Front. Cell Dev. Biol. 2022 Jan 3.
doi: 10.3389/fcell.2021.790386.
题目
Bridging the Gap: Connecting the Mechanisms of Immune-Related Adverse Events and Autoimmunity Through PD-1
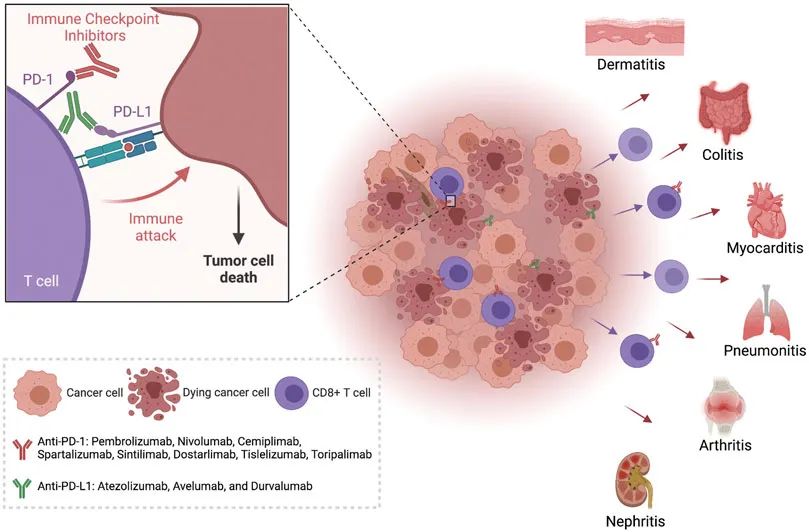
The emergence of anti–cytotoxic T-lymphocyte antigen 4 (anti-CTLA-4), anti–programmed cell death 1 ligand (anti–PD-1), and anti–PD-L1 antibodies as immune checkpoint inhibitors (ICIs) revolutionized the treatment of numerous types of tumors. These antibodies, both alone and in combination, provide great clinical efficacy as evidenced by tumor regression and increased overall patients’ survival. However, with this success comes multiple challenges. First, while patients who respond to ICIs have outstanding outcomes, there remains a large proportion of patients who do not respond at all. This all-or-none response has led to looking downstream of programmed cell death 1 (PD-1) for additional therapeutic targets and for new combination therapies. Second, a majority of patients who receive ICIs go on to develop immune-related adverse events (irAEs) characterized by end-organ inflammation with T-cell infiltrates. The hallmarks of these clinically observed irAEs share many similarities with primary autoimmune diseases. The contribution of PD-1 to peripheral tolerance is a major mechanism for protection against expansion of self-reactive T-cell clones and autoimmune disease. In this review, we aim to bridge the gaps between our cellular and molecular knowledge of PD-1 signaling in T cells, ICI-induced irAEs, and autoimmune diseases. We will highlight shared mechanisms and the potential for new therapeutic strategies.