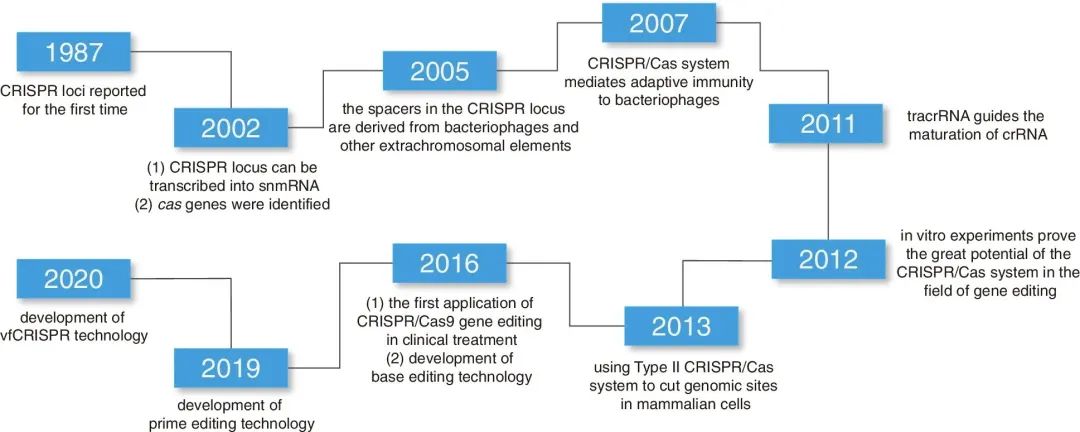
图1 CRISPR/Cas9系统开发和相关基因编辑工具发展史(Wang et al. 2022)。
近年来,CRISPR/Cas9系统越来越多地应用于各种疾病的研究和治疗,其中癌症的发生和发展涉及一系列基因的突变和失调,包括致癌基因、抑癌基因、化疗耐药基因、代谢相关基因以及肿瘤干细胞相关基因等等,癌症治疗的最终目标是通过特异性纠正突变和恢复失调基因的表达来抑制肿瘤的生长和进展,并取得了显著成果,接下来就和小编一起去看看CRISPR/Cas9基因编辑技术在肿瘤研究中都有哪些应用,其应用前景又如何呢?
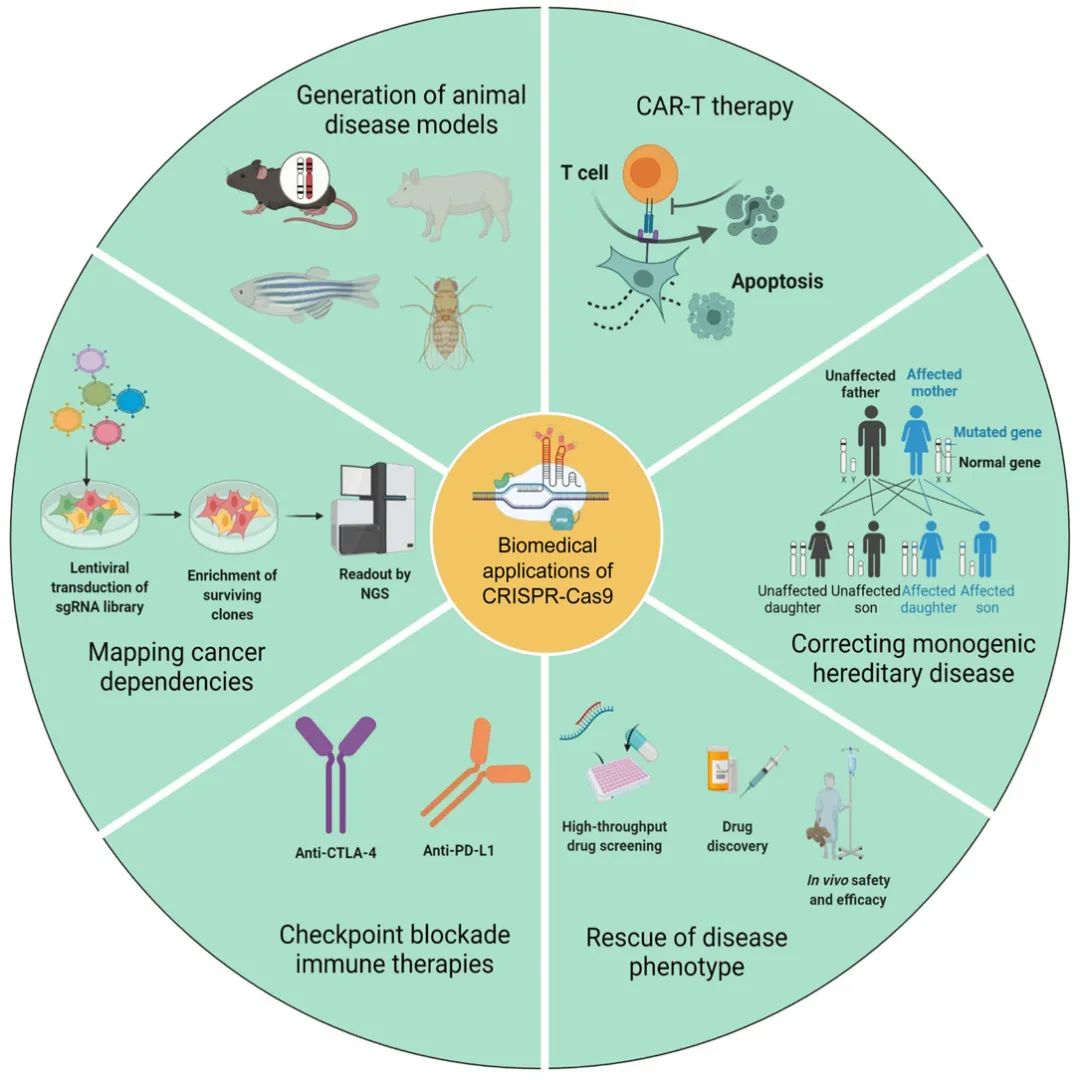
图2 CRISPR/Cas9主要应用范围示意图(Bhattacharjee et al. 2022)。
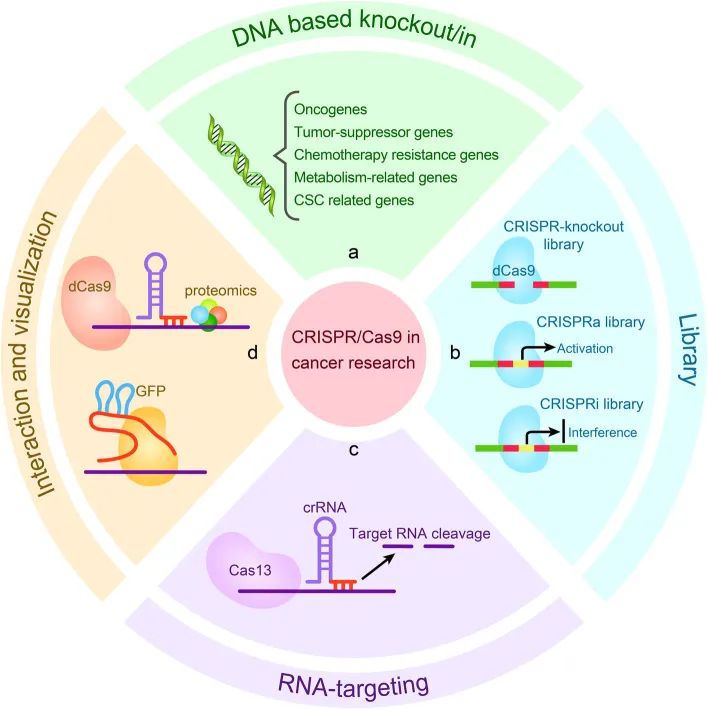
众所周知,癌基因与正常基因的调控方式不同,可促进正常细胞的恶性转化,而CRISPR/Cas9系统为缺失、干扰表达和改变癌基因的活性提供了有效措施,从而抑制了肿瘤的生长(Zhang et al. 2021)。系列研究表明,CRISPR/Cas9基因编辑系统是识别致癌基因与评估靶向治疗的有效工具(图3)。
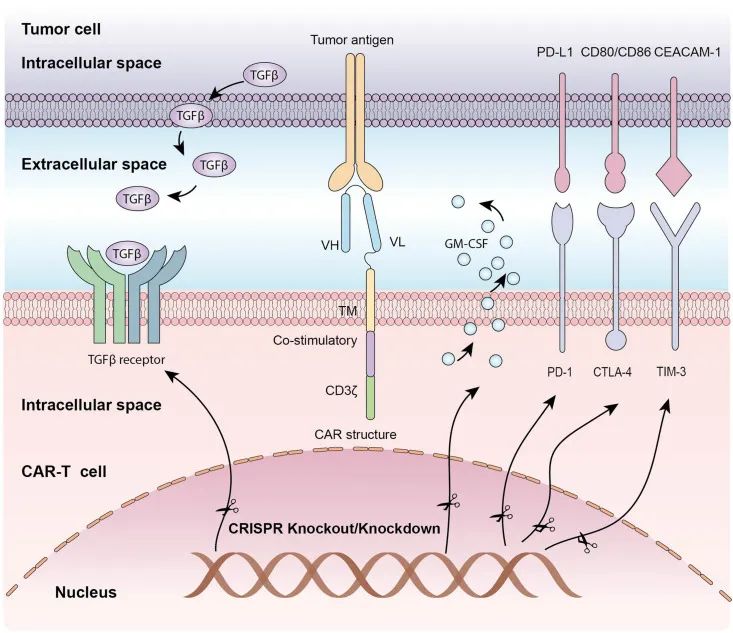
继2017年FDA批准两种自体CAR-T细胞疗法后,多项临床试验表明CAR-T细胞疗法对多种血液和非血液性恶性肿瘤有效,但临床应用仍存在局限性,而CRISPR基因组编辑是解决这些限制的方法(图4)。最新研究指出,CRISPR疗法可用于靶向CD19和CD70定向的CAR-T细胞,用于治疗实体瘤,白血病和淋巴瘤(Bhattacharjee et al. 2022)。
图4 CRISPR/Cas9系统在CAR-T细胞编辑中的应用(Ou et al. 2021)。
2、转基因T细胞受体(TCR)-T细胞疗法
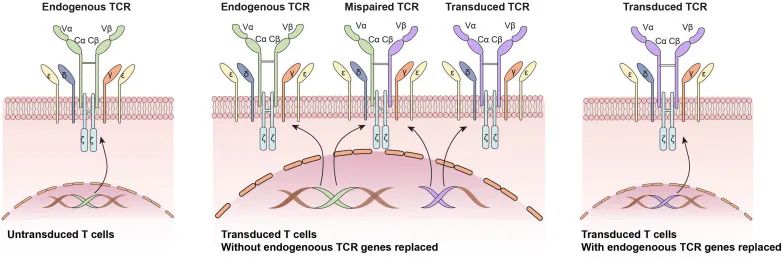
临床试验表明,CAR-T细胞疗法在实体瘤中效果有限,主要是由于缺乏肿瘤特异性抗原、肿瘤异质性和抑制性免疫TME。CRISPR/Cas9介导的从T细胞中敲除内源性TCR-β,同时进行癌症反应性受体转导,显著增加了转基因TCR(tgTCR)的表达,增强了工程化T细胞对目标癌细胞的杀伤作用(图5)。与标准TCR转导的T细胞相比,TCR转导和CRISPR修饰的T细胞对抗原的敏感性要高一千倍。
2020年的第一个Ⅰ期人体临床试验报道了使用多重CRISPR/Cas9编辑靶向T细胞靶基因以改善抗肿瘤免疫反应,并引入一种合成的癌症特异性TCR转基因(识别肿瘤细胞。注入患者体内的工程T细胞在体内持续存在长达9个月,初步表明TCR转移和基因组编辑的结合可能会开发出更有效和更安全的癌症免疫疗法(Stadtmauer et al. 2020)。
3、PD-1/PD-L1靶向治疗
PD-L1是一种重要的免疫抑制分子,在多种免疫细胞和癌细胞中表达,可下调免疫系统,避免自身免疫性疾病。通过使用适体/肽功能化载体敲除β-连环蛋白,将CRISPR/Cas9质粒递送至肿瘤细胞核,可下调肿瘤细胞上PD-L1的表达。
4、对抗致癌病毒感染
CRISPR/Cas9系统在细菌适应性免疫中具有抗病毒作用,因此其在防御和清除受感染病毒方面具有巨大潜力。使用可特异性识别病毒基因组的Cas9-sgRNA,直接靶向致癌病毒基因或维持病毒复制所需的基因,导致病毒基因组发生突变并抑制致癌病毒基因表达,从而诱导癌细胞死亡。
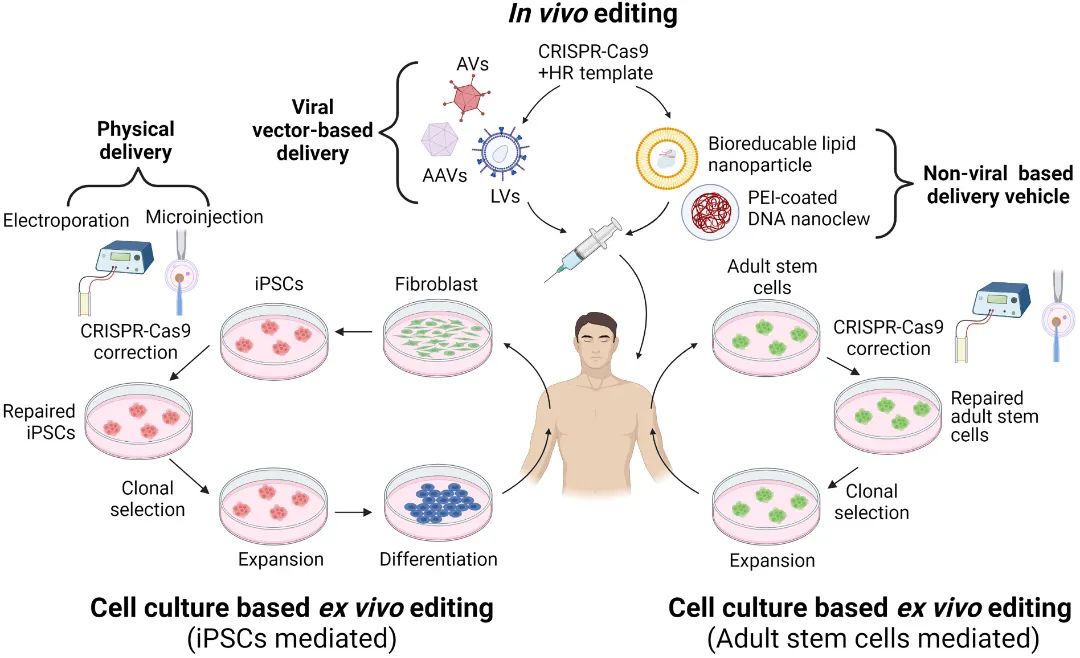
对于直接递送的体内编辑包括直接引入病毒载体,如携带Cas9和gRNA表达载体的腺病毒(AV)、腺相关病毒(AAV)、慢病毒(LV)载体,以及患者体内的治疗模板;除病毒载体外,还可通过非病毒载体如生物可还原脂质纳米颗粒或聚乙烯亚胺(PEI)包被的DNA纳米片递送Cas9、gRNA和同源重组(HR)模板。
对于基于细胞培养的离体编辑,主要为将从患者体内分离的成纤维细胞诱导转化为诱导多能干细胞(iPSC),然后对其进行CRISPR/Cas9基因编辑,并在分化后移植到体内;也可针对成体干细胞使用相同策略,即通过CRISPR/Cas9技术对从患者体内分离的细胞进行重编程,并在扩大培养后重新引入患者体内。
Ou X, Ma Q, Yin W, et al. CRISPR/Cas9 Gene-Editing in Cancer Immunotherapy: Promoting the Present Revolution in Cancer Therapy and Exploring More. Front Cell Dev Biol. 2021;9:674467.
Stadtmauer EA, Fraietta JA, Davis MM, et al. CRISPR-engineered T cells in patients with refractory cancer. Science. 2020;367(6481):eaba7365.
Wang SW, Gao C, Zheng YM, et al. Current applications and future perspective of CRISPR/Cas9 gene editing in cancer. Mol Cancer. 2022;21(1):57.
Zhang H, Qin C, An C, et al. Application of the CRISPR/Cas9-based gene editing technique in basic research, diagnosis, and therapy of cancer. Mol Cancer. 2021;20(1):126.