2022年3月7日,德国慕尼黑中风和痴呆研究所(ISD)Martin Dichgans团队在世界心血管三大杂志之一的European Heart Journal上发表了题为“Targeting the CCL2–CCR2 axis for atheroprotection”的综述性论文。在本文中,作者总结了CCL2-CCR2信号轴作为心血管疾病新兴药物靶标的证据,我们一起来看看吧。
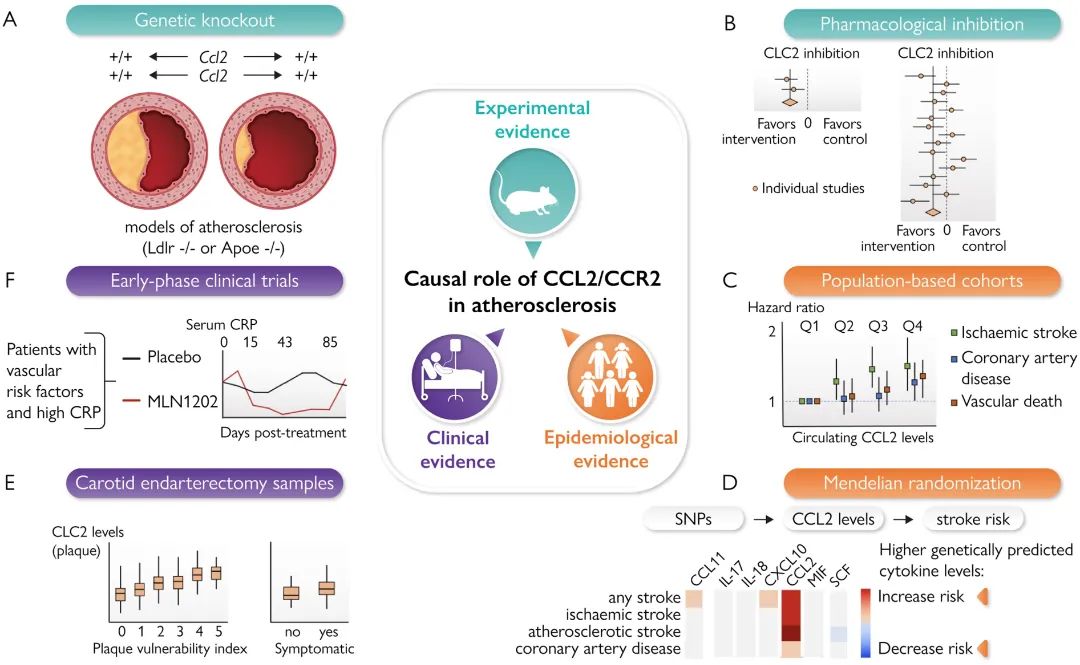
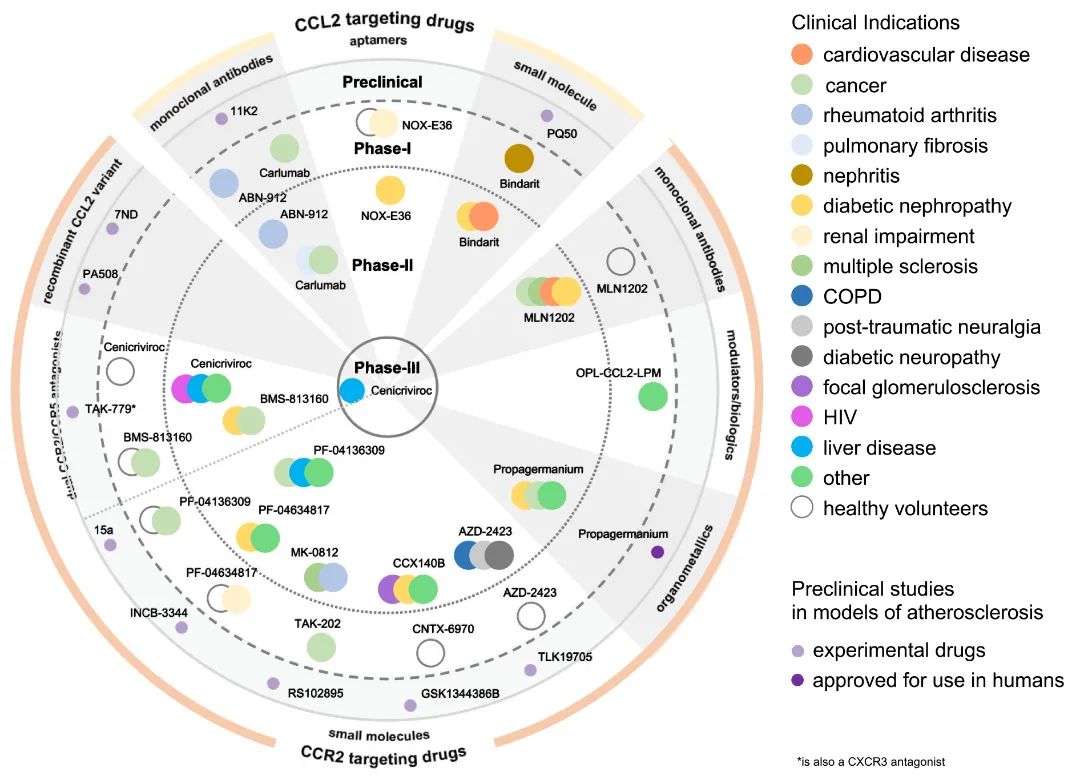
最近大规模临床试验为CVD的抗炎疗效提供了验证,同时也强调了选择合适途径和候选药物的重要性。大量的实验以及遗传和流行病学证据解释了CCL2-CCR2信号轴在动脉粥样硬化疾病中的因果作用。与此同时,这些蛋白药理学靶向的重大进展为逐步过渡到临床试验带来了希望。并且,单核细胞募集对动脉粥样硬化病变的生物学作用,以及其在动脉粥样硬化中的因果作用,为将CCL2-CCR2信号轴作为CVD下一代抗炎靶标提供了强大的理论支撑。
注:除了对单核细胞具有强烈的趋化作用外,在某些条件下也发现CCL2对趋化性T细胞、B细胞、自然杀伤性细胞、嗜碱性粒细胞和嗜中性粒细胞的作用较弱,但这种作用在动脉粥样硬化中的作用尚未确定。
在发现CCL2作为单核细胞趋化分子并证明其在人动脉粥样硬化病变中高度表达后,研究人员发现,与Apoe-/-对照小鼠相比,Ccr2-/-/Apoe-/-小鼠显示动脉粥样硬化病变减少和斑块中巨噬细胞积聚减少。此外,将CCR2-/-骨髓祖细胞移植到易发生动脉粥样硬化的载脂蛋白E3-Leiden转基因小鼠中可抑制动脉粥样硬化病变的形成。当使用靶向CCL2或CCR2的药理学试剂时,对动脉粥样硬化病变大小和斑块形态的影响相同。
2、观察和遗传流行病学研究
首先,在对1199名接受动脉内膜切除术治疗晚期颈动脉狭窄的患者数据进行分析后,发现斑块内的CCL2水平与斑块不稳定性标志物显著相关,具体而言,它们与较高的巨噬细胞含量、较大的脂质核心、斑块内出血、较低的平滑肌和胶原含量以及促炎斑块特征相关。
3、早期临床试验
目前,唯一经过测试的两种药物是小分子药物粘合剂和单克隆抗体MLN1202。Bindarit是一种抑制CCL2产生的吲唑啉衍生物,并在148名使用裸金属支架进行冠状动脉支架术的患者的II期试验中用于预防再狭窄。
第二项研究是一项II期临床试验,在108例有CVD危险因素的患者中测试了抗CCR2单克隆抗体MLN1202。
关键词:Vascular inflammation, Chemokines, Monocyte-chemoattractant protein-1, Atherosclerosis, Coronary artery disease