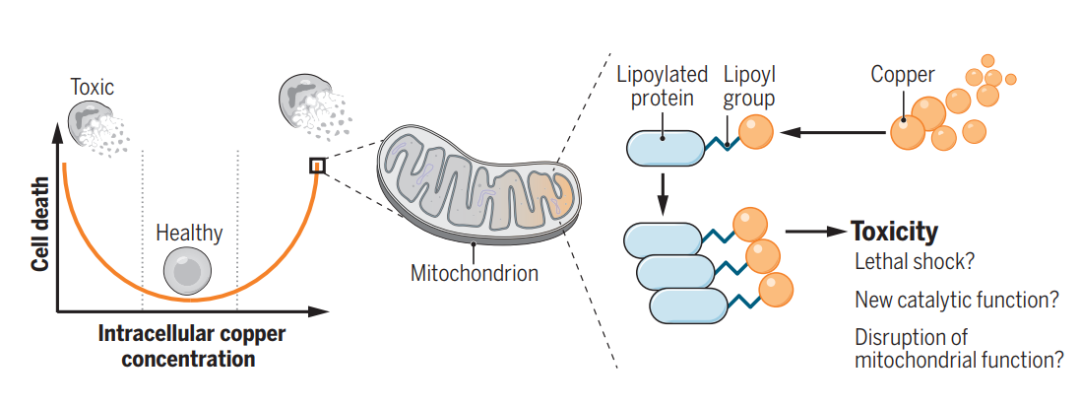
2022年3月17日,麻省理工学院和哈佛大学Broad研究所的Peter Tsvetkov和Todd R. Golub团队在Science上在线发表了“Copper induces cell death by targeting lipoylated TCA cycle proteins”一文,确定了促进铜诱导死亡的关键基因——FDX1,并将这种铜离子载体诱导的细胞死亡新形式命名为“铜死亡”即Cuprotosis,开启细胞死亡机制研究新方向。
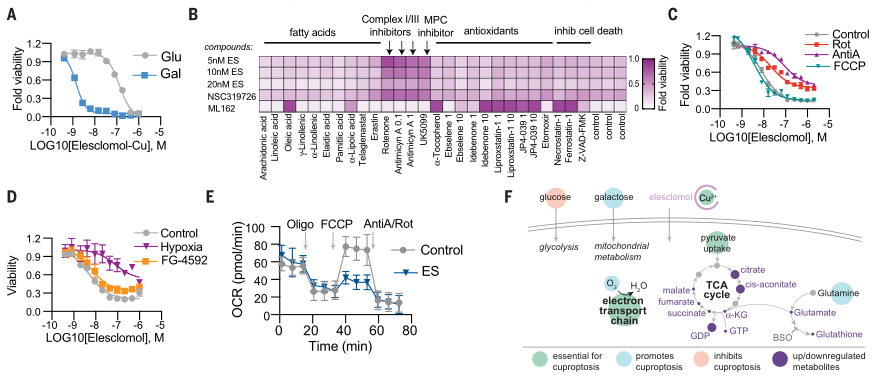
为了进一步确定铜离子载体的细胞毒性是否依赖于铜本身,作者分析了铜离子载体杀伤潜力(图2A、B),以及铜离子载体介导的细胞死亡是否受调节,特别是短期暴露是否会导致不可逆的细胞毒性(图2C)。接下来,作者又深入探索了铜离子载体诱导细胞死亡的类型,发现其不同于已知的细胞死亡途径与机制(图2)。
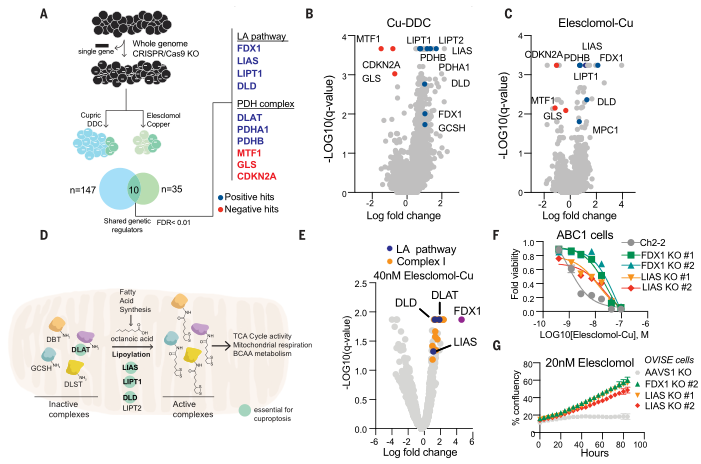
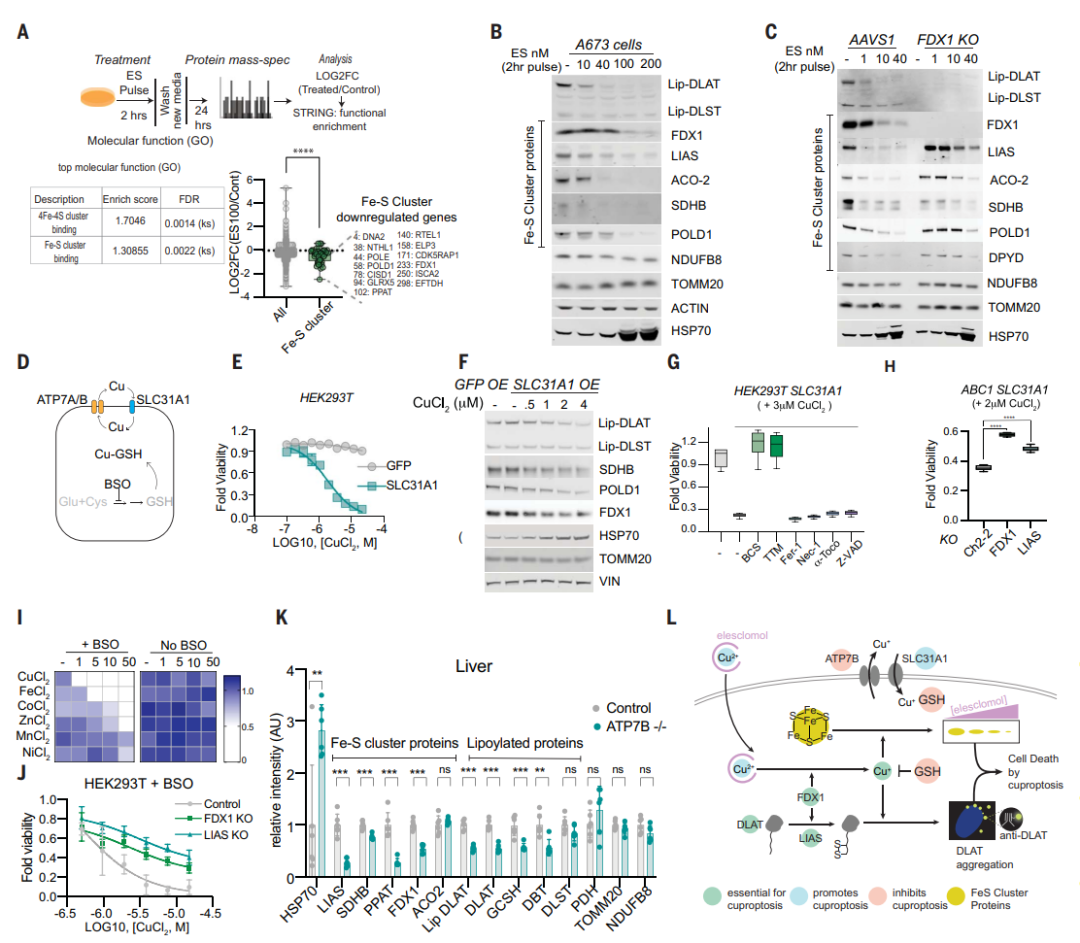
(1)查找癌症依赖图(Cancer Dependency Map)之间协调依赖性的证据,发现FDX1和硫辛酸途径成分在整个细胞系中的生存力影响高度相关(图5A);
(2)对208例人类肿瘤标本中的FDX1和硫辛酸进行免疫组织化学染色以及半定量光学显微镜评分,发现FDX1与脂酰化蛋白表达高度相关(图5B、C);
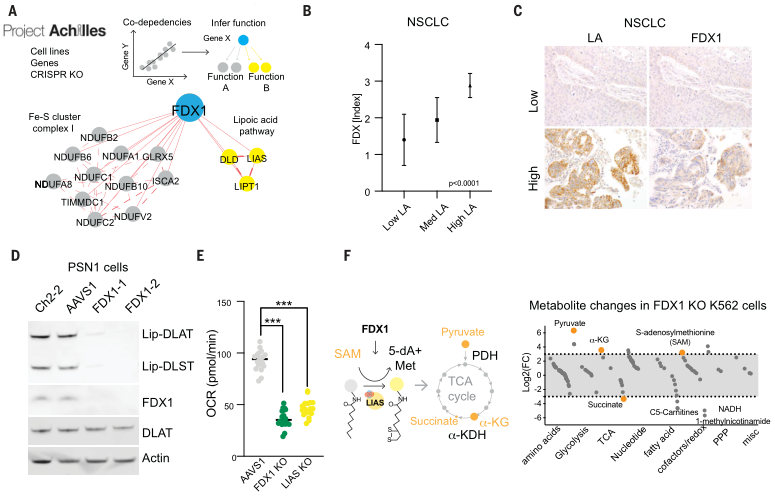
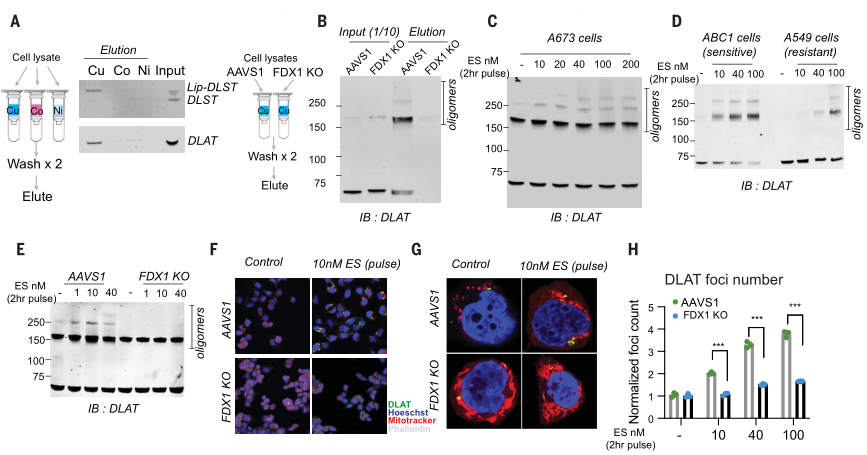
类似地,针对铜离子载体敏感细胞的处理,增加了DLAT寡聚体和不溶性DLAT水平,而针对铜离子载体不敏感细胞系或FDX1敲除细胞的处理,仅在高浓度下才可导致DLAT寡聚化(图6D、E),且以上结果通过免疫荧光得以证实(图6F-H)。综上,这些发现支持暴露于铜离子载体后脂酰化蛋白功能的毒性增加至少部分由其异常寡聚化介导。这些发现与在细菌和酵母中观察到的铜可以破坏含Fe-S蛋白质的稳定性是一致的。
这些在铜毒性小鼠模型中的发现表明,铜过载导致的细胞效应与铜离子载体诱导的细胞效应相同。
总之,团队的所有数据支持过量铜可促进脂酰化蛋白的聚集以及Fe-S簇蛋白的不稳定,导致蛋白毒性应激并最终导致细胞死亡(图7L)。至此,团队建议将这种先前从未表征的细胞死亡机制称为铜死亡(cuproptosis)。
Rowland EA, Snowden CK, Cristea IM. Protein lipoylation: an evolutionarily conserved metabolic regulator of health and disease. Curr Opin Chem Biol. 2018;42:76-85.
Solmonson A, DeBerardinis RJ. Lipoic acid metabolism and mitochondrial redox regulation. J Biol Chem. 2018;293(20):7522-7530.
Tsvetkov P, Coy S, Petrova B, et al. Copper induces cell death by targeting lipoylated TCA cycle proteins. Science. 2022;375(6586):1254-1261.