手机又找不到了,钥匙放哪儿了!那个谁谁谁叫什么名字来着?转身是要去干什么来着?人一旦上了年纪,就会出现诸如此类丢三落四、记忆力下降、反应迟钝等问题,也就是常说的“认知功能下降”,这给老年人的日常生活带来了诸多烦恼。
到底是什么原因导致“老来糊涂”、“老人爱忘事”呢?
本糕(根据既往好多好多科学研究和好多好多文献报道)盲猜:肠道菌群!
一提到肠道菌群,奇点糕还是有那么亿点点激动,毕竟“肠脑轴”、“肠道是人体的第二大脑”可不是随便喊出来的。
这不,科学家们又在“肠脑轴”上发现了重磅级信息——
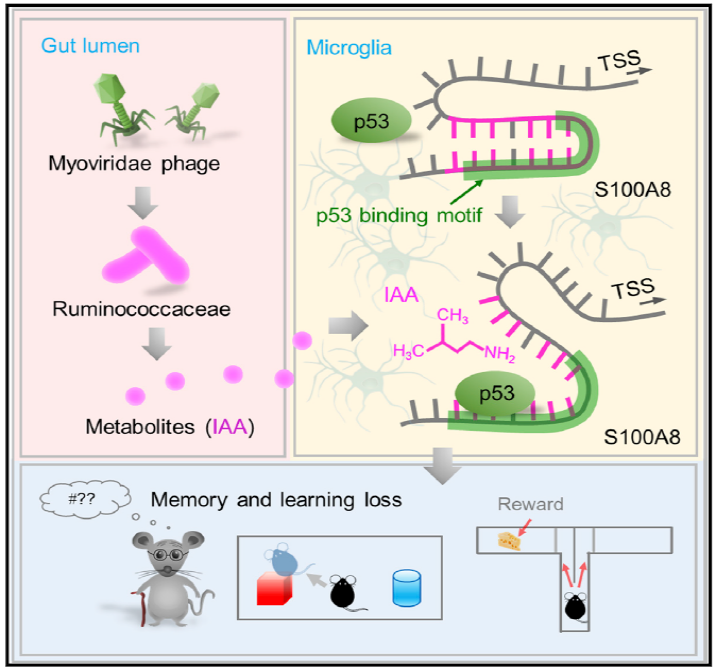
近日,路易斯维尔大学Huang-Ge Zhang团队在《细胞》的旗下子刊Cell Host & Microbe杂志上发表重要研究成果[1],他们发现肠菌的特定代谢产物竟会导致认知功能障碍!在衰老过程中,占比增加的瘤胃球菌科可产生代谢物异戊胺(IAA),调节促炎和促凋亡因子S100A8的表达,介导小胶质细胞凋亡,最终促进认知功能下降;通过瘤胃球菌特异性噬菌体—肌尾噬菌体抑制肠菌“作怪”,则可以改善认知功能!
衰老伴随着肠道菌群改变和认知功能衰退,但衰老相关的菌群变化如何调节认知功能?肠道菌群代谢产物在衰老过程中起着什么样的调节作用呢?
我们对此知之甚少。
为此,该研究团队深入探讨了肠道菌群及其代谢产物对衰老相关认知功能的作用及影响。
让我们一起来看看实验是如何开展的吧。
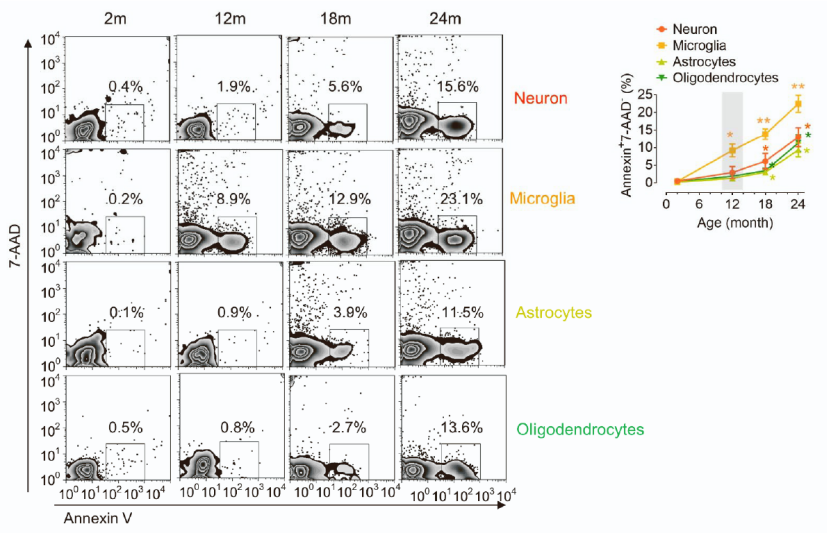
大脑神经元、少突胶质细胞、小胶质细胞及星型胶质细胞是参与调节认知功能的重要组成部分[3]。为了筛选出与认知功能障碍最相关的细胞类型,该研究首先通过比较2月龄、12月龄、18月龄、24月龄的小鼠大脑各种细胞的凋亡程度,发现小胶质细胞凋亡最明显,也是最早出现凋亡现象的神经细胞类型(12月龄时就出现明显的差异)。
因此,小胶质细胞是在衰老过程中最早出现凋亡的中枢神经细胞类型,也是调节大脑认知功能最关键的细胞。
不同神经细胞随小鼠年龄的凋亡情况
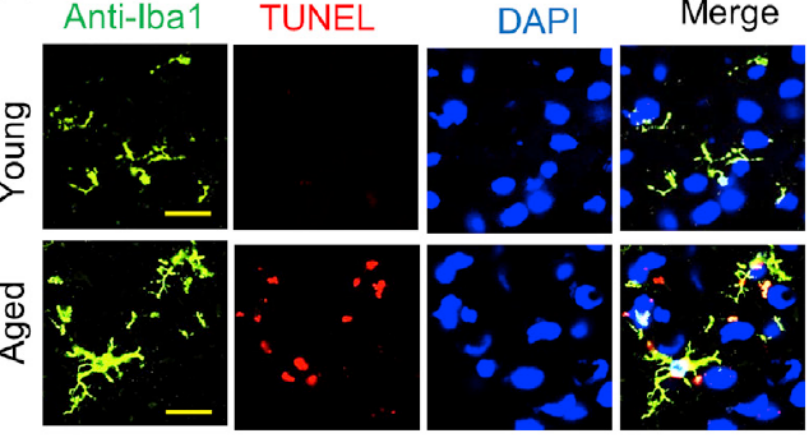
通过qPCR和WB分析进一步验证只有S100A8和S100A9在衰老小鼠小胶质细胞中高表达。同时,TUNEL染色及caspase-3在小胶质细胞中高表达说明衰老小鼠的小胶质细胞存在凋亡现象。
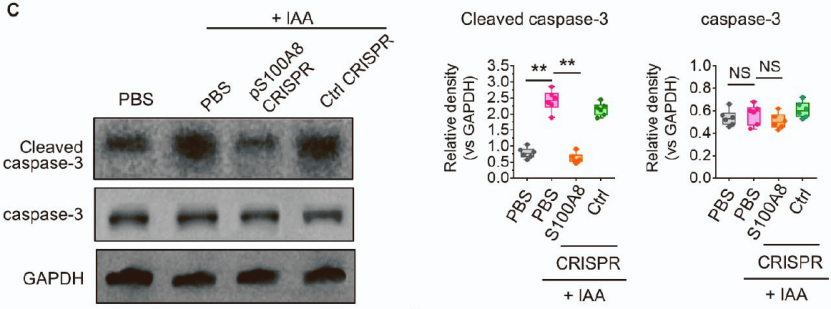
S100A8和S100A9形成的异源二聚体可以促进小胶质细胞的凋亡和多种炎症因子的释放,与认知功能和衰老密切相关[4]。为了进一步研究S100A8/A9与小胶质细胞凋亡之间的关系,作者结合细胞实验,通过CRISPR-Cas9技术分别敲除和过表达小胶质细胞中S100A8和S100A9,发现只有S100A8对小胶质细胞的凋亡有调控作用,而S100A9对小胶质细胞不存在调节作用。
以上说明在衰老过程中S100A8的上调促进小胶质细胞凋亡。
衰老小鼠大脑中的小胶质细胞凋亡增加
由于肠道菌群可以通过分泌多种代谢产物影响宿主的神经功能[5],为了探讨在衰老过程中肠道菌群代谢产物是否促进小胶质细胞的凋亡,作者通过代谢组学技术和高效液相色谱分析技术比较了无菌小鼠(GF级)和常规小鼠(SPF级)肠道中代谢产物的差异,发现肠源性代谢产物IAA浓度在SPF级衰老小鼠中增加,而在无菌小鼠中这种变化并不明显。
并且在衰老小鼠中IAA的浓度变化与大脑S100A8的表达正相关。
在提取的小胶质细胞中添加IAA可以促进凋亡指标caspase-3上调,但敲除S100A8可以逆转IAA对小胶质细胞的促凋亡作用。
以上说明在衰老过程中,肠道菌群代谢产物IAA与S100A8上调密切相关,IAA可以通过S100A8促进小胶质细胞凋亡。
IAA通过S100A8促进小胶质细胞凋亡
顺藤摸瓜,为了进一步确定调节衰老与认知最关键的肠道微生物,作者纳入健康的年轻受试者和老年受试者,运用高通量测序分析比较两组人群中肠道菌群的结构差异,发现瘤胃球菌科在老年人群中高度富集。
与人群的研究相一致的是,衰老小鼠的瘤胃球菌也高度富集!
考虑到肠道菌群噬菌体在塑造肠道菌群组成中具有重要的调节作用[6],本研究运用Virus-Host DB和qPCR技术发现肌尾噬菌体是影响瘤胃球菌科组成的关键噬菌体。
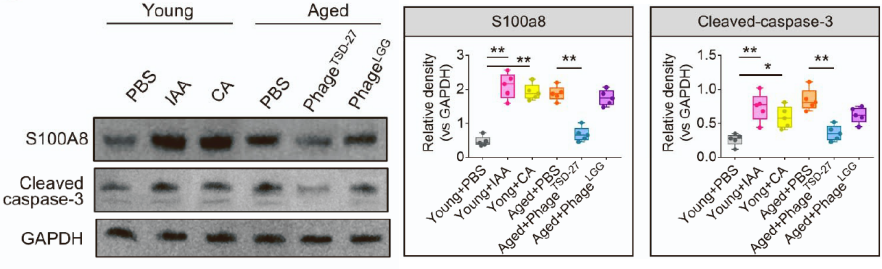
提取并接种年轻受试者粪便中的瘤胃球菌科特异性噬菌体(phageTSD-27),灌胃给衰老小鼠后,可以抑制小鼠体内瘤胃球菌科的相对丰度,降低IAA的浓度,并且衰老小鼠的小胶质细胞中S100A8及caspase-3的表达在补充噬菌体后也下降。
以上说明,在衰老情况下,肌尾噬菌体减少,导致瘤胃球菌科相对丰度增加,代谢产物IAA增多,诱导S100A8的表达上调,促进小胶质细胞凋亡。
噬菌体phageTSD-27逆转衰老引起的S100A81及caspase-3表达上调
但是到底IAA怎么作用于S100A8的呢?
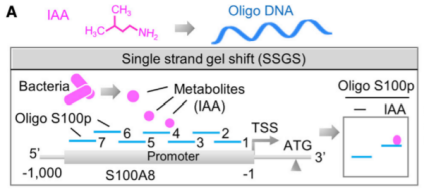
为了回答这一问题,作者运用单链凝胶转移技术(SSGS)、表面等离子共振分析和DNA解链实验,发现IAA识别并结合到S100A8启动子区域,促进发夹结构展开,暴露转录因子p53的结合位点,使p53结合到S100A8启动子并增加S100A8的表达,促进小胶质细胞发生凋亡。
也就是说,从肠道菌群释放的小分子能够直接结合基因组DNA,作为转录辅助调控因子,招募转录因子在基因启动子区的聚集,从而促进基因的表达。
鉴定IAA结合S100A8的启动子区域
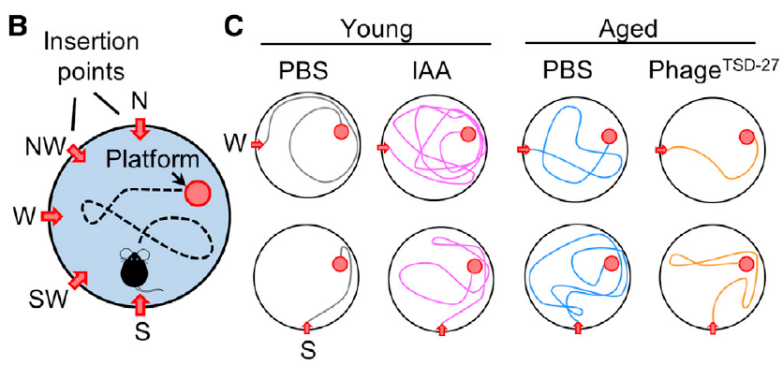
在本研究的最后,作者通过给年轻小鼠灌胃IAA,运用水迷宫实验(MWM)、T字迷宫交替实验(TMSA)、新事物辨别实验(NOR)评估年轻小鼠的认知功能,发现IAA灌胃后年轻小鼠的认知功能明显下降。
而给衰老小鼠灌胃噬菌体phageTSD-27可以改善小鼠的学习记忆能力,脑组织中促炎和促凋亡指标S100A8和caspase-3的表达在IAA补充后上调,phageTSD-27补充后下调。
以上说明补充IAA确实促进认知功能障碍,而通过噬菌体也确实可以改善认知功能。
Morris水迷宫实验证实IAA和噬菌体对认知功能障碍的调节作用
衰老导致瘤胃球菌科相对丰度增加,肠源性代谢产物IAA升高,IAA与S100A8结合促进小胶质细胞凋亡,引起认知功能障碍;肌尾噬菌体可抑制瘤胃球菌科,逆转衰老引起的认知功能障碍
所以,要想保持“年轻”的大脑,咱先想办法保证菌群“不老”!
参考文献:
[1]. Teng Y, Mu J, Xu F, et al. Gut bacterial isoamylamine promotes age-related cognitive dysfunction by promoting microglial cell death [published online ahead of print, 2022 May 25]. Cell Host Microbe. 2022;S1931-3128(22)00265-7. doi:10.1016/j.chom.2022.05.005
[2]. Doulberis M, Papaefthymiou A, Polyzos SA, et al. Microbes and Alzheimer’ disease: lessons from H. pylori and GUT microbiota. Eur Rev Med Pharmacol Sci. 2019;23(5):1845-1846. doi:10.26355/eurrev_201903_17218
[3]. Bernard-Patrzynski F, Lécuyer MA, Puscas I, et al. Isolation of endothelial cells, pericytes and astrocytes from mouse brain. PLoS One. 2019;14(12):e0226302. Published 2019 Dec 18. doi:10.1371/journal.pone.0226302
[4]. Mattei D, Notter T. Basic Concept of Microglia Biology and Neuroinflammation in Relation to Psychiatry. Curr Top Behav Neurosci. 2020;44:9-34. doi:10.1007/7854_2018_83
[5]. Liberti J, Engel P. The gut microbiota – brain axis of insects. Curr Opin Insect Sci. 2020;39:6-13. doi:10.1016/j.cois.2020.01.004
[6]. Sausset R, Petit MA, Gaboriau-Routhiau V, De Paepe M. New insights into intestinal phages [published correction appears in Mucosal Immunol. 2020 Jan 31;:]. Mucosal Immunol. 2020;13(2):205-215. doi:10.1038/s41385-019-0250-5
文章来源:奇点网