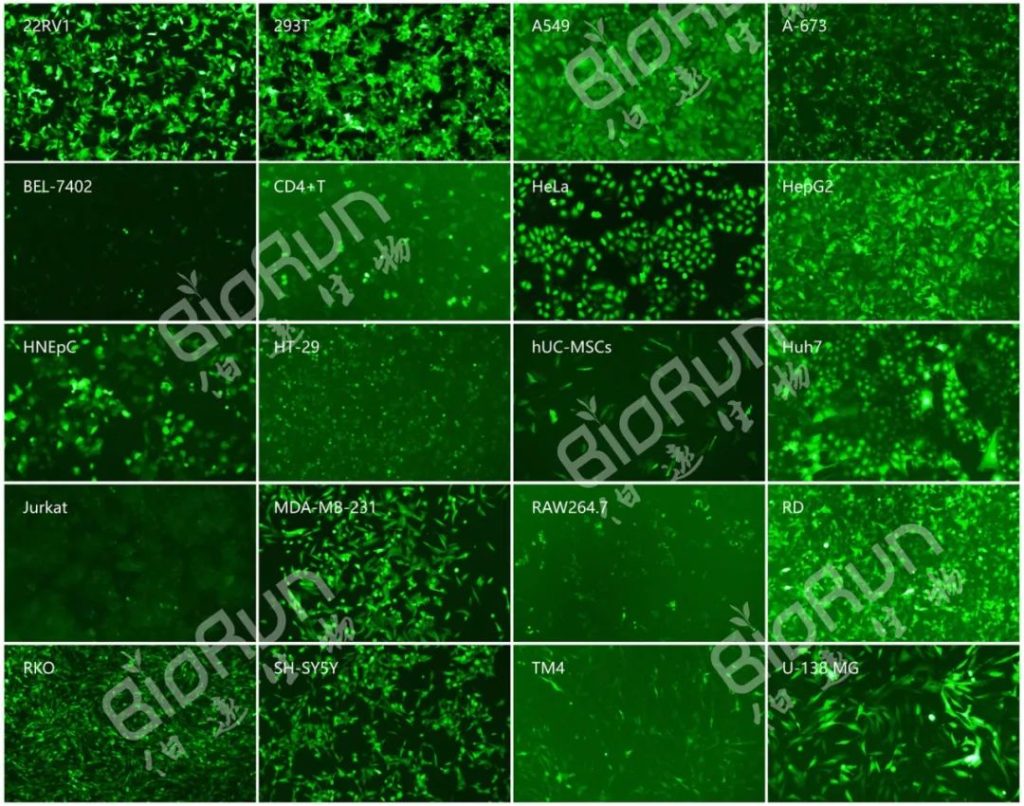
在之前发布的“叮咚!收下这份慢病毒包装的全攻略”和“慢病毒稳转细胞株的构建”两篇文章中,我们已经了解了慢病毒可以将外源基因有效地整合到宿主染色体上,从而可以在体内长期表达,且慢病毒可有效地感染包括几乎所有的哺乳动物细胞、干细胞和原代细胞。鉴于慢病毒的多种优点,使它成为了基因传递强大而有效的工具,也获得了广泛的应用。
当我们知道了慢病毒是如何包装的,当我们拿到了包装好的慢病毒之后,该怎么进行下一步操作呢?今天,小医就给大家分享一下拿到慢病毒后如何操作的详细步骤,满满的都是干货,快接着往下看吧!
慢病毒的储存与稀释
1.病毒的储存
包装好的慢病毒建议分装后置于-80℃冰箱保存,储存期限为半年。若超过半年,建议使用前重新测定滴度。若短时间内(3-5天)进行实验,也可置于4℃保存。另外,在病毒的使用过程中应尽量避免反复冻融,反复冻融会降低病毒滴度,可根据每次实验用量进行分装。
2.病毒的稀释
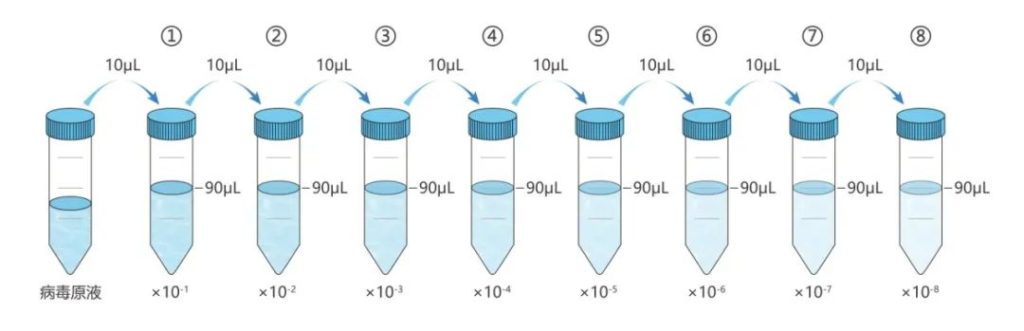
如需稀释病毒,可以先将病毒冰浴融化,再用PBS或不含血清的培养基稀释混匀后4℃保存,为保证病毒滴度,建议在3天内使用完毕。
慢病毒的使用
1.预实验摸索慢病毒的最佳MOI
每种细胞对慢病毒的敏感性不同,同时每种慢病毒载体荧光强度也有差异,所以在正式实验前需要通过预实验确定慢病毒对细胞的感染复数(multiplicity of infection,MOI)和最佳的感染条件,如接种的细胞量,感染时的总体积,感染后的换液时间,以确保正式实验达到理想的实验效果,并根据MOI和细胞数量计算后续实验所需的病毒量。
感染预实验步骤:
第1天, 将生长状态良好的目的细胞以1×104个/孔接种于96孔板中,放入37℃,5% CO2培养箱中培养过夜。接种细胞数量因细胞的生长速度而略有不同,一般以第2天细胞密度约30-50%为宜。
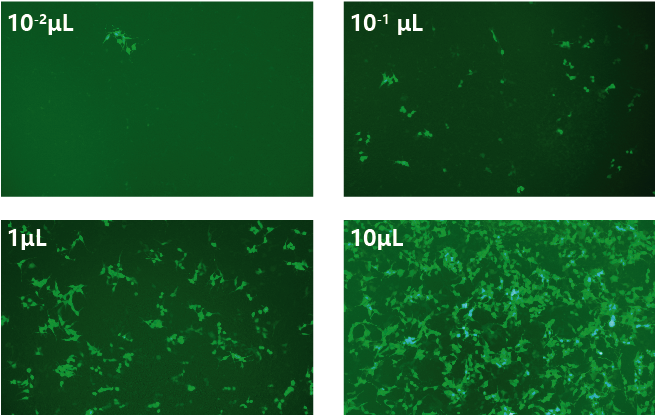
第2天,根据实验需要或文献参考的MOI值,设置梯度范围,一般为3-100。将从-80℃冰箱取出的病毒冰浴融化,假设病毒滴度为1×108TU/mL,按照MOI为5,10,30,50,100的梯度来算的话,则每孔分别需要加入病毒原液0.5μL,1μL,3μL,5μL,10μL。根据每孔需要加入的病毒原液及复孔数用培养基配置病毒稀释液,保证每孔加入体系为100µL。另外可同时设计含有Polybrene的培养基实验组以及空细胞组(即Blank组)。
注:慢病毒原液添加量=(感染细胞数×MOI)/病毒滴度×103(单位:μL)
第3天,更换培养液,一般在病毒感染16-24h后将含有慢病毒的培养液更换成正常培养液,继续培养。
第4-5天,感染效率检测,使用倒置荧光显微镜观察感染48h-72h后的荧光并拍照,对比细胞明场及荧光估计慢病毒感染目的细胞的效率,最后确定合适的MOI值用于正式实验。
2.慢病毒感染目的细胞
预实验确定慢病毒对靶细胞的亲嗜性以及合适的MOI值后,可进行正式感染实验,以24孔板中用含有GFP荧光标记和Puromycin抗性的慢病毒感染细胞为例,具体操作步骤如下:
(1)第一天按实验需要将细胞铺板,24孔板一般以5-10×104cells/孔的密度,细胞数以第二天密度约50%为宜,37℃培养过夜。
(2)第二天感染前,从-80℃冰箱取出病毒后冰浴融化,根据预实验得到的MOI值用新鲜完全培养基将病毒稀释成所需浓度,注:轻轻混匀,不要使用振荡器。
(3)吸去细胞原有培养基,将按照MOI稀释好的病毒液加入细胞中,并根据预实验结果确定是否需要添加Polybrene,如对细胞无影响,Polybrene可以和病毒原液一起加到培养基中,轻轻摇匀,37℃培养过夜。
(4)感染16-24h后,吸除含慢病毒的培养基,换为新鲜的培养基。注:具体感染时间可参考预实验感染中慢病毒对细胞状态的影响。
(5)继续培养至感染48-72h后,根据需要收集细胞检测目的蛋白的表达。
3.目的细胞稳转株的构建
(1)抗生素筛选
带有不同抗性的慢病毒在成功感染细胞后,能使细胞在含有一定浓度对应抗生素的培养基中存活,而未感染上慢病毒的细胞则无法存活。因此在抗性筛选压力下,可成功筛选稳定表达目的基因的细胞株。
如上述带有Puromycin抗性的慢病毒感染48-72h后(70-80%汇合度),将细胞继续培养于含适当浓度Puromycin的培养液中,每3-4天更换一次含抗生素的培养液,直至未感染病毒的对照组细胞被抗生素杀光,而感染病毒组再无细胞出现死亡(如病毒载体带有荧光标记,荧光效率需达到100%)后,进行多克隆及单克隆稳转株的筛选。
注:筛选浓度即为抗生素预实验中确定的该正常细胞被全部杀死时的最低浓度(全致死浓度),筛选时可设置未感染病毒的野生型细胞作为对照,加入等量浓度抗生素。
(2)稳转株的构建及保存
①多克隆稳转株筛选
将抗生素浓度降低至维持浓度(筛选浓度的1/2即半致死浓度,可有效抑制空细胞生长),继续对感染后的细胞进行筛选和扩增,同时收集细胞进行qPCR或Western Blot鉴定(鉴定目的基因表达水平),并将鉴定结果正常的细胞冻存保种。
②单克隆稳转株筛选
可对感染并筛选后的细胞进行稀释培养,挑取单一细胞生长而成的细胞克隆,再进行扩大培养, 以获得性状单一、表达稳定的细胞株。
将细胞消化后通过有限稀释或流式分选等方式接种于96孔板中,接种的细胞密度为1个细胞/孔。标记出具有单个细胞的孔,将抗生素浓度减至维持浓度,继续筛选和扩增。扩增完毕后收集细胞进行qPCR或Western Blot鉴定(鉴定目的基因表达水平),选择鉴定结果正常的单克隆细胞冻存保种。
注:不同细胞群体依赖性不同,可能由于细胞密度影响单个细胞无法正常增殖,可先用空细胞进行单克隆预实验确定细胞是否可正常增殖分裂。