研究背景
扩张型心肌病(Dilated Cardiomyopathy,DCM),又名扩心病,主要表现为心室扩大,心脏收缩功能下降,是心力衰竭的主要发病原因之一。虽然目前已经确定某些心肌结构基因突变可诱发DCM,但仍有大部分特发性和家族性DCM病理没有明显的致病遗传变异。研究表明,代谢应激反应的改变、心肌细胞凋亡、表观遗传修饰改变都可能参与到DCM发病过程。JMJD 家族(Jumonji C domain-containing family)蛋白是一种组蛋白脱乙酰酶,已被证明与许多心血管疾病有关,参与心肌肥大和心肌细胞纤维化过程。研究表明,靶向表观遗传修饰药物如组蛋白去乙酰化酶抑制剂已被证明具有较好的心肌病治疗效果。JMJD4是JMJD家族小蛋白成员,能够羟基化真核释放因子eRF1的赖氨酸残基促进翻译终止过程,并不具备JMJD家族成员的组蛋白修饰功能。目前关于JMJD4是否参与心肌细胞或DCM的能量代谢过程仍不清楚。
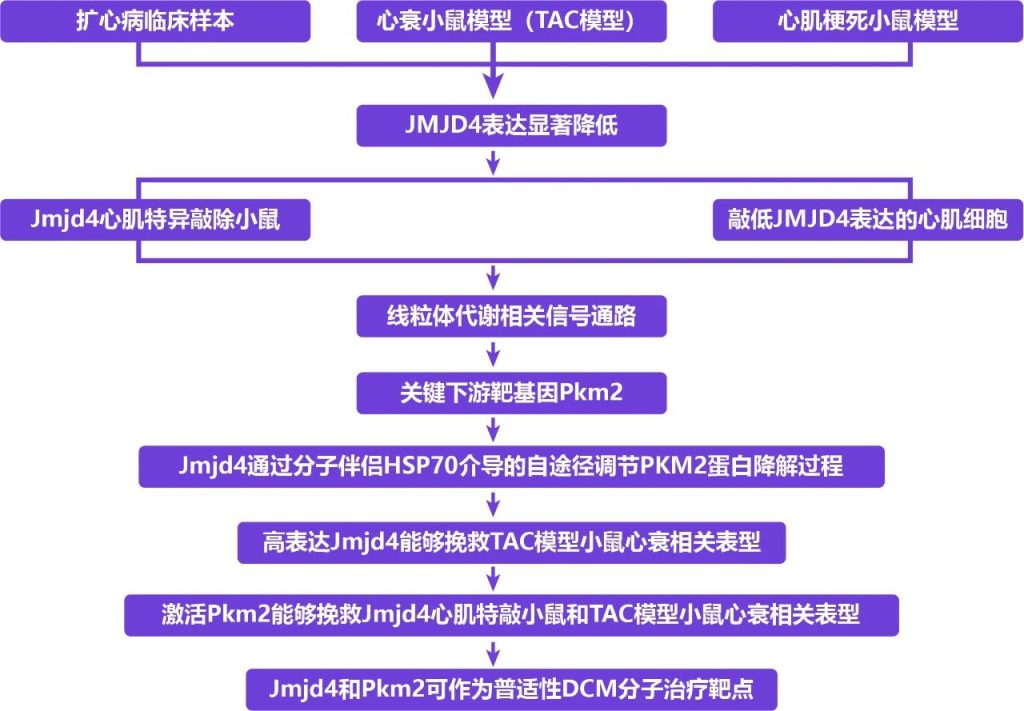
研究思路
研究结果
1、JMJD4在扩心病发生过程中表达显著降低
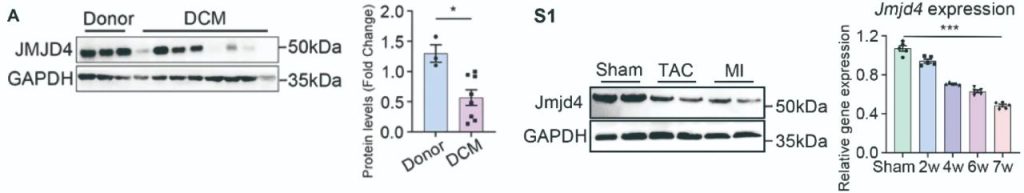
首先,作者分别在DCM患者心脏样本、TAC心衰小鼠模型以及心肌梗死小鼠模型中检测JMJD4的蛋白表达发现,JMJD4蛋白表达在扩心病发生过程中显著降低,表明JMJD4可能是DCM的响应蛋白(图1)。
2、敲除Jmjd4导致小鼠出现明显的扩心病以及心力衰竭表型
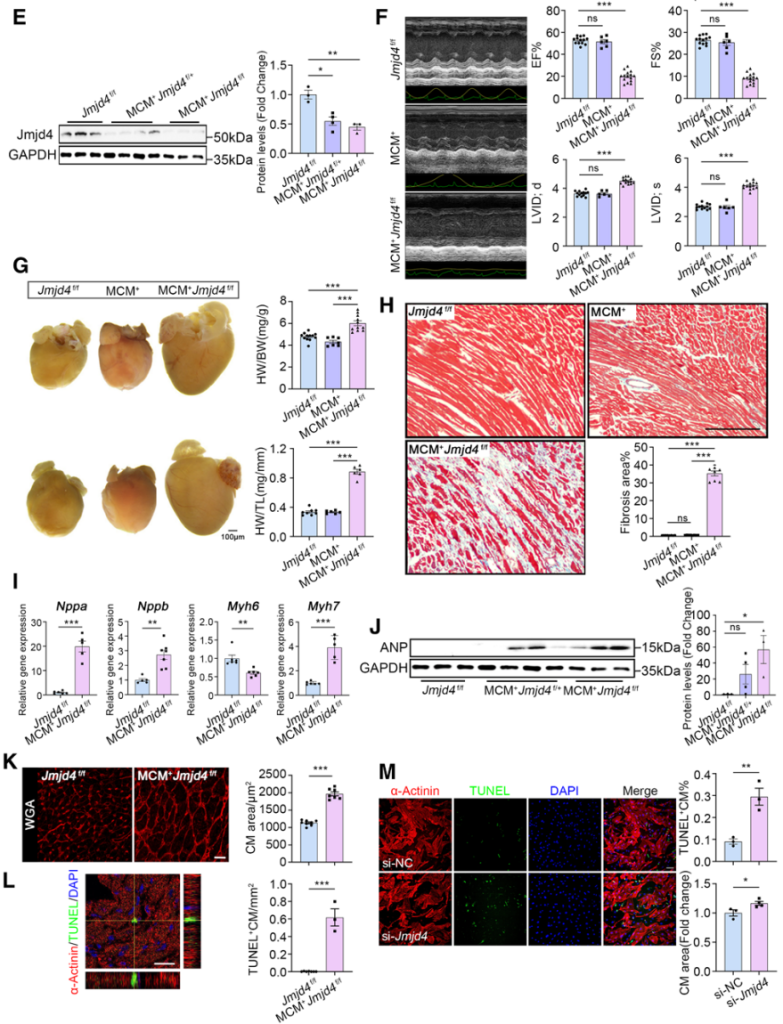
随后,作者构建了他莫昔芬诱导的Jmjd4心肌细胞特异性敲除小鼠。结果显示,成年小鼠经他莫昔芬诱导后出现明显的扩心病表型,如射血分数(EF)和左心室短轴缩短率(FS)显著降低,左心室舒张末期内径(LVID;d)和左心室收缩末期内径(LVID;s)显著增加(图2E-2F)。分离小鼠心脏组织发现,心肌细胞特异性敲除Jmjd4导致小鼠心脏明显变大,并且出现明显纤维化(图2G-2H)。此外,qRT-PCR结果显示心肌肥厚和心衰标记物Nppa、Nppb和Myh7表达显著增加,WB结果显示心房利钠肽ANP表达同样显著增加(图2I-2J)。免疫荧光结果显示,心肌细胞特异性敲除Jmjd4导致心肌细胞明显变大,细胞凋亡增多,并且这一结果在大鼠心肌细胞中同样得到验证(图2K-2M)。
3、敲除Jmjd4影响心肌细胞能量代谢过程
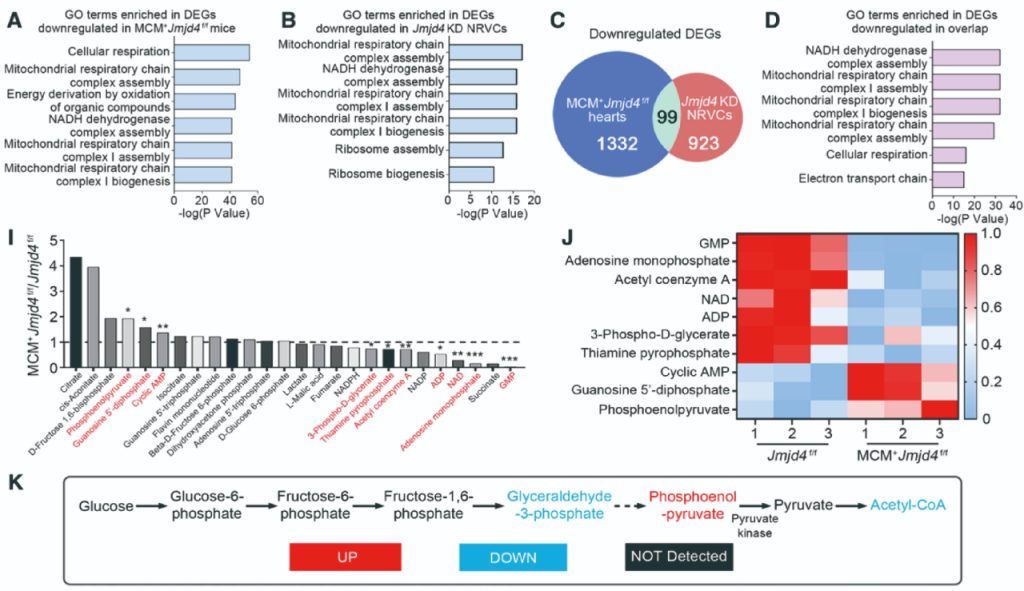
为了进一步探索Jmjd4参与扩心病发生过程的具体分子机制,作者对条件性心肌细胞特异敲除Jmjd4小鼠的心脏组织和体外敲减Jmjd4的大鼠心肌细胞NRVCs进行了转录组测序(RNA-seq)和靶向代谢组学分析。RNA-seq信号通路富集结果显示,差异表达基因主要富集在线粒体代谢相关的通路(图3A-3D)。靶向代谢组学分析结果显示,小鼠心肌细胞特异性敲除Jmjd4导致乙酰辅酶A(CoA)的产生显著减少,并且糖酵解过程中丙酮酸直接上游磷酸烯醇式丙酮酸(PEP)积累明显增多(图3I-3K)。上述结果表明小鼠心肌细胞特异性敲除Jmjd4影响丙酮酸代谢过程,使心肌细胞能量代谢出现紊乱,进而导致DCM的发生。
4、JMJD4与PKM2相互作用影响心肌细胞氧化代谢过程
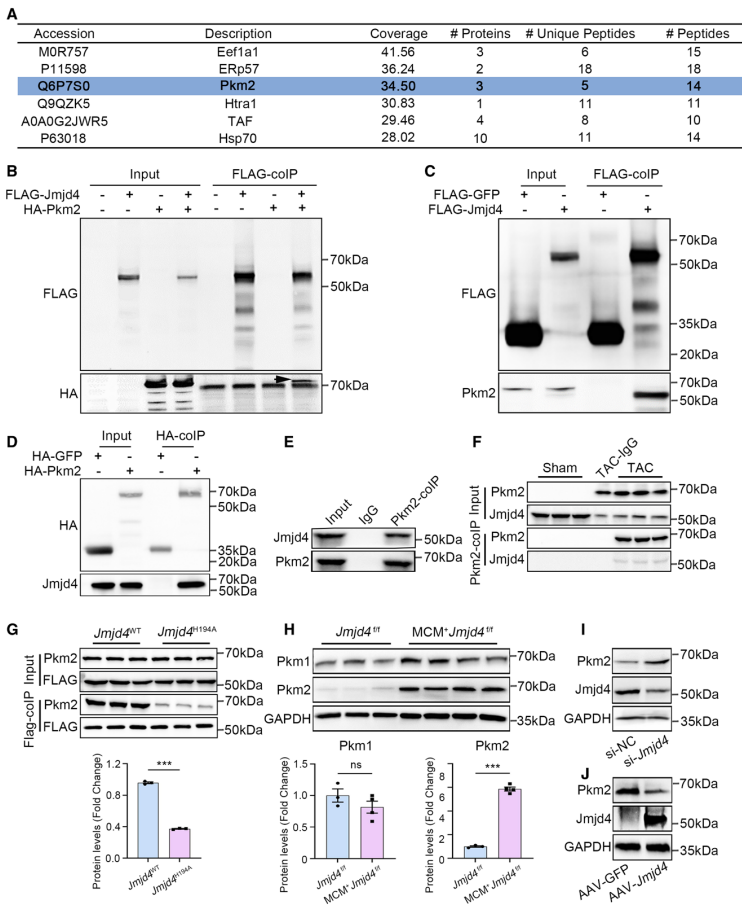
为进一步明确Jmjd4如何影响心肌细胞代谢过程,作者利用IP-MS技术在心肌细胞NRVCs中挖掘出与JMJD4相互作用蛋白丙酮酸激酶PKM2,并且在JMJD4心肌细胞特异性敲除小鼠代谢产物质谱分析中得到验证(图4A)。随后,作者在NRVCs细胞模型以及TAC小鼠模型分别证实JMJD4和PKM2存在相互作用(图4B-4F)。利用点突变技术,作者发现JMJD4和PKM2的相互作用依赖于JMJD4的羟基化酶活性,而不依赖PKM2的激酶活性(图4G)。
5、JMJD4通过分子伴侣介导的PKM2降解影响心肌代谢过程
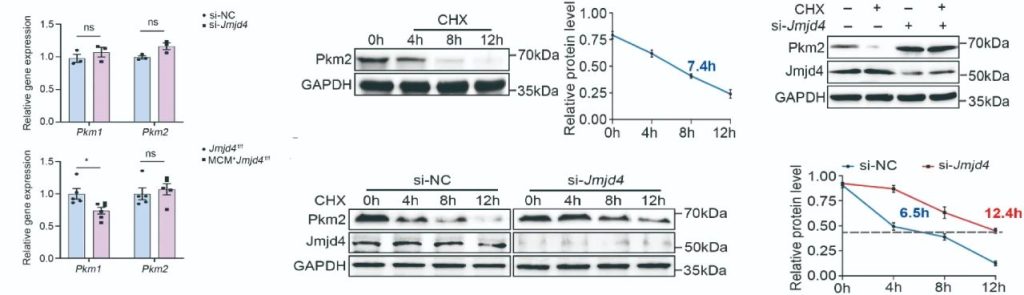
为探索Jmjd4如何调控Pkm2的表达,作者首先在NRVCs中检测敲低Jmjd4后Pkm2的表达变化。结果显示,敲低Jmjd4对Pkm2的转录水平没有影响,但显著增加PKM2的蛋白表达,提示Jmjd4可能影响PKM2的翻译后修饰过程。并且放线菌酮抑制试验也证实Jmjd4的确能够影响PKM2蛋白翻译后的稳定性,表明Jmjd4通过翻译后修饰影响PKM2的表达(图5)。
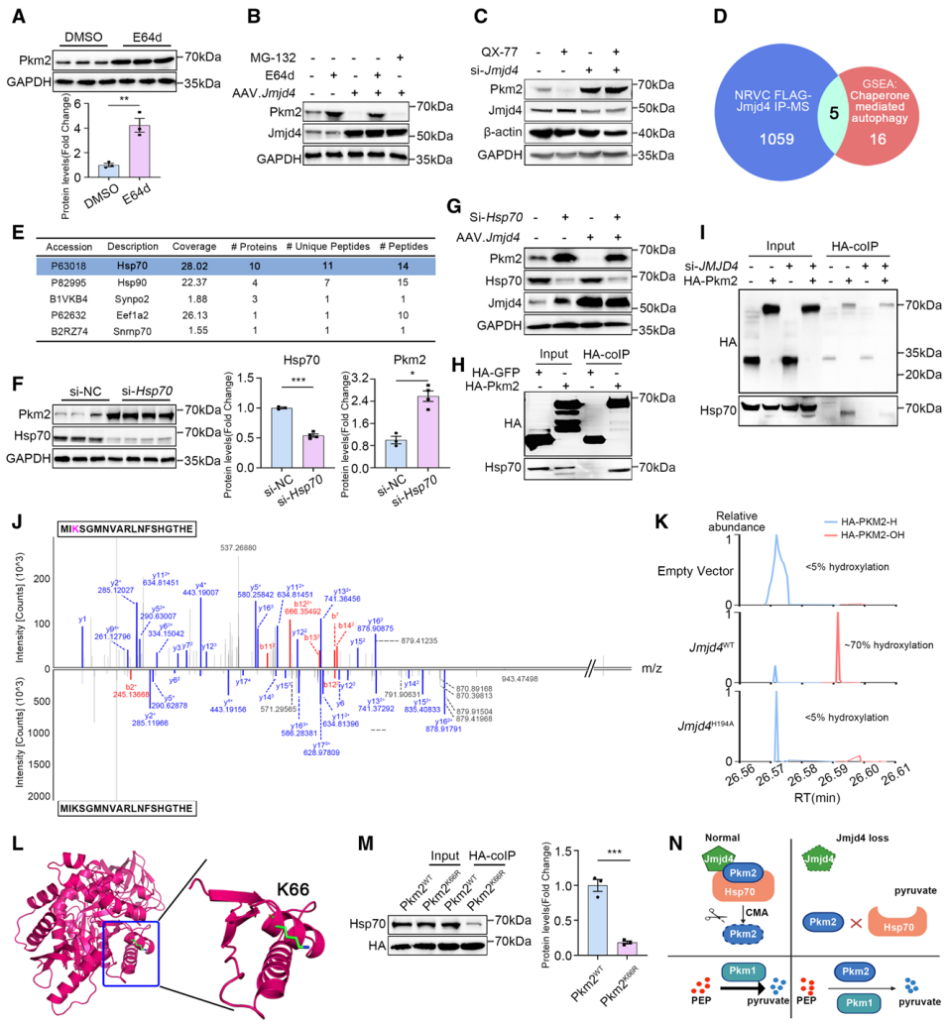
接下来,作者使用多种蛋白降解抑制剂发现,溶酶体抑制剂(E64d、Baf-A1以及Leptin)能够促进PKM2的蛋白表达,并且溶酶体抑制剂E64d能够挽救高表达Jmjd4诱导的PKM2表达不足,表明Jmjd4可能通过溶酶体介导的蛋白降解途径调控PKM2的蛋白表达(图6A-6B)。研究表明,分子伴侣介导的自噬途径(Chaperone-mediated autophagy, CMA)是溶酶体中胞质蛋白降解的主要途径。作者使用CMA特异性拮抗剂QX-77处理发现,QX-77能够显著降低PKM2的蛋白表达,而干扰Jmjd4则能够明显减弱这一过程(图6C),表明Jmjd4对于CMA介导的PKM2的蛋白降解是不可或缺的。
此外,作者通过分析JMJD4 Pull-down IP-MS结果发现,CMA通路关键分子伴侣HSP70参与CMA介导的PKM2降解过程,敲低HSP70的表达能够促进PKM2的蛋白表达并挽救高表达Jmjd4诱导的PKM2蛋白表达不足,并且JMJD4对于HSP70- PKM2的相互作用至关重要(图6E-6I)。为了进一步阐明Jmjd4调控PKM2降解的分子机制,作者通过蛋白质谱发现高表达Jmjd4导致PKM2 K66位点特异性羟基化修饰显著增多,随后的点突变技术证实K66R突变导致PKM2无法结合分子伴侣HSP70(图6J-6N)。上述结果表明,JMJD4通过羟基化PKM2 K66位点,抑制PKM2和HSP70的结合,促进CMA介导的PKM2的蛋白降解过程,最终影响心肌细胞能量代谢过程。
6、PKM2可作为普适性DCM分子治疗靶点
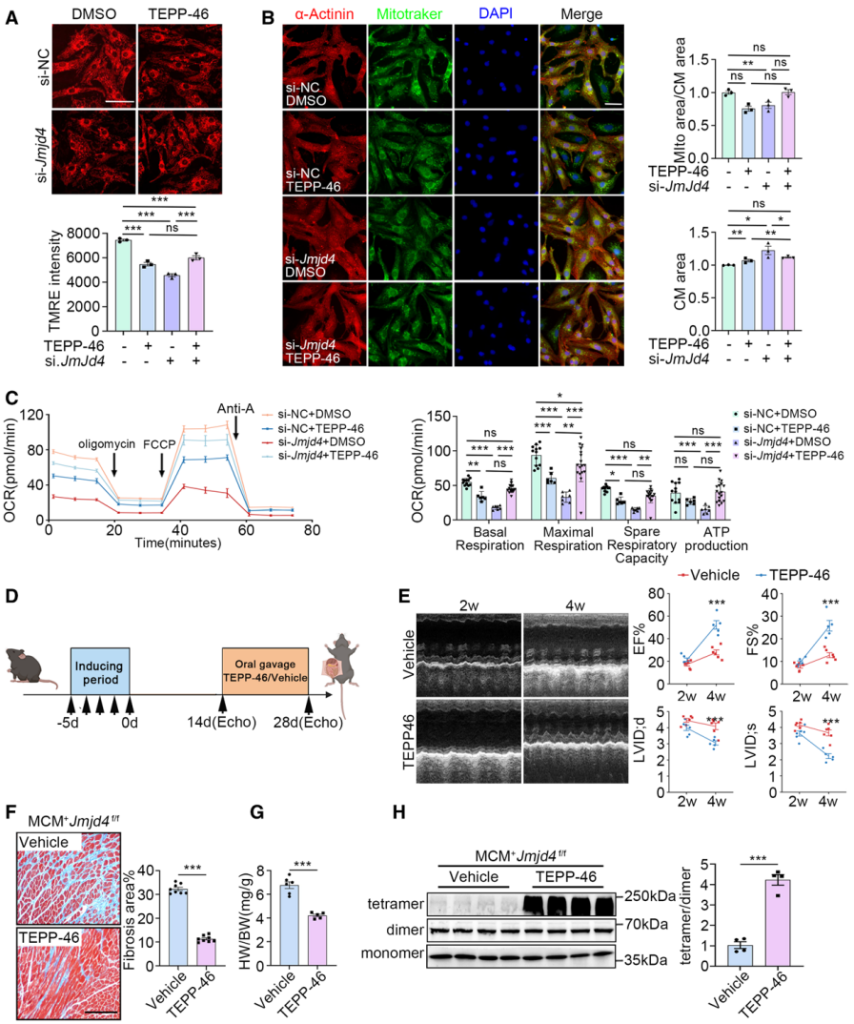
TEPP-46是PKM2特异性激动剂,能够促进PKM2四聚体的形成。作者利用PKM2特异性激动剂TEPP-46处理发现,在NRVCs细胞中激活PKM2的表达能够明显挽救敲低Jmjd4诱导的膜电位降低、线粒体减少、心肌细胞肥大以及代谢紊乱等生理过程(图7A-7C)。此外, 在体内水平, TEPP-46处理促进PKM2四聚体的形成,挽救心肌细胞特异性敲除Jmjd4诱导的DCM相关表型,如恢复EF、FS、LVID;d和LVID;s,减少心肌细胞纤维化以及心脏体积(图7D-7H)。
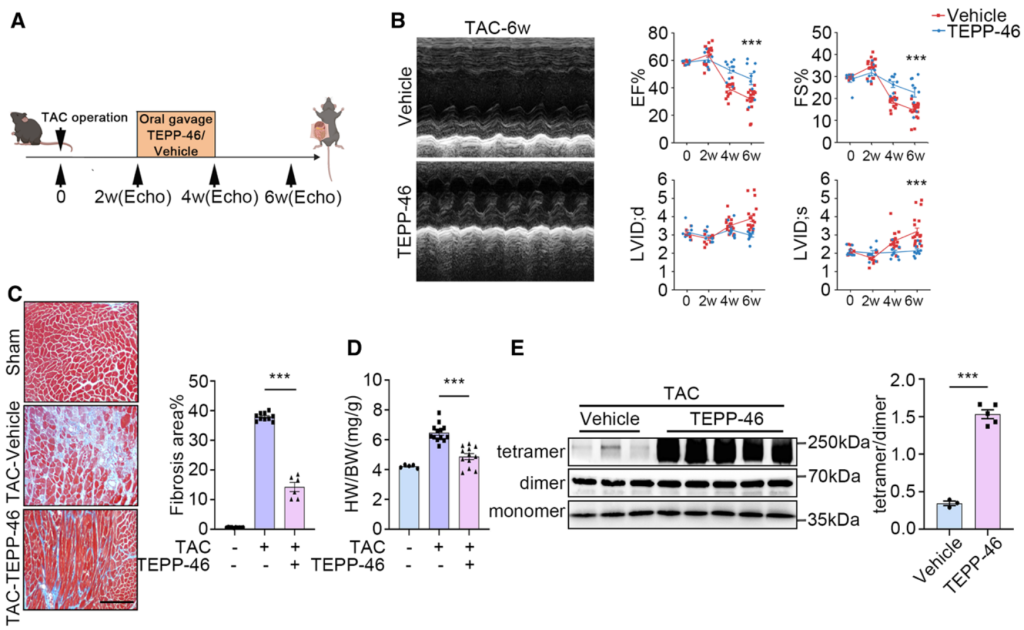
此外,为验证PKM2作为治疗DCM分子靶点的普适性,作者同样检测PKM2激活剂TEPP-46在TAC诱导的心力衰竭中的治疗效果。结果显示,TEPP-46同样能够恢复TAC诱导的心衰相关表型,如恢复心脏功能检测指标(EF、FS、LVID;d和LVID;s),减少心肌细胞纤维化以及心脏体积如增加EF和FS,降低LVID;d和LVID;s,减少心肌细胞纤维化等(图8)。上述结果表明PKM2可作为普适性心力衰竭的分子治疗靶点。
7、高表达Jmjd4能够保护TAC诱导的心力衰竭
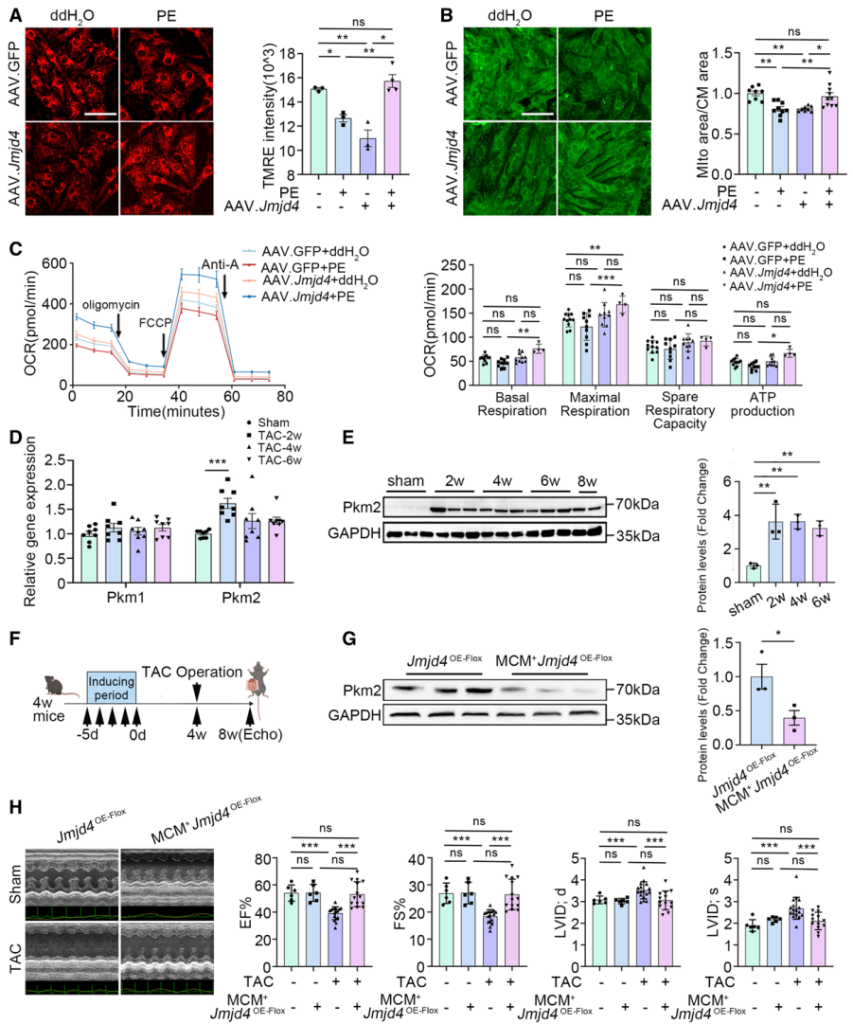
最后,为检测Jmjd4是否同样可以作为治疗DCM的普适性分子靶点,作者首先在NRVCs中利用苯肾上腺素(phenylephrine,PE)诱导DCM,然后高表达Jmjd4检测治疗效果。结果显示,高表达Jmjd4能够挽救PE诱导的线粒体功能紊乱,如线粒体膜电位降低、数量减少以及线粒体代谢活性降低等(图9A-9C)。随后,作者利用转基因技术在心肌细胞中特异性高表达Jmjd4发现,在TAC诱导的DCM模型中,高表达Jmjd4能够明显恢复TAC诱导的心衰相关心功能指标(EF、FS、LVID;d和LVID;s)。这些结果表明Jmjd4同样可作为普适性DCM治疗靶点。
总结
本研究首次发现Jmjd4通过分子伴侣HSP70介导的自噬途径调节PKM2的蛋白降解过程,在维持心肌细胞线粒体功能和能量代谢具有重要作用,并且证实Jmjd4和Pkm2可作为DCM的普适性治疗靶点,为DCM的治疗提供重要的数据支持。
参考文献
Tang Y, Feng M, Su Y, et al. Jmjd4 facilitates Pkm2 degradation in cardiomyocytes and is protective against dilated cardiomyopathy[J]. Circulation, 2023, 147(22): 1684-1704.