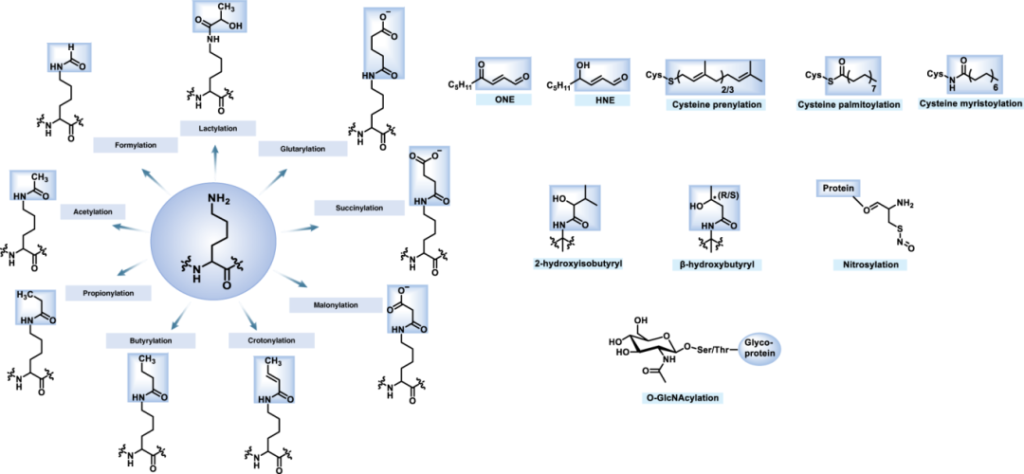
蛋白翻译后修饰(Post-translational modification, PTM)是指蛋白质在核糖体上完成生物合成之后,发生的一系列化学修饰过程。这些修饰极大地丰富了蛋白质的结构和功能多样性,对于调控蛋白质活性、稳定性、定位、相互作用以及参与细胞信号传导等生物学过程至关重要。常见的蛋白翻译后修饰包括磷酸化、泛素化、糖基化、乙酰化、甲基化等等。在疾病研究中,如何阐明某个蛋白的翻译后修饰过程是十分重要的,也有助于文章分值提升。然后,用什么样手段能够简单而有效的去验证蛋白翻译后修饰是困扰很多研究者的问题,而Co-IP技术就可以轻松解决这一问题。
Co-IP全称为免疫共沉淀(Co-Immunoprecipitation, Co-IP),是一种经典的生物学研究方法,用于检测和分析细胞内蛋白质之间的相互作用。基于抗原-抗体的特异性结合原理,旨在从细胞裂解物中捕获目标蛋白。实验中,首先使用特异性的抗体与诱饵蛋白结合,形成抗体-抗原复合物。随后,这些复合物通过与具有抗体结合能力的固相载体(如蛋白A或蛋白G偶联的琼脂糖珠)结合,实现从细胞提取液中的富集目标蛋白,最后可以通过WB或者MS分析富集得到的蛋白。下面就由小医来简单介绍一下Co-IP技术在几种常见蛋白翻译后修饰研究中的应用。
一、Co-IP技术验证蛋白泛素化修饰
蛋白质泛素化是一种重要的蛋白质翻译后修饰过程,涉及将泛素分子共价连接到特定蛋白质的赖氨酸残基上。泛素化过程:泛素化是一个由三类酶催化的级联反应,包括:E1泛素激活酶首先将ATP的能量用于激活泛素分子,并与泛素形成一个高能硫酯键;E2泛素结合酶(又称泛素载体蛋白)从E1接收激活的泛素;E3泛素连接酶负责识别靶蛋白并催化泛素从E2转移到靶蛋白的赖氨酸残基上,E3酶赋予整个过程高度的特异性,确保正确的蛋白质被泛素化。在li等人的文章“Deubiquitinase USP39 and E3 ligase TRIM26 balance the level of ZEB1 ubiquitination and thereby determine the progression of hepatocellular carcinoma”中,作者用Co-IP方式验证了泛素化酶TRIM26对肝癌细胞中的ZEB1蛋白泛素化修饰。首先,MG132(蛋白酶体抑制剂)处理显著逆转了TRIM26诱导的ZEB1蛋白减少,这些结果表明,TRIM26通过蛋白酶体途径使ZEB1蛋白失稳。通过转染Flag-ZEB1表达质粒,用标签Flag抗体(IP抗体)进行富集,然后用Ub泛素抗体以WB方式检测ZEB1的泛素化水平。实验结果显示TRIM26敲低显著抑制了SK-hep-1细胞中ZEB1的泛素化(图2)。
二、Co-IP技术验证蛋白乙酰化修饰
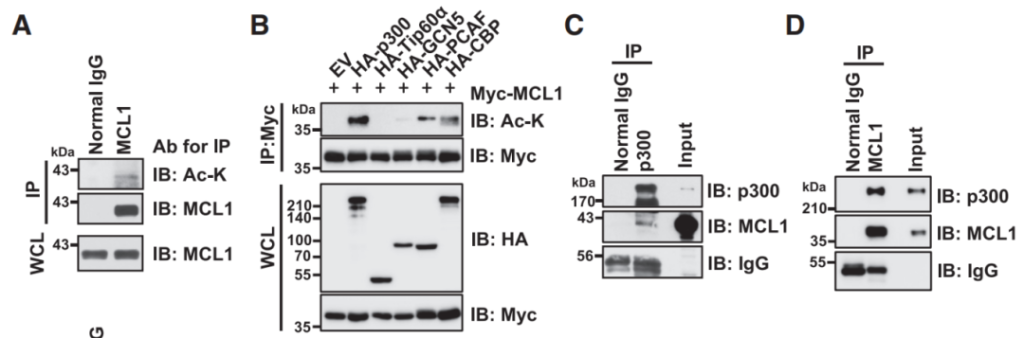
乙酰化是赖氨酸修饰的一种基本类型,它控制着多种生物过程,包括蛋白质-蛋白质相互作用、转录、亚细胞定位和许多蛋白质的酶活性。许多被乙酰化修饰的非组蛋白是肿瘤促进因子或肿瘤抑制因子,直接参与肿瘤发生、肿瘤进展和转移。另外,乙酰化有助于蛋白质的稳定和降解,通过与泛素化(另一种赖氨酸修饰)的相互作用来实现的。乙酰化可与泛素化在相同的受体赖氨酸残基上竞争,来影响蛋白的稳定性。Shimizu等人在他们研究结果中“Interplay between protein acetylation and ubiquitination controls MCL1 protein stability”发现了p300能结合并乙酰化MCL1蛋白。为了评估MCL1在细胞中是否乙酰化,首先免疫沉淀内源性MCL1蛋白,并使用乙酰化赖氨酸抗体检测其乙酰化;接下来,为了确定负责MCL1乙酰化的上游酶,将Myc-MCL1表达载体与各种赖氨酸乙酰转移酶表达载体共转染细胞,免疫沉淀Myc-MCL1融合蛋白,在测试的五种乙酰转移酶中,p300、p300/CBP相关因子(PCAF)和creb结合蛋白(CBP)诱导了MCL1的乙酰化;然后,Co-IP验证了HeLa细胞内源性水平的MCL1和p300之间的相互作用(图2)。
三、Co-IP技术验证蛋白糖基化修饰
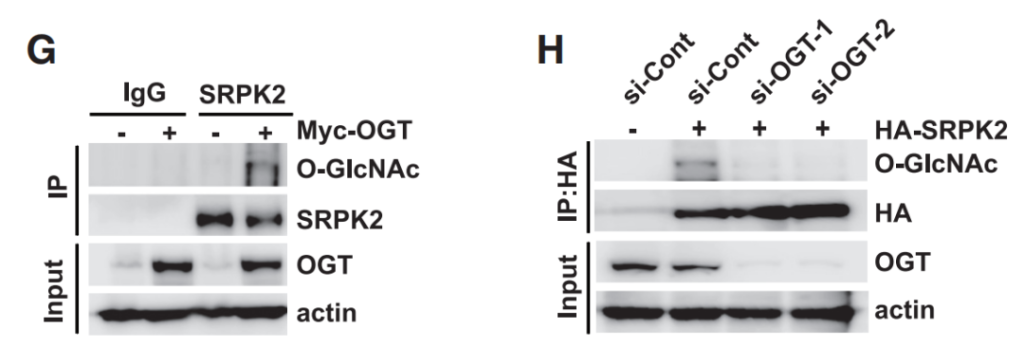
蛋白质糖基化是一种普遍存在于真核生物和许多原核生物中的重要的翻译后修饰过程,它涉及到在蛋白质上共价连接糖分子。这一过程对于蛋白质的结构、功能、定位以及细胞间通信等方面都起着至关重要的作用。蛋白质糖基化主要发生在内质网和高尔基体中,可以分为两大类:N-连接糖基化和O-连接糖基化。N-连接糖基化:这种类型的糖基化发生在肽链的氮原子上,特指在蛋白质的天冬酰胺(Asn)的酰胺基上。过程通常开始于内质网中,当多肽链进入内质网时,一个14个糖残基的核心寡糖会被添加到天冬酰胺的侧链氨基上。O-连接糖基化:O-连接糖基化是在蛋白质的丝氨酸(Ser)、苏氨酸(Thr)或羟赖氨酸的羟基上的氧原子上添加单个糖分子,这一过程主要发生在高尔基体中。Tan等人在其研究“Posttranscriptional regulation of de novo lipogenesis by glucose-induced O-GlcNAcylation”中验证了SRPK2发生了O-GlcNAc修饰后增加了肿瘤细胞的脂质合成能力。用Myc-OGT表达质粒转染HEK293T细胞,用SRPK2抗体免疫沉淀反应,用WB检测SRPK2蛋白的O-GlcNAc含量。实验结果显示,细胞转染Myc-OGT后可以促进SRPK2蛋白的O-糖基化修饰,而干扰OGT表达后,SRPK2蛋白的O-糖基化修饰水平显著下降。
在上述各种蛋白翻译后修饰中的实验验证所用Co-IP技术上,伯远生物有丰富操作经验和成熟实验体系,为许多科研单位提供过优质的技术服务,欢迎有这方面需求的老师联系我们。
参考文献
Li W, Li F, Zhang X, et al. Insights into the post-translational modification and its emerging role in shaping the tumor microenvironment[J]. Signal transduction and targeted therapy, 2021, 6(1): 422.
Li X, Yuan J, Song C, et al. Deubiquitinase USP39 and E3 ligase TRIM26 balance the level of ZEB1 ubiquitination and thereby determine the progression of hepatocellular carcinoma[J]. Cell Death & Differentiation, 2021, 28(8): 2315-2332.
Shimizu K, Gi M, Suzuki S, et al. Interplay between protein acetylation and ubiquitination controls MCL1 protein stability[J]. Cell reports, 2021, 37(6).
Tan W, Jiang P, Zhang W, et al. Posttranscriptional regulation of de novo lipogenesis by glucose-induced O-GlcNAcylation[J]. Molecular cell, 2021, 81(9): 1890-1904. e7.