链霉菌,可能大多数读者对这个名字很难心生好感,霉菌,一看就很不卫生啊!不过这类最常见的放线菌,其实贡献了大量临床常用的抗生素,来,浅看一下某百科的举例↓

今日,华盛顿大学科学团队在《自然》杂志发表论文,他们在链霉菌中首次发现了一种全新的抗菌蛋白颗粒,这种颗粒具有独特的伞状结构,因此研究者将它命名为伞状毒素颗粒(Umb)。
Umb颗粒的复杂结构使其可以高特异性且有效地抑制特定菌种的生长,有望成为新型抗生素的模板为人类造福。

虽然时常感慨城市里人山人海,但论居住密度,真是无物种能超菌右,在1克土壤中,富含的菌种竟能达到109之多。菌口如此密集,彼此之间竞争也很是激烈,细菌与细菌之间的攻防战让人类“偷”得了很多抗菌灵感。
链霉菌之所以能成为众多抗生素之母,是因为它能产生多种有抗菌活性的小分子次级代谢物。其实在其他细菌中,也有发现参与细菌种间竞争的蛋白质毒素,但此前在链霉菌中还没有类似的发现。
为了寻找链霉菌中的蛋白质毒素,研究者的思路是从有同源性的小毒素结构域入手,再顺藤摸瓜搞清相关的互作蛋白,最终找到的就是Umb蛋白。虽然一步一步的推理过程也很有趣,不过我们还是先来整体看一下Umb蛋白的构成吧!
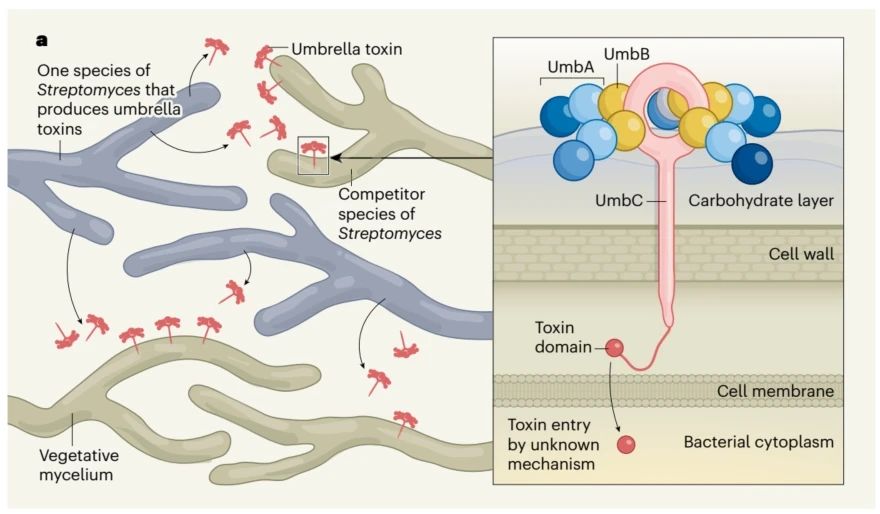
Umb蛋白保持了蛋白质毒素的一贯作风,具有模块化特征,由UmbA、UmbB、UmbC三个模块构成。UmbC是组成整个蛋白复合物的“中轴”,UmbA连接着UmbB、并通过UmbB“挂”在UmbC顶端的环状结构上。
从Umb的上方看下来,每个UmbC环上挂着5枚“伞骨”,还真的非常像一把直柄雨伞。
这是首次发现类似结构的蛋白质毒素。
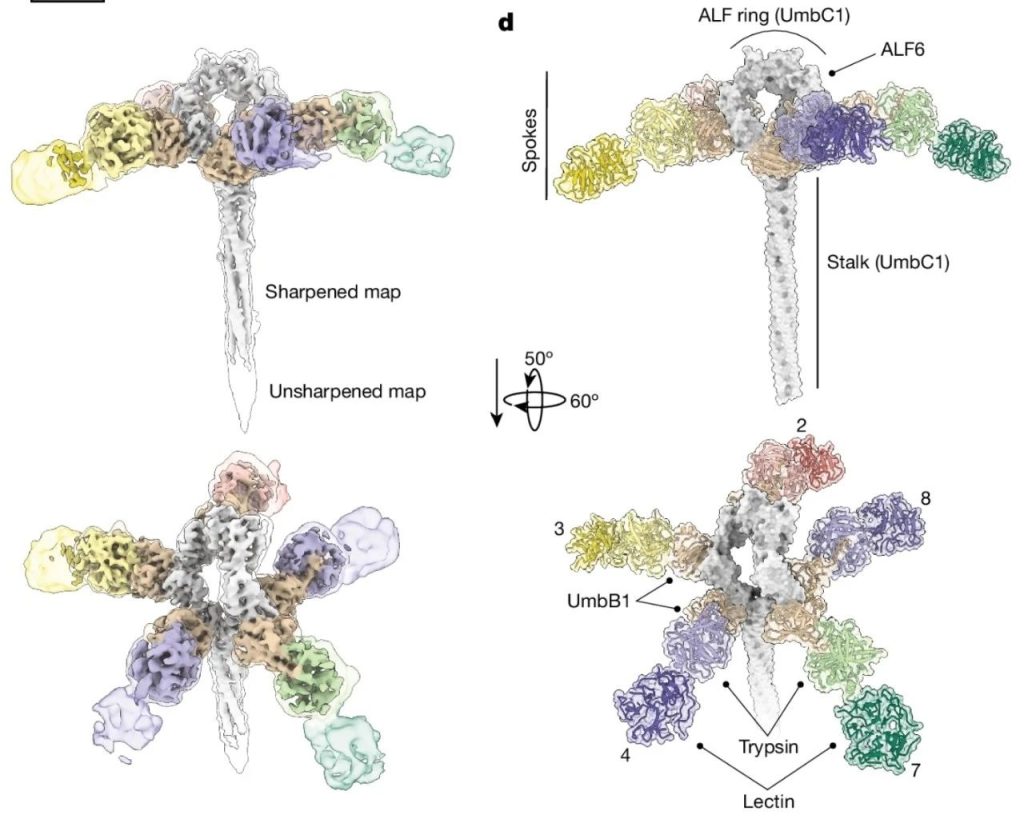
冷冻电镜下的umb结构
实验中研究者筛选到的3种不同的UmbC具有不同的抗菌机制,一种能够修饰DNA,另外两种则通过未知的机制破坏细菌的细胞壁和细胞膜。
UmbA含有不同的凝集素结构域,组成最先接触外界的“伞尖”。凝集素结构域可结合特定多糖,研究者猜测UmbA就是Umb识别特定靶细胞的关键。
实际,Umb的靶向性也是非常的高。研究者从链霉菌培养液中提取了富含Umb的上清液,并用其处理140种不同的细菌。从结果来看,Umb对两个链霉菌属的成员有高度的特异性,而且抑菌效果相当不错。
链霉菌毒素研究已经开展了百年有余,可能正是Umb的复杂性和特异性让它得以一直“隐身”没被发现。
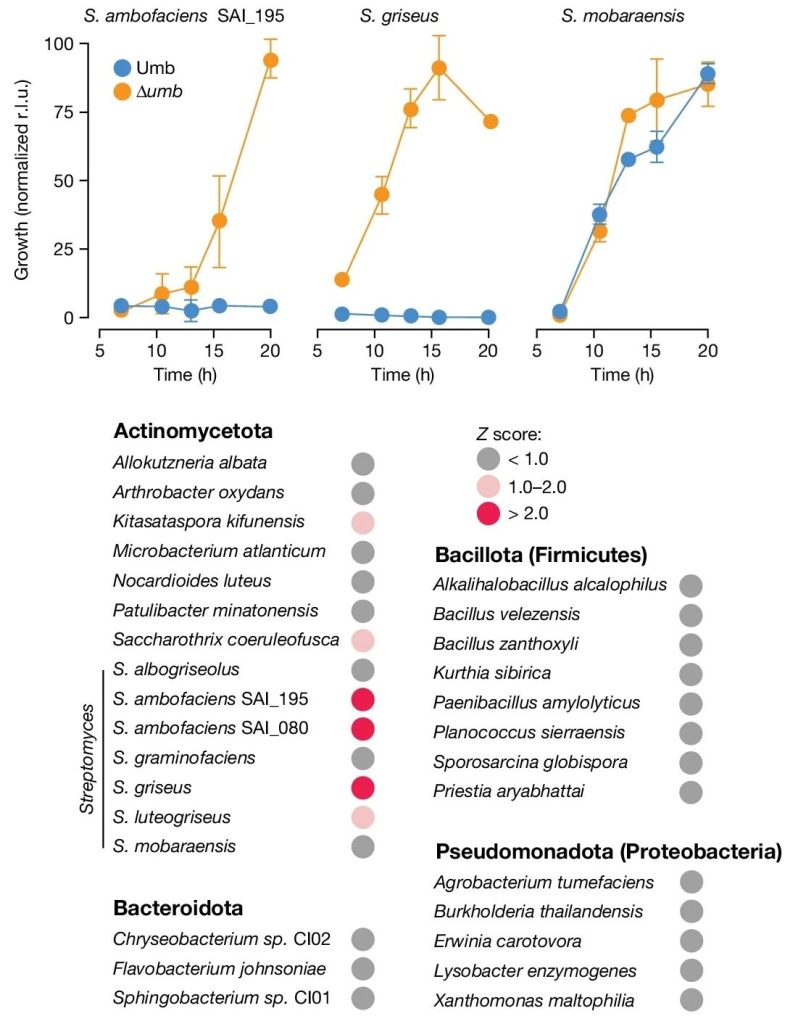
Umb的抑菌机制也很独特,研究者分析发现,Umb主要作用于营养菌丝体。Umb也无需直接输注至靶细胞内,仅释放到胞外环境中,它就能触达易感细菌,至于如何进入细胞内,本项研究未能给出答案。
Umb蛋白的存在相当广泛,不仅限于链霉菌,研究者在875种放线菌中都发现了编码Umb蛋白的序列。Umb的各个模块也相当多样化,研究者已经发现了77个不同的UmbC毒素结构域,UmbA也有至少20个不同的凝集素结构域。
想必它们一定能够组合出令人惊喜的Umb单品吧!研究者在采访中提及,结核杆菌和白喉杆菌很可能是Umb能有效对付的目标。
研究者还猜测,Umb可能还具有抗菌之外的其他功能。因为Umb编码基因多数时候还会编码一种保护Umb生产者免遭毒害的免疫蛋白,但也有少数不编码这类蛋白的情况。
这意味着,Umb可能存在非细菌靶标,比如动物、植物、真菌等等。那么Umb的应用范围又可以扩大了!
文章来源:奇点网

