我们对细胞毒性T细胞的认知,又要刷新了。
今天,由美国圣裘德儿童研究医院迟洪波领衔的研究团队,在顶级期刊《自然》发表了一项重磅研究成果[1],让我们对瘤内细胞毒性T细胞的分化过程有了更深入的认知。
他们基于CRISPR基因编辑技术,绘制了有史以来最完整的肿瘤内T细胞转录因子图谱,发现了调控细胞毒性T细胞分化的三个检查点。他们还证实,耗竭前体T细胞(Tpex)退出静息状态并往中间型终末耗竭T细胞(Tex)分化,以及让中间型Tex保持分化增殖状态,是免疫系统抗肿瘤的关键。
迟洪波团队认为,他们这项研究成果为改善免疫治疗效果搭建了一个系统的框架。圣裘德儿童研究医院的周培培、史豪和黄宏龄是论文的共同第一作者。
论文首页截图
李白说,“君不见黄河之水天上来,奔流到海不复回”。
其实T细胞的分化过程与此类似。
位于“山巅”的前体T细胞是源头,而“奔流入海”的耗竭T细胞则是结局。理想的T细胞位于二者之间,这些T细胞分化程度足够,但又不过分,因此具有较强的增殖能力和有效的抗癌活性,且能积极响应免疫治疗。
然而,T细胞一旦进入肿瘤,就会被微环境中的各种分子调控,迫使T细胞进入终末耗竭状态,很快就失去抗癌的能力,且不再响应免疫治疗。因此,要想重振免疫系统的抗癌能力,就得像肿瘤一样了解T细胞的分化,然后操纵T细胞的分化方向。
遗憾的是,科学家并没有完全弄清楚上述问题。
从左到右:周培培、史豪和迟洪波(图片来源:圣裘德儿童研究医院)
为了搞清楚T细胞分化的过程,迟洪波团队决定借助于单细胞CRISPR(scCRISPR)技术,搞清楚T细胞进入肿瘤后的命运走向。他们的筛选围绕180个转录因子(TF)展开,共涉及42209个T细胞,其中就包括Tpex和Tex。
之前的研究表明,Tex是肿瘤内细胞毒性T细胞的主要群体,能直接杀伤肿瘤细胞,不过它们会逐渐失去增殖能力,而且它们不响应现有的免疫疗法。而Tpex可以响应免疫治疗,在免疫检查点抑制剂的处理下,会分化成Tex抗癌。因此,接下来迟洪波团队重点就研究了Tpex往Tex分化的调节机制。
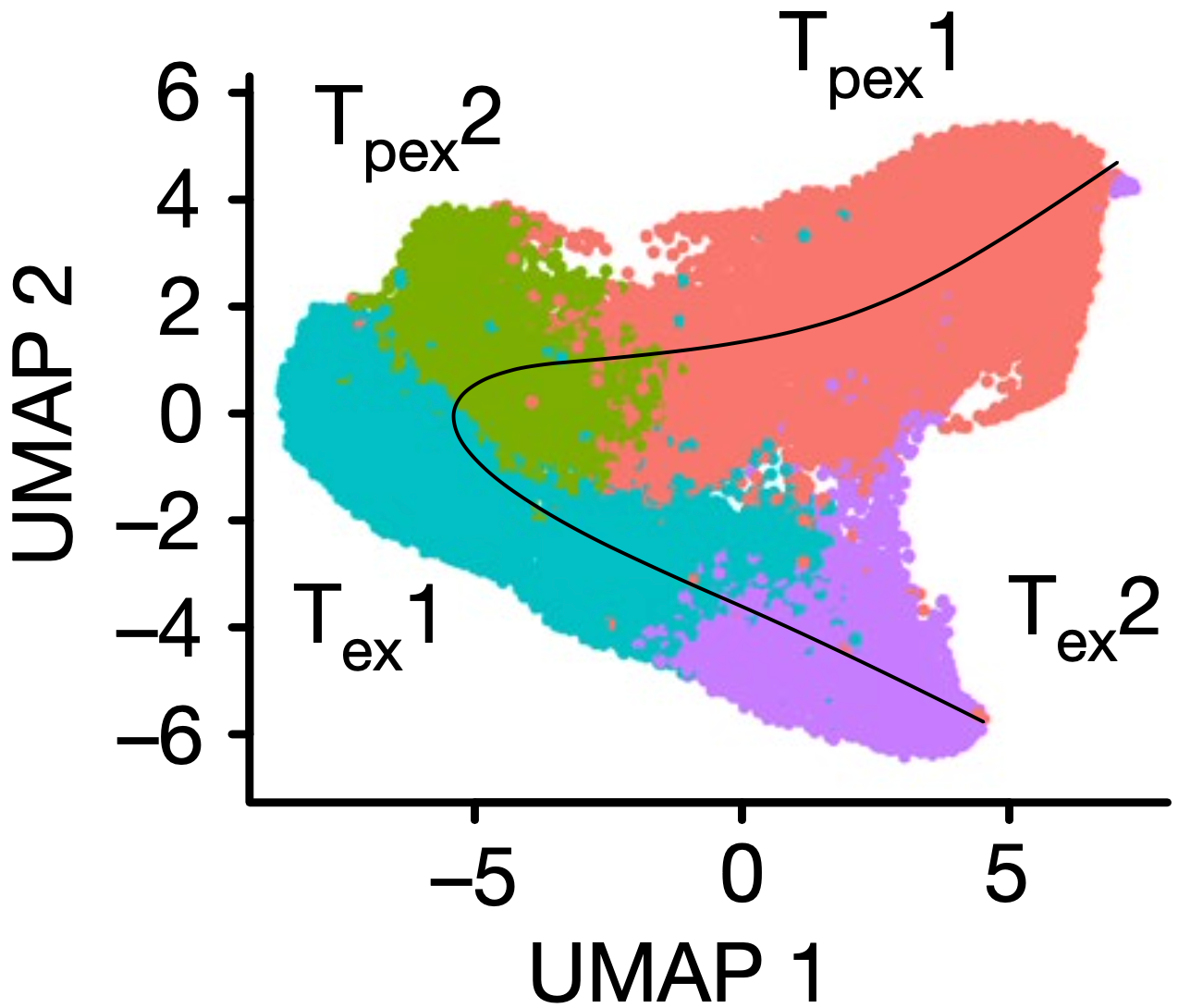
他们发现,这个分化轨迹大概是这样的:从耗竭前体样状态1(Tpex1),分化出Tpex2,再分化出终末耗竭样状态1(Tex1),最后是Tex2。在肿瘤进展过程中,Tex2细胞比例持续增加,而两种Tpex细胞状态减少。
分化流程图
后面的工作就是要确定调节上述分化流程的关键点。
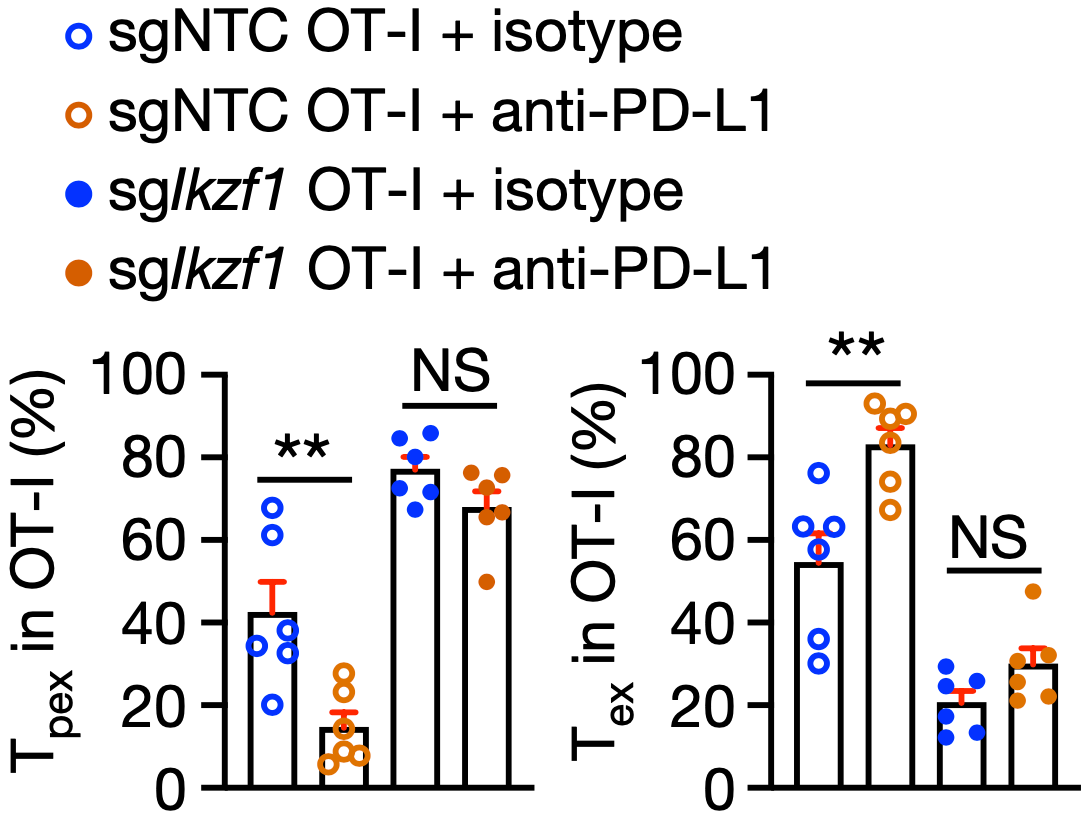
首先是Tpex1向Tpex2的转变。他们发现这个过程受Ikzf1基因调节,Ikzf1的缺失会导致Tpex1不能从静息状态退出,也就抑制了Tpex1向Tpex2的转变。这带来的后果是Tpex细胞积累和Tex细胞减少。
从分子机制上来说,Ikzf1的缺失导致它编码的蛋白IKAROS减少,与干性相关的TCF-1就失去了抑制因子处于激活状态,促使Tpex1处于不活跃状态。简单来说,Ikzf1基因的表达是Tpex1向Tpex2转变的关键。
正因为如此,Ikzf1基因缺失的T细胞不响应抗PD-L1抗体。即使此类T细胞在肿瘤中含量很高,它们也不会增加抗肿瘤效果。
Ikzf1基因缺失,T细胞就睡不醒
接下来轮到Tpex2细胞向Tex1细胞转变了。
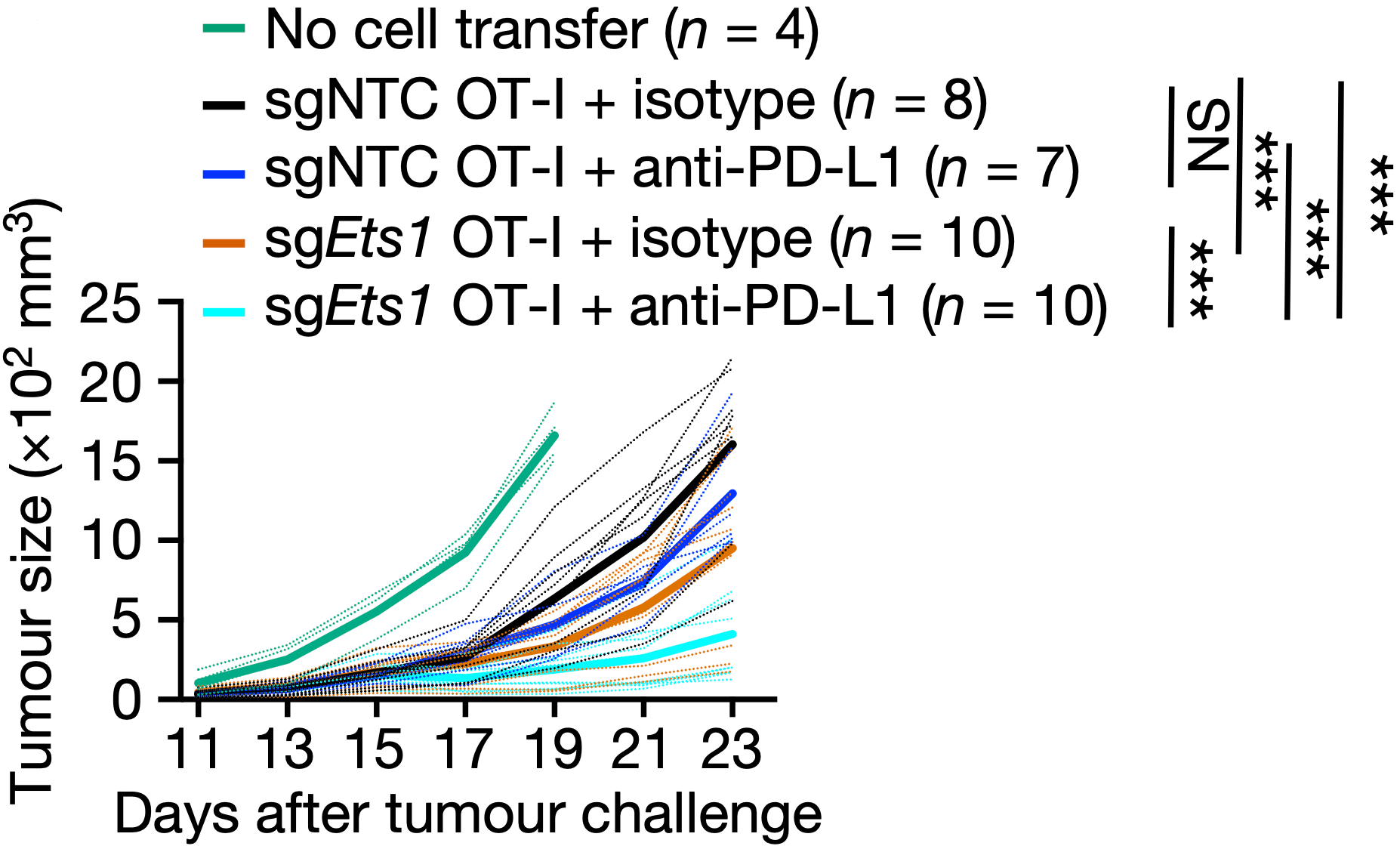
迟洪波团队分析数据发现,Ets1是最主要的负调控因子之一。Ets1缺失与Tex1细胞扩增,以及Tpex细胞比例降低密切相关。
而且瘤内Ets1缺失的T细胞还显示出与效应功能、细胞毒性和增殖相关的标志物表达增加。从机制上看,Ets1缺失T细胞的BATF活性增强,而BATF是细胞毒性T细胞效应功能的有效调节因子。因此,是ETS1-BATF轴在调节Tpex2向Tex1的转变。
正如预料的那样,Ets1缺失联合抗PD-L1抗体会增强抗肿瘤效果。人体肿瘤样本也表明,ETS1的水平与免疫治疗的效果负相关。
Ets1缺失增强免疫治疗效果
最后是Tex1向Tex2的转变。
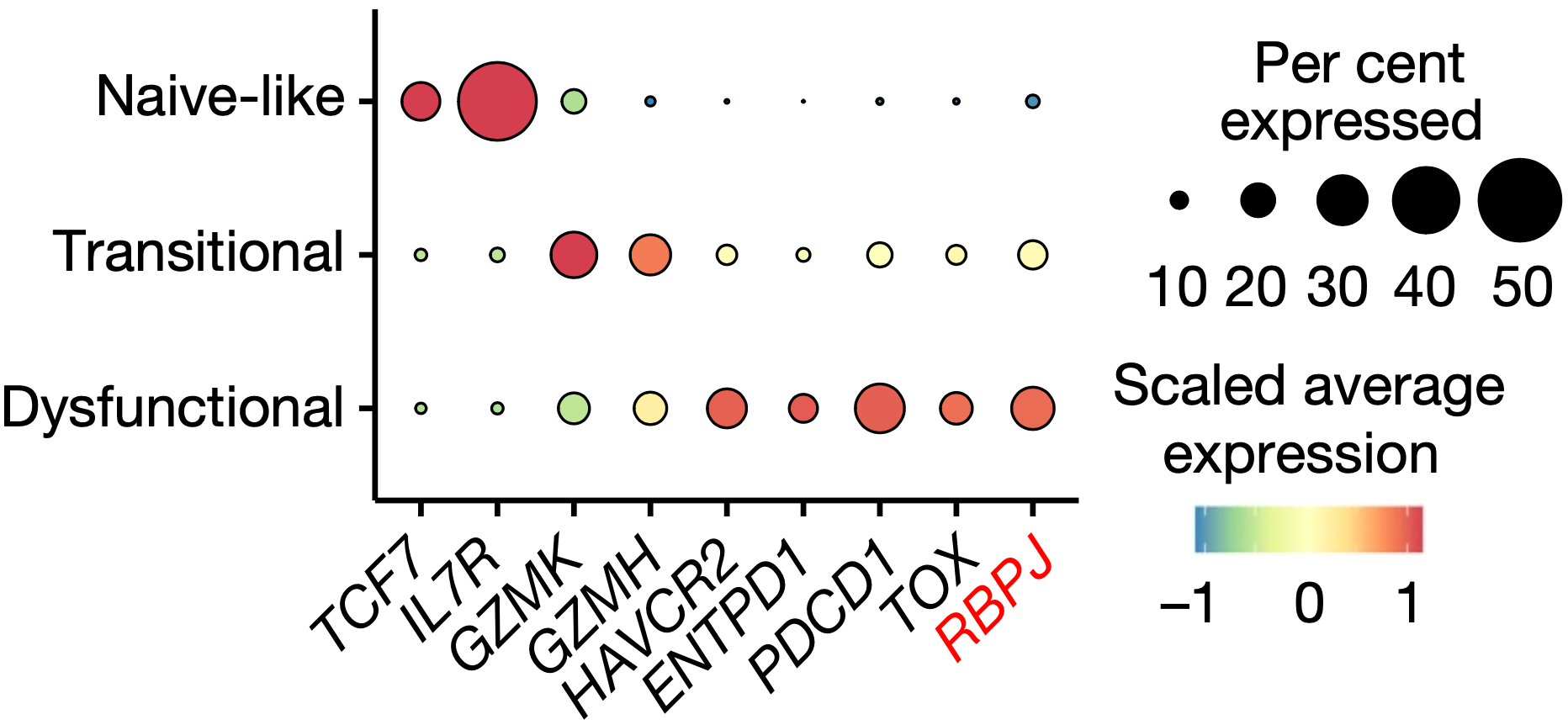
迟洪波团队发现Rbpj的缺失会上调T细胞的增殖特征,阻止Tex1向Tex2转变,选择性地导致Tex1积累。值得注意的是,在人类肿瘤样本中,他们也发现功能障碍的T细胞中Rbpj表达水平最高,而且CD8阳性T细胞中Rbpj低表达与免疫治疗临床反应增强有关。
功能受损,Rbpj表达水平高
从细胞的表性来看,在Rbpj缺失的T细胞中,表达GZMB和IFNγ细胞占比和数量都增加,而且穿孔素和其他效应相关分子的表达也上调,这表明此类细胞的细胞毒性和效应特征增强。从机制上来说,Rbpj缺失缺失后,IRF1活性增加是Tex细胞增殖和抗肿瘤作用增强所必需的。
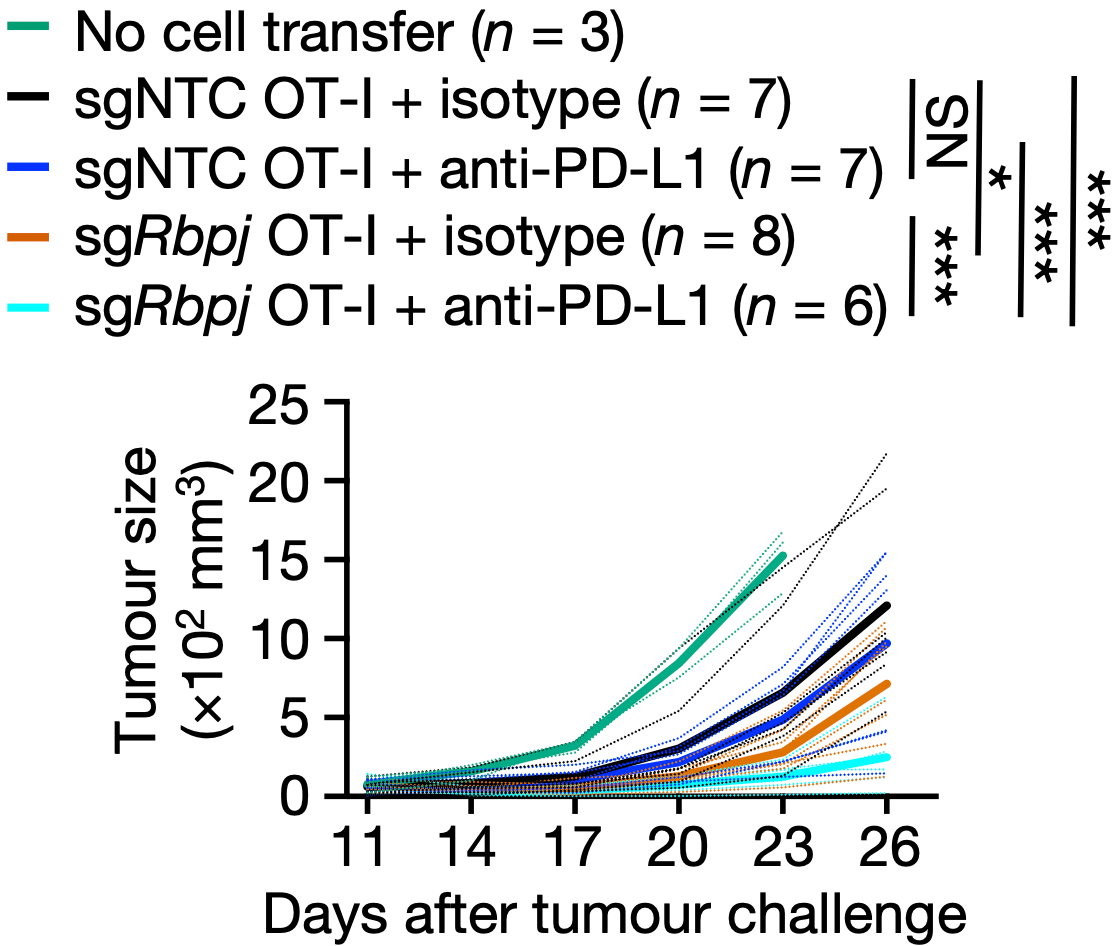
小鼠实验也表明,Rbpj缺失联合抗PD-L1抗体会增强抗肿瘤效果。
Rbpj缺失联合抗PD-L1抗体会增强抗肿瘤效果
总的来说,迟洪波团队的这项研究成果让我们搞清楚了瘤内T细胞的分化过程,他们发现的那三个T细胞分化检查点对于改善癌症的免疫治疗有重大意义。
未来,基于本研究的发现,有望开发出重编程瘤内T细胞,提升免疫治疗效果的药物。
参考文献:
[1].Zhou P, Shi H, Huang H, et al. Single-cell CRISPR screens in vivo map T cell fate regulomes in cancer. Nature. 2023. doi:10.1038/s41586-023-06733-x
文章来源:奇点网