癌细胞疯狂增殖的特性让它们对营养物质的需求非常高,对葡萄糖尤其偏爱。这个特征也可以被我们反向利用,比如通过高脂肪、低碳水的生酮饮食(KD)来限制癌症的进展,而这也已经得到了很多临床前研究的认可。
但是,生酮饮食抗癌也不全是优点。
近期,发表于《细胞·代谢》杂志的一项研究发现,虽然生酮饮食能够有效抑制癌症进展,但是在产生IL-6的癌种中,生酮饮食也会加速恶病质的进展并因此导致小鼠生存期缩短。研究发现,生酮饮食能够增加脂质过氧化、导致癌细胞铁死亡;但氧化还原的失衡同时也损害了皮质酮的生物合成,进而影响代谢平衡、加速恶病质。
好在,这个问题可以通过糖皮质激素解决。生酮饮食+地塞米松的组合可以在保证抑癌效果的同时,延缓恶病质发作、延长生存期。这也提示我们,癌症进展不能作为疗效的唯一指标,综合讨论生存时长和质量更加重要。
所谓的癌症恶病质(cachexia)是一种严重消耗综合征,主要表现为食物摄入量减少和体重减轻,恶病质影响多达80%的癌症患者,要为癌症死亡负直接责任。
所以,原因在于这类疾病中生酮饮食无法有效地转化为机体的能量?
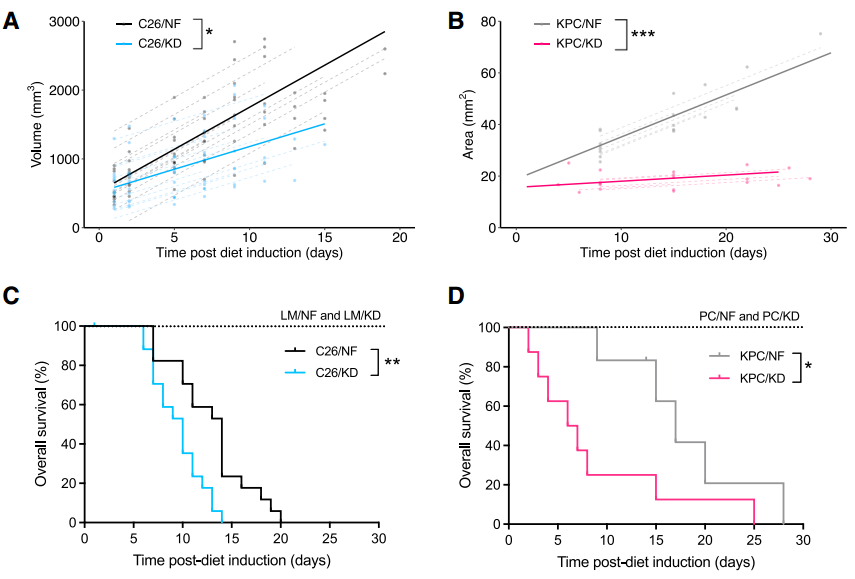
为了解决这个疑问,研究者们开展了实验。他们首先在C26结直肠癌和KPC胰腺癌两个分泌IL-6的癌种的小鼠模型中测试了生酮饮食的抗癌效果。
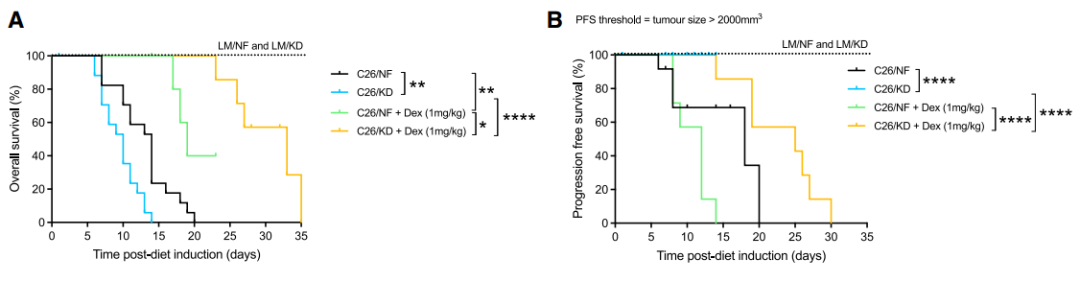
不得不说,生酮饮食确实有点东西,两种小鼠的肿瘤生长都显著减慢了,但是这却并未让小鼠活得更久——生酮饮食小鼠的生存期显著缩短了(C26:10 vs 14天,KPC:6.5 vs 17天)。
生酮组小鼠表现出皮下和性腺脂肪组织丢失、股四头肌肌肉减少、脾肿大,这都是典型的恶病质表现。
恶病质的问题我们稍后再聊,生酮饮食如何把细胞带上死路的呢?
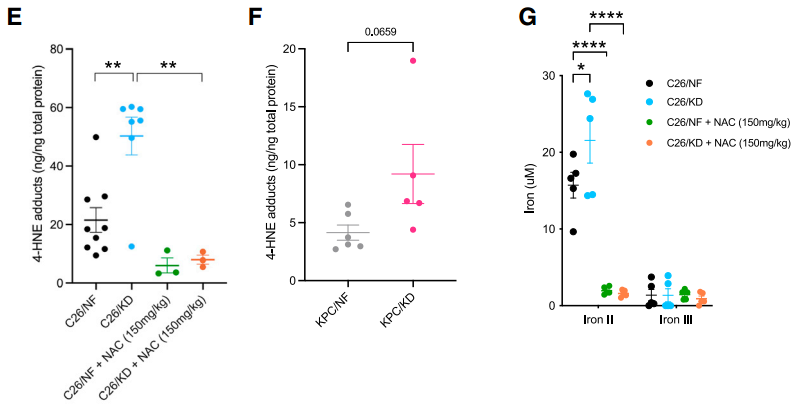
生酮饮食这样富含脂质的饮食能够为脂质过氧化和脂质自由基的形成提供大量底物。研究者在小鼠肝脏内检测到了大量4-HNE的积累,这是脂肪酸氧化产生的主要脂质过氧化产物(LPP)。
正常情况下,脂质过氧化率并不高,NADPH依赖的谷胱甘肽(GSH)等抗氧化防御系统也能及时把有毒产物清除。但是一旦不能及时“解毒”,积累的LPP就会导致细胞出现依赖于铁的程序性细胞死亡,也就是铁死亡(ferropotosis)。
实际上,生酮饮食的荷瘤小鼠体内,这一系统也的确在超饱和运转,研究者观察到它们体内GSH与其氧化型的比值降低、铁死亡标记物显著增加。给小鼠喂食抗氧化剂N-乙酰半胱氨酸(NAC)能够促进谷胱甘肽生物合成、减少LPP积累。
由此可见,生酮饮食可以通过脂质过氧化诱发持续的癌细胞铁死亡,这也是它延缓肿瘤生长的机制之一。
糖皮质激素的生物合成涉及NADPH依赖的胆固醇酶促还原反应。人类糖皮质激素的主要成员之一就是皮质醇(啮齿类动物中的皮质酮),在癌症恶病质中,皮质醇会驱动适应性改变,包括调剂葡萄糖/蛋白质/脂肪等营养物质的储存和分解。
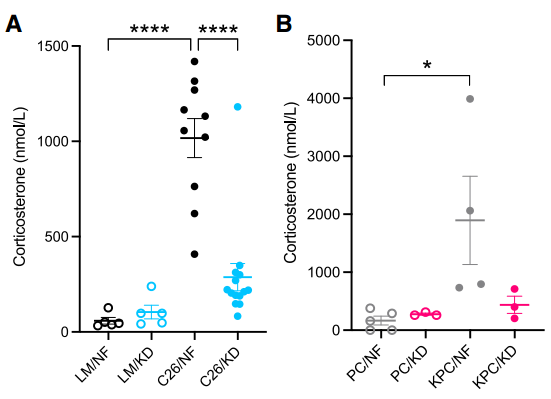
研究者发现,在发生恶病质时,饲喂正常饮食的荷瘤小鼠皮质酮浓度显著升高,但是生酮饮食的小鼠皮质酮水平却不变。
比较小鼠的转录组进行GSEA分析,研究者发现生酮组小鼠的类固醇生物合成和胆固醇稳态途径显著下调。这说明生酮组荷瘤小鼠的皮质酮合成受损。
额外一提,虽然IL-6能够驱动皮质酮释放,但是实验中研究者并未观察到不同饮食组的IL-6水平差异,起码这回不是IL-6的问题。
研究者在生酮组小鼠中够观察到了多种代谢标志物的变化,例如泛素介导的蛋白质水解过程的受损、糖/丙酮酸代谢相关基因的下调、脂肪酸代谢的异常等等。
可以说,生酮组荷瘤小鼠皮质酮生物合成受损,引发了一系列代谢不适应、能源利用不足、血糖水平降低,并最终提前诱发了癌症恶病质。
研究者还发现,在恶病质状态下,生酮组小鼠相较正常饮食组小鼠的循环GDF-15水平更高。GDF-15是一种转化生长因子TGF-β超家族成员,能够介导食物摄入减少,已被认为是癌症恶病质的厌食和醛中毒引起的厌食症的机制之一。如此也能够解释小鼠出现的摄食减少了。
既然问题出在糖皮质激素上,那么是否可以通过糖皮质激素来解决呢?
研究者给荷瘤小鼠注射了地塞米松,发现它能够在保留生酮饮食的抗癌效果的同时,显著延缓恶病质发作、延长了小鼠的生存期。
地塞米松治疗也显著挽救了生酮组小鼠的代谢问题,脂肪组织消耗、肌肉消耗和脾肿大问题都好转了。
这项研究不仅提出了生酮饮食在抗癌和诱导恶病质两个对生存截然相反的方面的作用机制,也提示我们系统干预的结果不能仅从对肿瘤的影响中推断。在临床中,也要结合多方面讨论治疗对患者的价值。
文章来源:奇点网