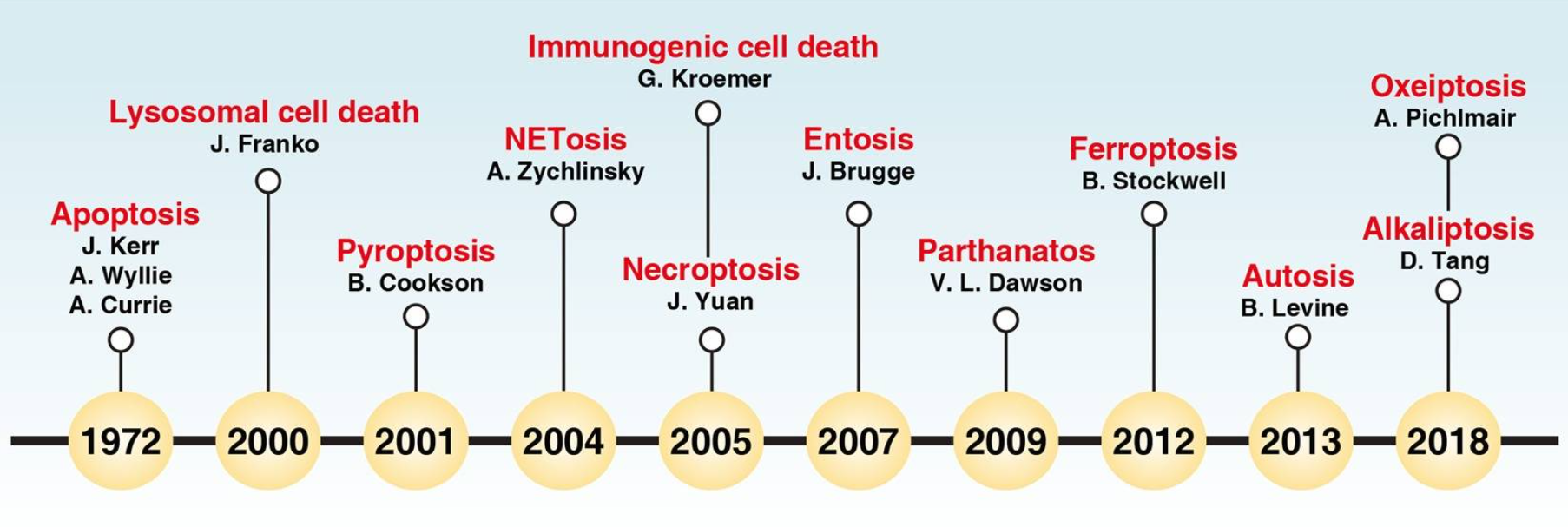
以前小医认为细胞死亡只有细胞凋亡和坏死,但随着对细胞死亡的深入了解,小医发现,细胞死亡形式也是多姿多彩的,包括自噬、铁死亡、坏死性凋亡、细胞焦亡等多种形式,然而这还只是细胞决定自己死亡形式的冰山一角,近年来,随着大量科学研究的进展,越来越多的新型死亡形式被发现,下面就和小医一起来学习下细胞的花样死亡吧!
1、坏死(Necrosis):一种非程序化的、不受调节的细胞死亡过程,其特征是细胞肿胀、生物膜完整性丧失、细胞内容物溢出和离子梯度的消散,从而引发炎症反应。
2、细胞凋亡(Apoptosis)、坏死性凋亡(Necroptosis)、细胞焦亡(Pyroptosis)与铁死亡(Ferroptosis),详见“细胞死亡方式与肿瘤研究热点的碰撞”。
3、铜死亡(Cuproptosis):详见“Science|Todd R Golub团队带你了解铜死亡”。
4、细胞胀亡(Oncosis):1910年,vonReckling-hausen首次发现一种因骨软化症而肿胀、坏死的骨细胞,1995年,Majno和Joris提出了Oncosis的概念,将具有明显肿胀特征的细胞死亡称为Oncosis。胀亡细胞周围有明显炎症反应。
5、自噬(Autophagy):百度百科的解释为,由Ashford和Porter在1962年发现细胞内有“自己吃自己”的现象后提出,是指从粗面内质网的无核糖体附着区脱落的双层膜包裹部分胞质和细胞内需降解的细胞器、蛋白质等成分形成自噬体(autophagosome),并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞本身的代谢需要和某些细胞器的更新。
6、失巢凋亡(Anoikis):是1994年首次命名的一种特殊的程序化细胞死亡形式,由细胞与细胞外基质(Extracellular matrix,ECM)和其他细胞失去接触而诱发,caspase作为关键信号通过依赖线粒体和caspase活化影响细胞死亡,是失巢凋亡的重要机制。
7、副凋亡(Paraptosis):2000年Sperandio等在293T细胞系中超表达胰岛素样生长因子1受体(IGFIR)时发现的一种非凋亡性细胞程序死亡,细胞浆空泡化,线粒体和内质网肿胀,但没有核固缩现象。
8、免疫原性细胞死亡(Immunogenic cell death,ICD):2005年提出的用于描述可以引起免疫应答的细胞死亡。ICD是调节性细胞死亡的一个特定变体,由应激压力驱动,可诱导针对死亡细胞抗原的适应性免疫。
9、细胞套亡(Entosis):是2007年首次报道的一种细胞死亡新形式,将细胞能够吞噬整个活细胞和/或濒死细胞的这种非吞噬过程称为“细胞套亡”,有可能成为一种抑制肿瘤的新方法。
10、Parthanatos:又称PARP-1依赖性细胞死亡,2007年由约翰霍普金斯大学医学院Ted Dawson与Valina Dawson夫妻发现的一种基于DNA损伤,PARP-1激活的程序性细胞坏死形式,是一个受到调控过程,由PAR聚集、线粒体凋亡诱导因子AIF转移到细胞核内引起的,它会导致大片段的DNA碎片产生,且不依赖caspase。
11、泛凋亡(PANoptosis):最早在2016年被报道,基于对炎症小体/焦亡与凋亡和坏死性凋亡之间的交互作用的研究而建立,是一种炎症性程序细胞死亡,受PANoptosome(泛凋亡体)复合物调控,具有Pyroptosis、Apoptosis和/或Necroptosis的关键特征,这也是PANoptosis术语中“P”、“A”和“N”的来源,不可被细胞焦亡、凋亡和坏死性凋亡中任意一种死亡方式单独表征。
12、双硫死亡(Disulfidptosis):2023年,德克萨斯大学MD安德森癌症中心甘波谊教授和陈俊杰教授团队发现的一种新的细胞死亡机制,由细胞内过量胱氨酸积累引起的二硫化物应激(disulfide stress)导致的快速死亡方式,通常在葡萄糖饥饿的条件下发生。
不知不觉,小医已经学习了这么多细胞死亡方式,由于篇幅有限,小医下面就介绍几种近年来发现的热门死亡方式,对其余经典死亡方式感兴趣的的小伙伴,可自行学习哟!
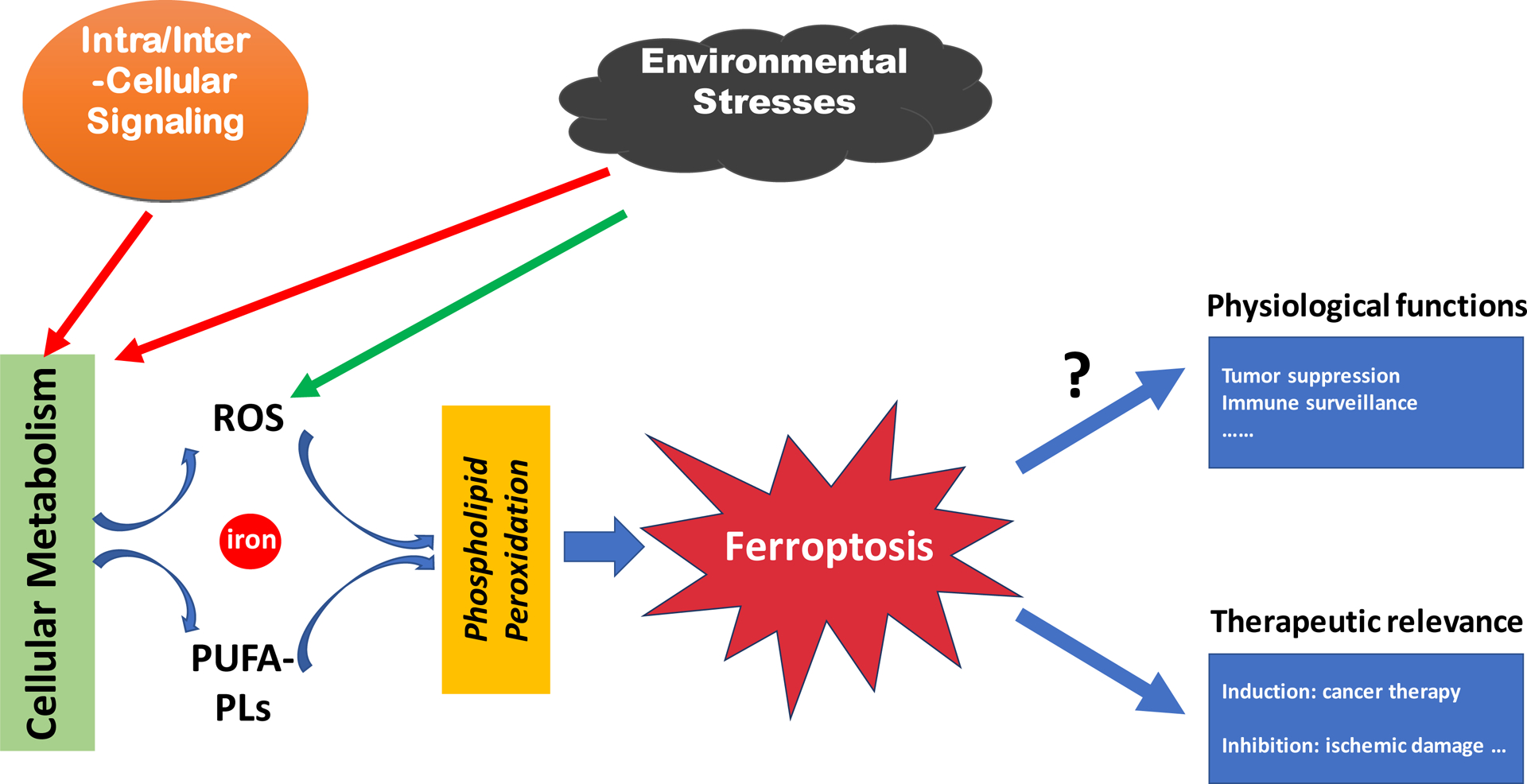
图1 铁死亡概述示意图(Jiang et al., 2021)。
Ferroptosis其主要机制是在二价铁或酯氧合酶的作用下,催化细胞膜上高表达的不饱和脂肪酸,发生脂质过氧化,从而诱导细胞死亡;此外,铁死亡还表现为抗氧化体系(谷胱甘肽系统)的调控核心酶谷胱甘肽过氧化物酶(GPX4)的降低。其主要特征为:线粒体变小,膜密度增高,嵴减少,细胞核形态变化不明显;脂质过氧化增高,在铁离子催化作用下,活性氧(ROS)升高,胞内氧化还原失衡,释放前炎症介质。
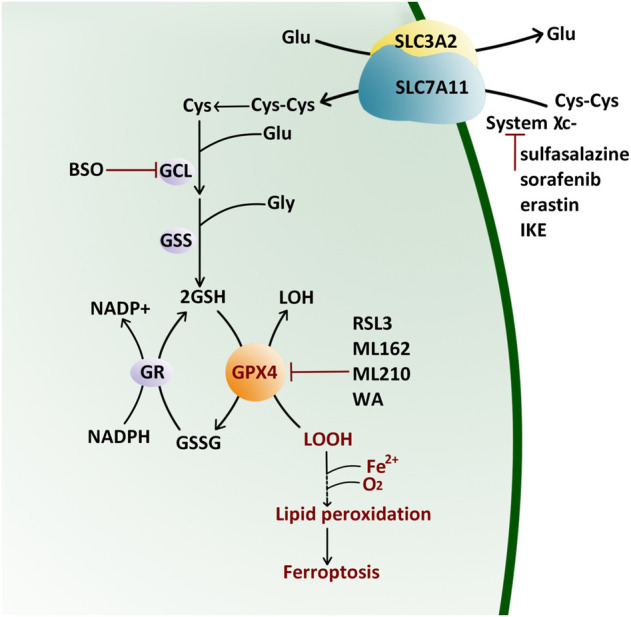
谷胱甘肽过氧化物酶4(GPX4)是一种硒蛋白,在铁死亡过程中起着主要调节作用,其独特的功能是通过将脂质氢过氧化物转化为无毒的脂质醇来中断脂质过氧化,谷胱甘肽(GSH)的生物合成和GPX4的正常功能是控制铁死亡的核心,抑制GPX4可增加细胞铁死亡的敏感性。铁的积累会产生特定的磷脂氢过氧化物,这些氢过氧化物会通过xc-/GSH/GPX4轴被细胞内源性地抵消。胱氨酸被xc系统吸收后,还原成半胱氨酸合成GSH,维持GPX4的活性(图2)。如果该过程的任何一步被破坏,GPX4的活性就会降低,导致细胞内过氧化物的积累,从而导致铁死亡。
图2 GPX4动力学模式(Cui et al., 2022)。
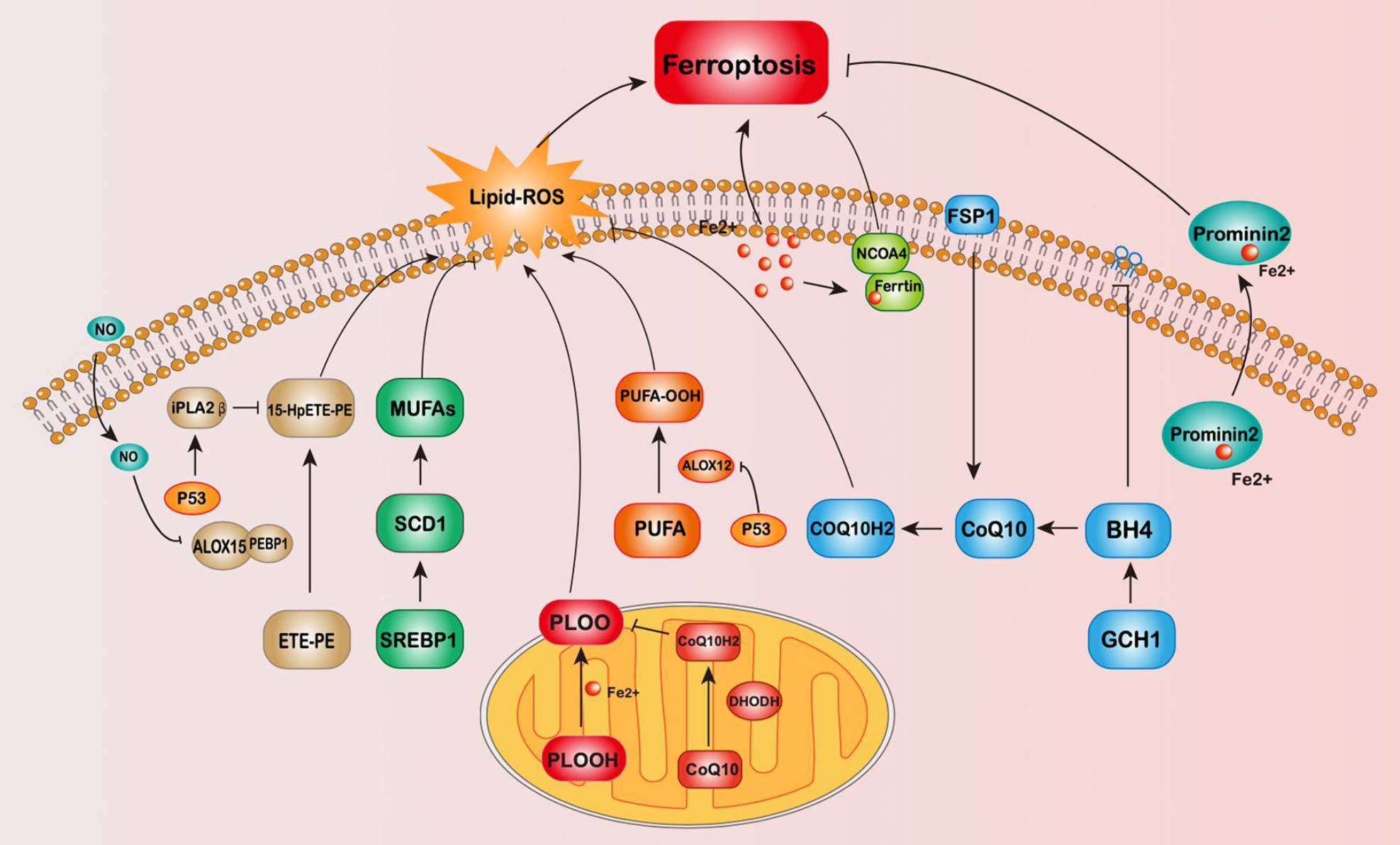
在抗铁死亡细胞系MCF-7的研究中,研究人员筛选了GPX4缺失的互补基因,发现了AIFM2基因,该基因最初被发现可诱导细胞凋亡,研究人员将其命名为FSP1,此后,一些研究证明FSP1可以抵抗铁死亡(Ma et al., 2022)。研究发现,FSP1在GPX4敲除细胞中过表达也能显着减少磷脂过氧化产物,从而抑制铁死亡的发生,说明FSP1的抗铁死亡作用不依赖于GPX4的表达。
随着发现FSP1可以独立于GPX4调节铁死亡,研究人员更加热衷于寻找不依赖GPX4 的铁死亡途径。ALOX和iPLA2β、iNOS、GCH1、DHODH、Prominin2、MUFA以及其他受FSP1和p53调节的途径已被发现(图3)。
近年来的研究指出,具有多重药物抗药性的肿瘤细胞,尤其是处于间充质状态且易于转移的肿瘤细胞,非常容易发生铁死亡。此外,许多器官损伤和退行性疾病也是由铁死亡引起的。
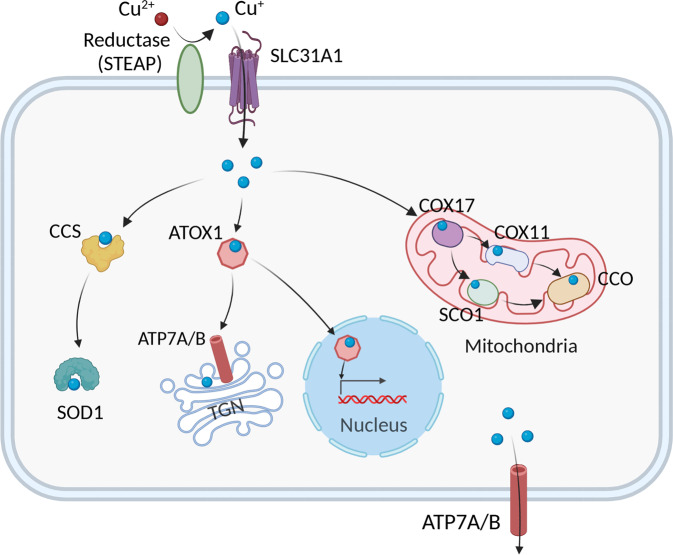
为了在细胞水平上维持Cu稳态,细胞内Cu含量受Cu依赖性蛋白质的复杂网络调节,包括铜酶、Cu伴侣蛋白和膜转运蛋白。这些蛋白质协同工作以协调Cu的输入、输出和细胞内利用,从而将细胞内的Cu水平维持在特定范围内,这有助于防止Cu过载和Cu缺乏的后果(Chen et al., 2022)。
高亲和力铜转运蛋白CTR1(也称为SLC31A1)在结构和功能上从酵母到人类都是保守的,负责将大部分铜吸收到细胞中。越来越多的证据表明,CTR1可转运Cu+,并且其还可能与金属还原酶(如STEAP和/或DCYTB)一起发挥作用,将Cu2+转运跨膜(图4)。
图4 介导细胞铜代谢的途径总结(Chen et al., 2022)。
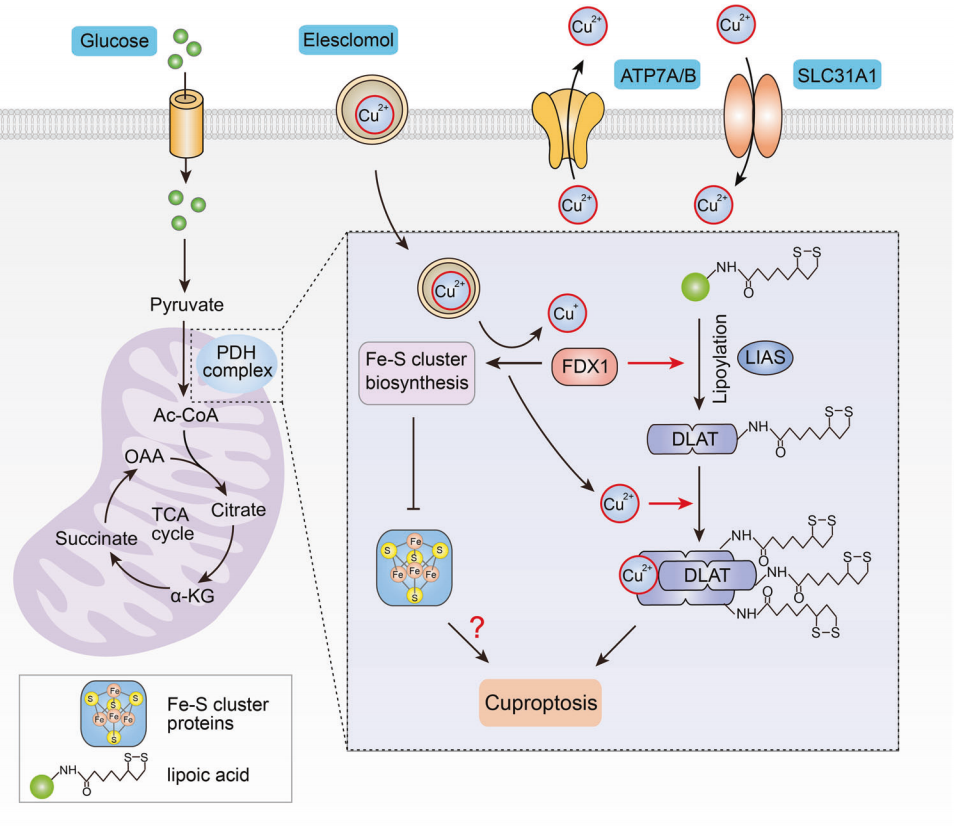
2022年,Tsvetkov等在Science发表的题为“Copper induces cell death by targeting lipoylated TCA cycle proteins.”一文,正式提出了cuproptosis一词,揭示细胞内过量的铜可促进脂酰化蛋白的聚集以及Fe-S簇蛋白的不稳定,导致蛋白毒性应激并最终导致细胞死亡,这与线粒体TCA循环有关(图5)。
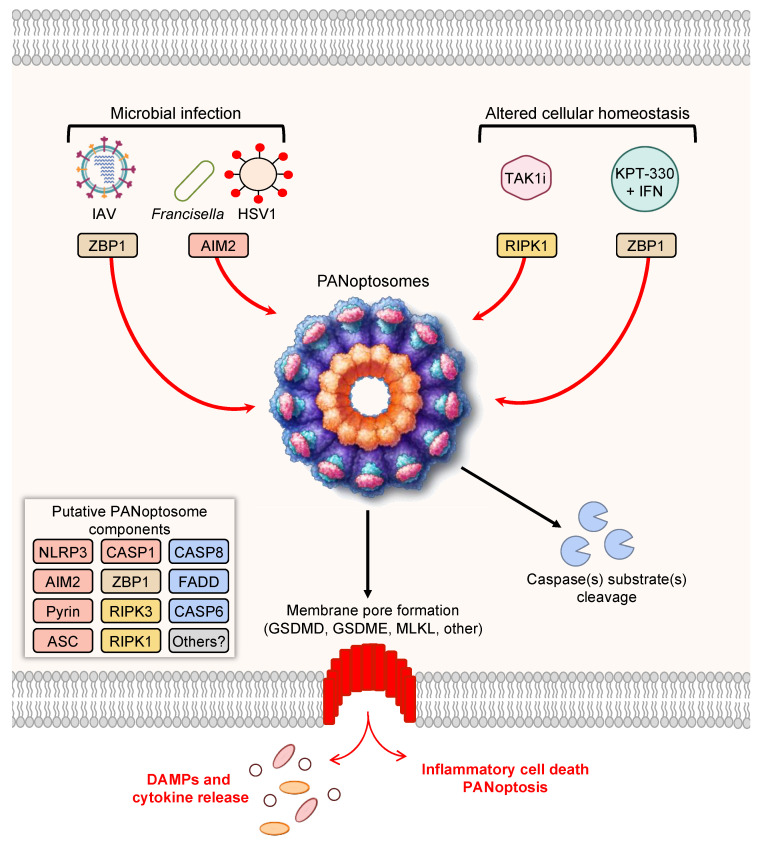
图6 PANoptosis和PANoptosome形成示意图(Gullett et al., 2022)。
最初研究显示PANoptosome含有RIPK1、ASC、NLRP3和CASP8蛋白,随后的研究确认RIPK3、CASP6、ZBP1和CASP1也是PANoptosome的组成成分,即PANoptosome包含了细胞焦亡、细胞凋亡和坏死性凋亡的至关重要的分子,并且能够激活所有这三者以执行促炎性细胞死亡。遗传学研究证实,PANoptosome成分已经进化为在细胞稳态、发育和炎症免疫反应中发挥关键作用。这也决定了泛凋亡参与多种疾病进展,包括脑缺血,细菌、病毒和真菌感染,口腔感染,炎性疾病,肿瘤及肿瘤治疗等(图7)。
遗传和生化数据表明,作为PANoptosome部分的蛋白质通常可以分为三类:
(1)ZBP1和NLRP3作为假定的PAMP和DAMP传感器;
(2)ASC和FADD作为接头蛋白;
(3)RIPK1、RIPK3、CASP1和CASP8作为催化效应子。
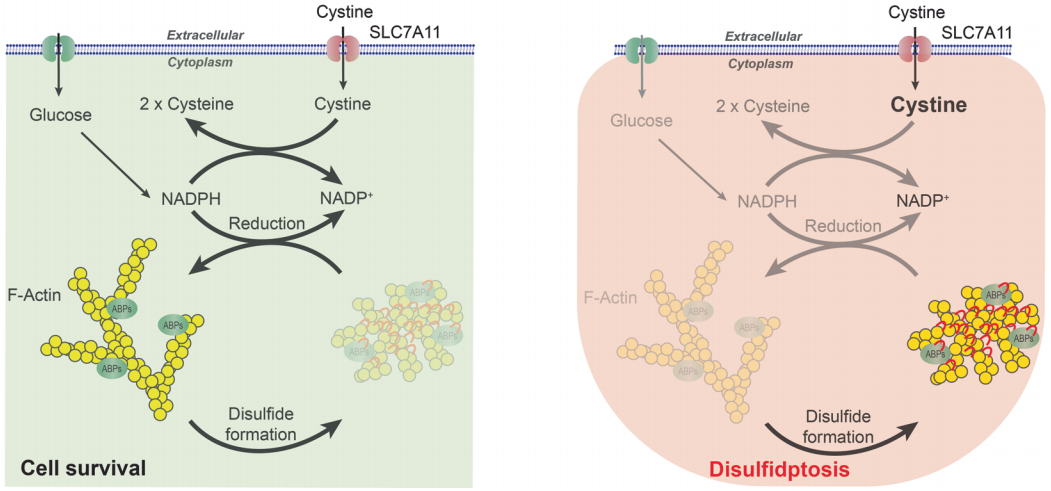
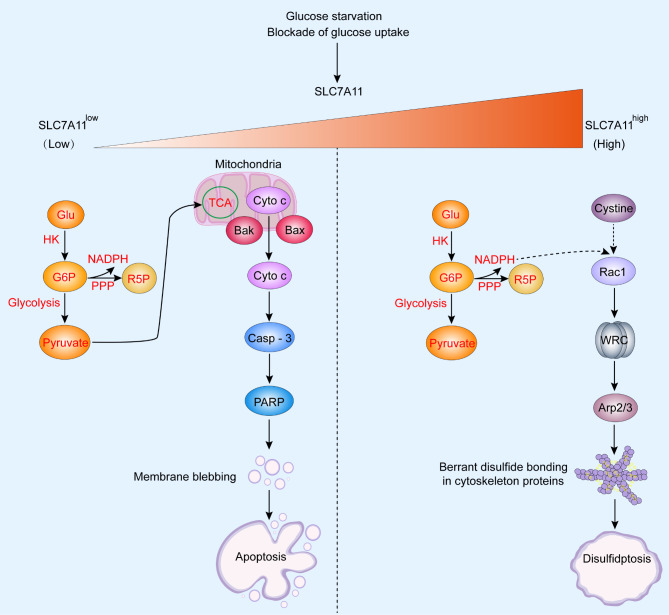
图8 葡萄糖转运蛋白抑制剂诱发肿瘤双硫死亡示意图(Liu et al., 2023)。
研究指出,双硫死亡的激活需要三个标志:
(1)SLC7A11高表达;
(2)葡萄糖饥饿条件阻断葡萄糖代谢,通过戊糖磷酸途径(PPP)生成还原形式的烟酰胺腺嘌呤二核苷酸磷酸(NADPH);
(3)肌动蛋白-细胞骨架蛋白之间形成异常二硫键。当满足所有这些条件时,就会发生二硫化物的过度积累,这有助于肌动蛋白-细胞骨架蛋白之间的二硫键结合以及肌动蛋白收缩和与质膜的分离,最终导致细胞收缩和死亡。详细而言,SLC7A11低表达与葡萄糖饥饿或葡萄糖摄取阻断相结合会降低细胞内葡萄糖水平,抑制葡萄糖6-磷酸的形成,并分别通过PPP和糖酵解抑制NADPH和丙酮酸的形成,随后,三羧酸(TCA)循环和线粒体氧化磷酸化形成丙酮酸受抑制,导致氧化应激和ATP耗竭。SLC7A11高表达与葡萄糖饥饿或葡萄糖摄取阻断相结合会导致胱氨酸高摄取、半胱氨酸减少、NADPH耗竭和二硫化物在细胞内积累,最终导致二硫化物应激(图9)。
Cui C, Yang F, Li Q. Post-Translational Modification of GPX4 is a Promising Target for Treating Ferroptosis-Related Diseases. Front Mol Biosci. 2022;9:901565.
Gullett JM, Tweedell RE, Kanneganti TD. It’s All in the PAN: Crosstalk, Plasticity, Redundancies, Switches, and Interconnectedness Encompassed by PANoptosis Underlying the Totality of Cell Death-Associated Biological Effects. Cells. 2022;11(9):1495.
Jiang X, Stockwell BR, Conrad M. Ferroptosis: mechanisms, biology and role in disease. Nat Rev Mol Cell Biol. 2021;22(4):266-282.
Liu X, Nie L, Zhang Y, et al. Actin cytoskeleton vulnerability to disulfide stress mediates disulfidptosis. Nat Cell Biol. 2023;25(3):404-414.
Ma T, Du J, Zhang Y, Wang Y, Wang B, Zhang T. GPX4-independent ferroptosis-a new strategy in disease’s therapy. Cell Death Discov. 2022;8(1):434.
Samir P, Malireddi RKS, Kanneganti TD. The PANoptosome: A Deadly Protein Complex Driving Pyroptosis, Apoptosis, and Necroptosis (PANoptosis). Front Cell Infect Microbiol. 2020;10:238.
Tang D, Kang R, Berghe TV, Vandenabeele P, Kroemer G. The molecular machinery of regulated cell death. Cell Res. 2019;29(5):347-364.
Tsvetkov P, Coy S, Petrova B, et al. Copper induces cell death by targeting lipoylated TCA cycle proteins. Science. 2022;375(6586):1254-1261.
Wang Y, Zhang L, Zhou F. Cuproptosis: a new form of programmed cell death. Cell Mol Immunol. 2022;19(8):867-868.
Zheng T, Liu Q, Xing F, Zeng C, Wang W. Disulfidptosis: a new form of programmed cell death. J Exp Clin Cancer Res. 2023;42(1):137.