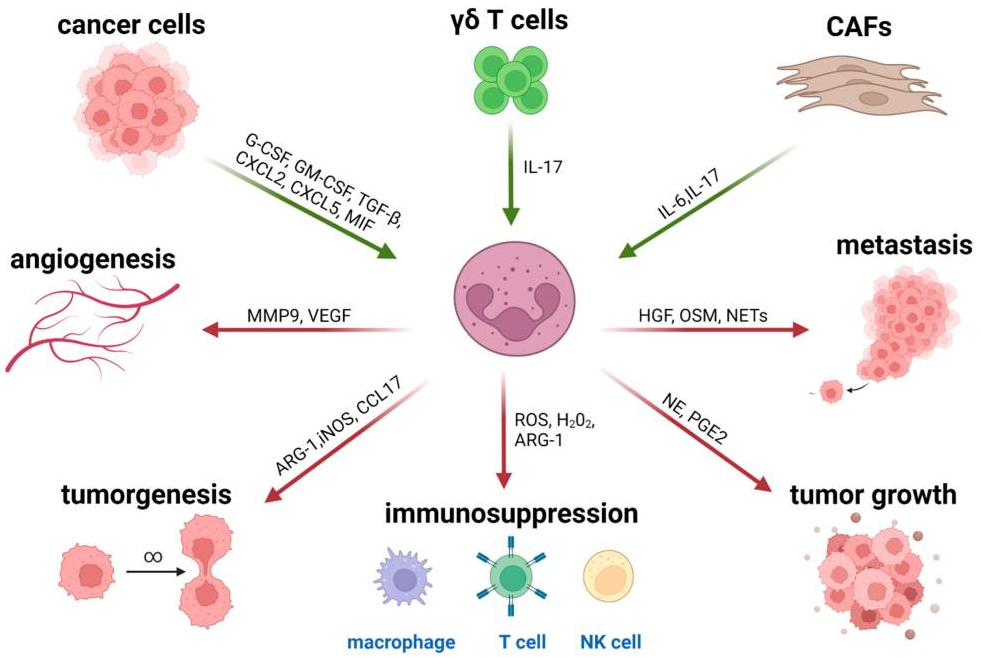
肿瘤微环境(TME)的影响最近也在治疗耐药性的背景下得到强调,其涉及多种类型的免疫抑制细胞,包括肿瘤相关巨噬细胞(TAM)、调节性T细胞(Treg)、髓源性抑制细胞(MDSC)、间充质基质细胞(MSC)及肿瘤相关中性粒细胞(TAN)。其中招募到TME中的TANs是细胞因子和趋化因子分泌的来源,可影响先天性和适应性免疫(图1)(Raftopoulou et al., 2022)。
图1 响应TME衍生刺激示意图。趋化因子和细胞因子(绿色箭头)调控中性粒细胞募集部位。极化TAN在中性粒细胞衍生因子的帮助下发挥免疫抑制和促肿瘤功能(红色箭头)。
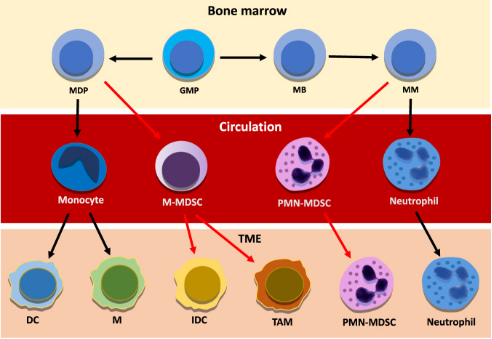
研究显示,恶性细胞主要通过促进病理激活骨髓源性抑制细胞(MDSC)的产生来逃避免疫监视。细胞毒性T细胞、记忆T细胞、TH1细胞和B细胞与延长生存有关,而Treg细胞、MDSC和中性粒细胞密度的升高与不良预后有关(Bruni et al., 2020)。在肿瘤分泌的生长因子和炎症介质的持续影响下,多形核髓源性抑制细胞(Polymorphonuclear myeloid-derived suppressor cells,PMN-MDSC)以及单核MDSC细胞群(M-MDSC)可从它们在骨髓中的前体开始大量扩增(图2)。当在TME中时,大多数M-MDSC分化成其他细胞类型,而PMN-MDSC由于TME介导的表型转换而增强了它们的促肿瘤免疫抑制能力和对细胞凋亡的抵抗力。
图2 中性粒细胞和PMN-MDSC从骨髓向血液及TME分化的示意图。
在恶性转化的早期阶段,经典激活的抗肿瘤中性粒细胞普遍存在;在疾病进展期间,PMN-MDSC水平增加,成为循环中重要的免疫抑制细胞类型,被招募到TME中,以帮助建立促肿瘤逃逸的免疫抑制环境。在TME中,经典激活的中性粒细胞具有抗肿瘤功能,而免疫抑制性PMN-MDSC驱动肿瘤,促进炎症,这与较差的肿瘤结果相关(Jaillon et al. 2020)。
接下来,就和伯小医一起来揭秘一下中性粒细胞与PMN-MDSC在肿瘤治疗中的应用与研究进展吧!
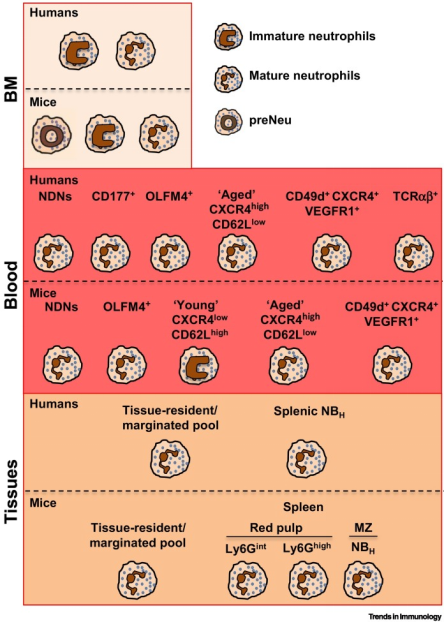
图3 稳态条件下的中性粒细胞群示意图(Silvestre-Roig et al.,2019)。
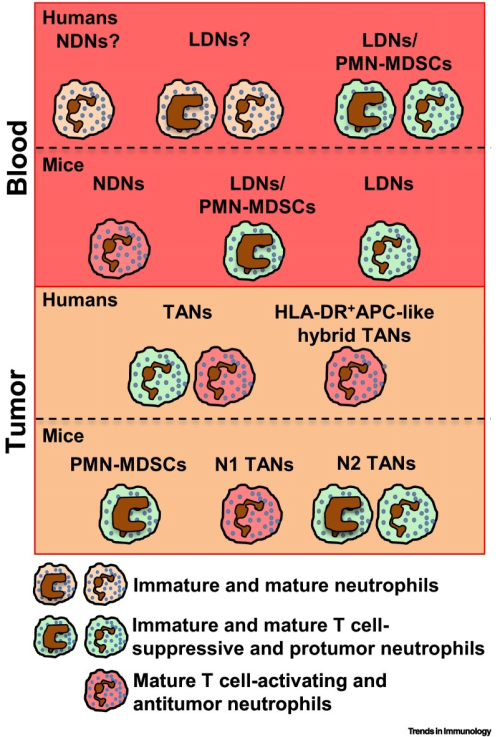
目前,已在肿瘤患者以及荷瘤小鼠的循环和肿瘤组织中鉴定出多种及异质的中性粒细胞群(如LDN/PMN-MDSC),这些中性粒细胞群均具有促肿瘤或抗肿瘤功能,包括非小细胞肺癌(NSCLC)、头颈癌(HNC)、肝细胞癌、结直肠癌等(图4)。并且,肿瘤相关中性粒细胞(TAN)在肿瘤微环境中的大量浸润与预后不良有关,其可用于早期肿瘤评估。
图4 肿瘤中的中性粒细胞群(Silvestre-Roig et al.,2019)。
PMN-MDSC
PMN-MDSC最初是指未成熟的免疫抑制性粒细胞,能够抑制免疫反应。其与中性粒细胞之间存在显著的表型和功能重叠,因此很难清楚地区分这两者。PMN-MDSC含有高水平的PGE2、ROS、诱导型一氧化氮合酶和精氨酸酶,LOX1与FATP2被鉴定为PMN-MDSC的特异性标志物。
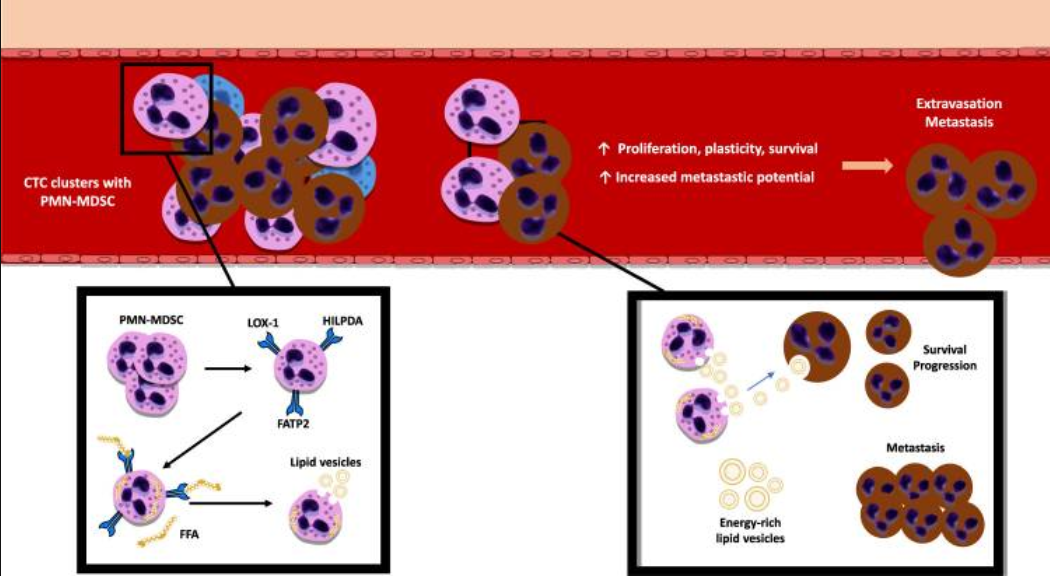
临床前研究表明,富含脂质的PMN-MDSC在迁移过程中是为循环肿瘤细胞(circulating tumor cell,CTC)提供燃料的能源,其通过为CTC提供富含能量的脂质囊泡来支持细胞周期进程以及CTC存活(图5)。也就是说,PMN-MDSC可诱导免疫抑制和肿瘤细胞从宿主免疫中逃逸。
图5 PMN-MDSC与CTC及基质细胞的传播
世卫组织全球乳腺癌行动(GBCI)的目标是让全球乳腺癌死亡率每年下降2.5%,从而在2020至2040年期间在全球范围内减少乳腺癌死亡250万人。全球乳腺癌死亡率每年下降2.5%,到2030年乳腺癌死亡减少25%,到2040年70岁以下女性乳腺癌死亡率减少40%。实现这些目标的三大支柱是:早发现,促进健康;及时诊断;全面乳腺癌管理。综上,对于TNBC的治疗,目前仍亟需更多的有效治疗策略与理论依据。
PMN-MDSCTME
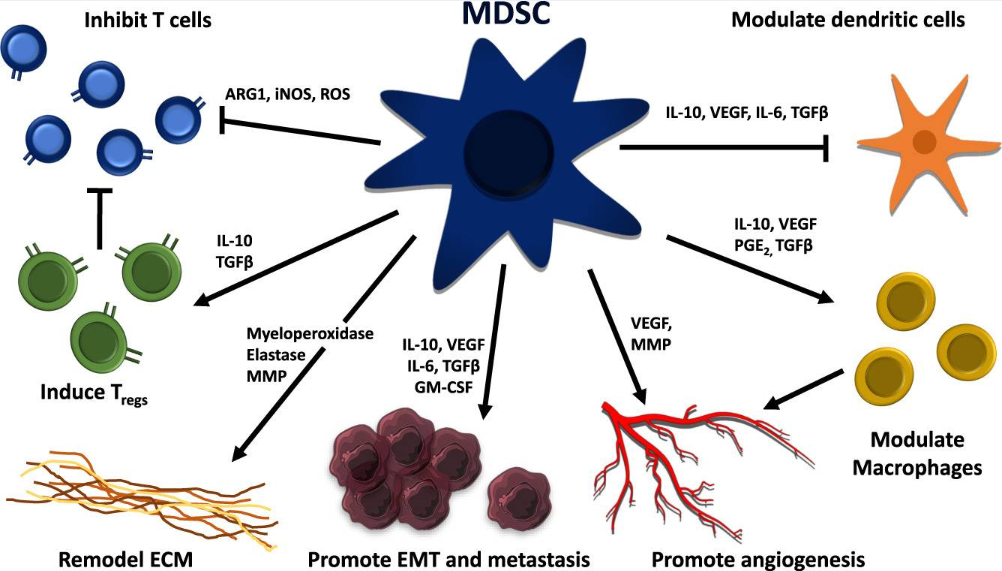
中性粒细胞和PMN-MDSCTME之间具有显著的可塑性和表型范围,已在小鼠模型中证明,PMN-MDSCTME与循环PMN-MDSC具有相似的表面标志物,可过表达多种促肿瘤细胞因子、趋化因子和粘附分子,除ROS外,细胞质颗粒还含有多种酶(髓过氧化物酶、弹性蛋白酶和MMP)。除组织驻留的基质细胞,PMN-MDSC还支持转移前小生境(PMN)的形成以及播散性肿瘤细胞(DTC)的定植和生长(图6)。
图6 髓源性抑制细胞促进恶性肿瘤相关机制概述(Raskov et al., 2022)。
研究显示,CCL17(GM-CSF下游介质和免疫抑制性调节性T细胞的募集者)是PMN-MDSCTME中与疾病进展和不良预后相关最强烈的上调基因之一。并且,在一项对18000个肿瘤组织样本的荟萃分析中发现,肿瘤内PMN-MDSCTME基因表达特征是所有肿瘤类型中低存活率的最强预测因子(Gentles et al., 2015)。总而言之,PMN-MDSCTME的鉴定为进一步了解其功能和改进肿瘤诊断与治疗轨迹提供了广阔空间。
临床前研究表明,表观遗传修饰剂恩替司他(组蛋白去乙酰化酶抑制剂)与5-氮杂胞苷(DNA甲基化阻滞剂)同ICI联合使用具有协同作用。遗憾的是,虽然目前已开展了大规模的免疫分析临床工作,但很少有靶向MDSC疗法与ICI相结合进入临床的实例。
同时,抗体疗法的开发人员也正在积极寻找扩大双特异性和三特异性单克隆抗体和细胞接合结构的可能性。到目前为止,只有一种这样的抗体(blinatumomab)被FDA批准用于治疗淋巴细胞白血病。与CAR-T疗法一样,由于缺乏独特的肿瘤抗原,靶向实体瘤的抗体进展缓慢。
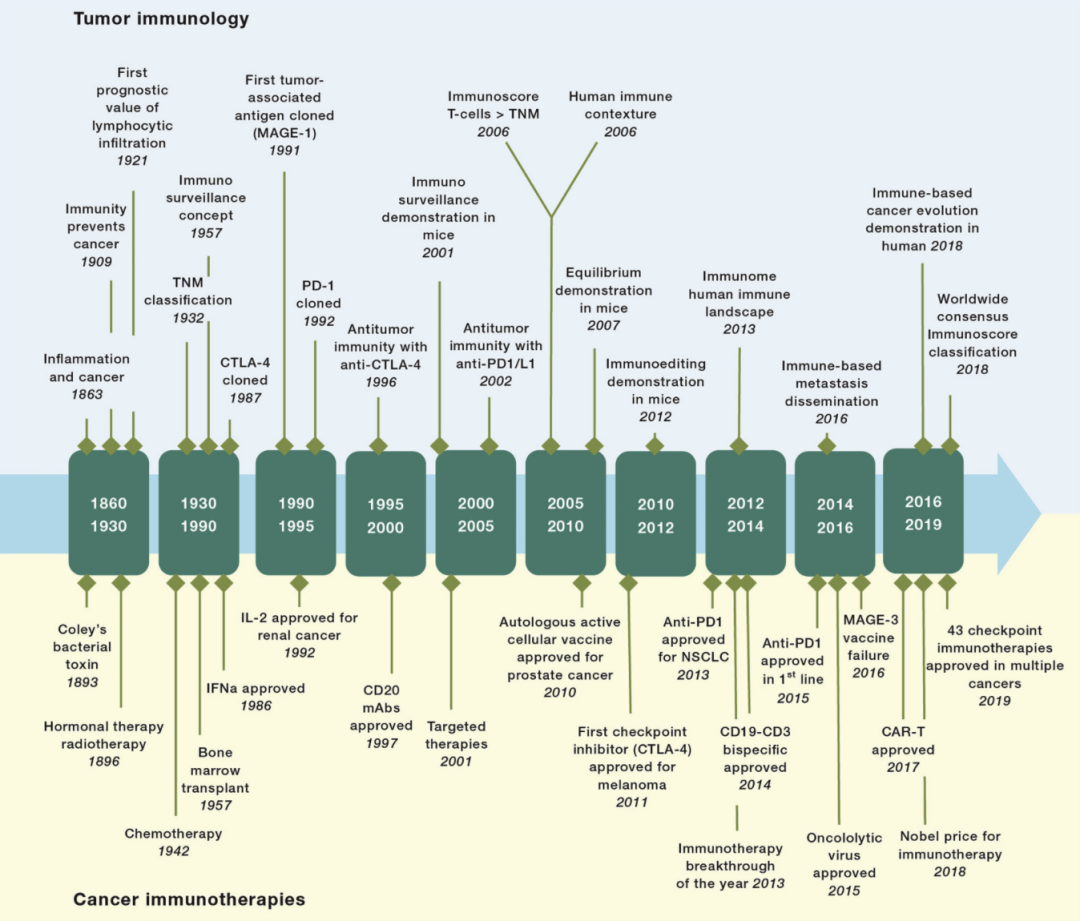
图7 肿瘤免疫学及肿瘤治疗与免疫治疗主要里程碑(Galon J and Bruni D., 2020)。
趋化因子抑制剂
趋化因子受体及其配体在中性粒细胞运输中发挥重要作用,其中,以阻断肿瘤细胞迁移为目标的CXCR1/2拮抗剂已开始进入临床;CXCR4抑制剂ulocuplumab已在血液恶性肿瘤中进行了研究;CJM112(抗IL17A和抗IL17F)治疗目前正在多发性骨髓瘤中进行评估;但英夫利昔单抗等抗TNFα单克隆抗体在肿瘤中的作用仍有争议。
TGF-β抑制剂
肿瘤细胞过度表达TGFβ是适应性和先天免疫反应的主要抑制因子,促进了几种肿瘤类型中肿瘤发展的所有阶段。除了将中性粒细胞极化为PMN-MDSC外,TGFβ还是一种强中性粒细胞趋化剂,其抑制可能导致中性粒细胞募集受损。关于TGFβ受体抑制剂的多项试验正在进行中,这些试验通常与ICI或标准疗法联合使用。
酪氨酸激酶抑制剂(TKI)
易位、扩增和突变会激活肿瘤中的许多酪氨酸激酶(TK),其直接涉及所有疾病阶段,并且是药物发现的主要目标。现已开发出多种靶向EGFR、ALK、ROS1、HER2、NTRK、VEGFR、RET、MET、MEK、FGFR、PDGFR和KIT的TKI,40多种药物已获得FDA批准用于肿瘤治疗。
前列腺素E2和COX抑制
除增加有丝分裂信号传导、基因组不稳定性和抑制细胞凋亡外,PMN-MDSC与PMN-MDSCTME释放的PGE2代表了T细胞抑制的重要机制。多项临床前试验已证明,抑制COX2可提高免疫疗法疗效,多项COX2抑制剂和ICI的临床试验正在进行中。目前正在测试一种特定的PGE2受体抑制剂与ICI联合用于微卫星稳定的CRC和NSCLC。
Gentles AJ, Newman AM, Liu CL, et al. The prognostic landscape of genes and infiltrating immune cells across human cancers. Nat Med. 2015;21(8):938-945.
Jaillon S, Ponzetta A, Di Mitri D, et al. Neutrophil diversity and plasticity in tumour progression and therapy. Nat Rev Cancer. 2020;20(9):485-503.
Mantovani A, Cassatella MA, Costantini C, et al. Neutrophils in the activation and regulation of innate and adaptive immunity. Nat Rev Immunol. 2011;11(8):519-531.
Raftopoulou S, Valadez-Cosmes P, Mihalic ZN, et al. Tumor-Mediated Neutrophil Polarization and Therapeutic Implications. Int J Mol Sci. 2022;23(6):3218.
Raskov H, Orhan A, Gaggar S, et al. Neutrophils and polymorphonuclear myeloid-derived suppressor cells: an emerging battleground in cancer therapy. Oncogenesis. 2022;11(1):22.
Silvestre-Roig C, Fridlender ZG, Glogauer M, et al. Neutrophil Diversity in Health and Disease. Trends Immunol. 2019;40(7):565-583.
Veglia F, Tyurin VA, Blasi M, et al. Fatty acid transport protein 2 reprograms neutrophils in cancer. Nature. 2019;569(7754):73-78.