今日,CRISPR大牛张锋团队在《自然》杂志发表新成果,研究者们从微生物取材,制造出了全新的蛋白递送系统。该系统形似“注射器”,可以通过改变结合基团以接近100%的效率靶向特定细胞,递送Cas9蛋白等基因编辑组件或生物毒素,以实现基因编辑、调控特定生理过程乃至杀死癌细胞等目的。
从目前的实验细节来看,该系统不仅效率奇高、灵活多变,且免疫原性和生物毒性很低、代谢也非常快,实在是具有了一个好工具的多项优良品质。
感觉继CRISPR之后,生物学研究的工具箱又要大升级了!
就是这回咋没给取个酷炫的名字啊,SHERLOCK啥的
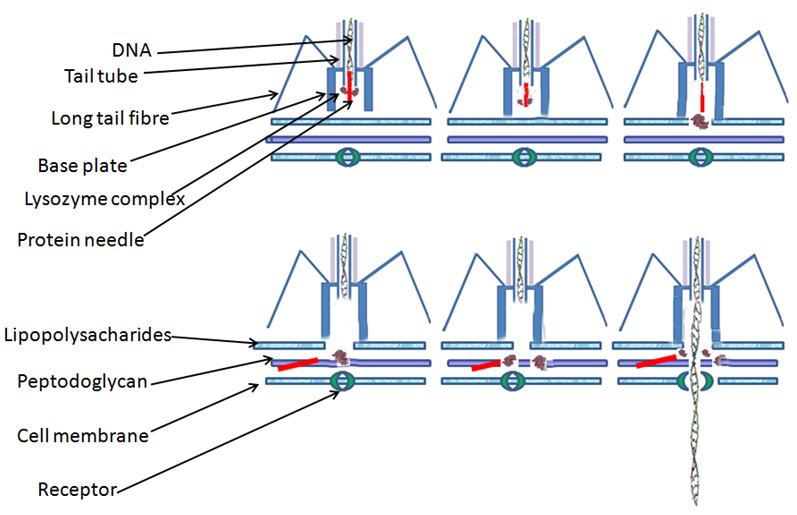
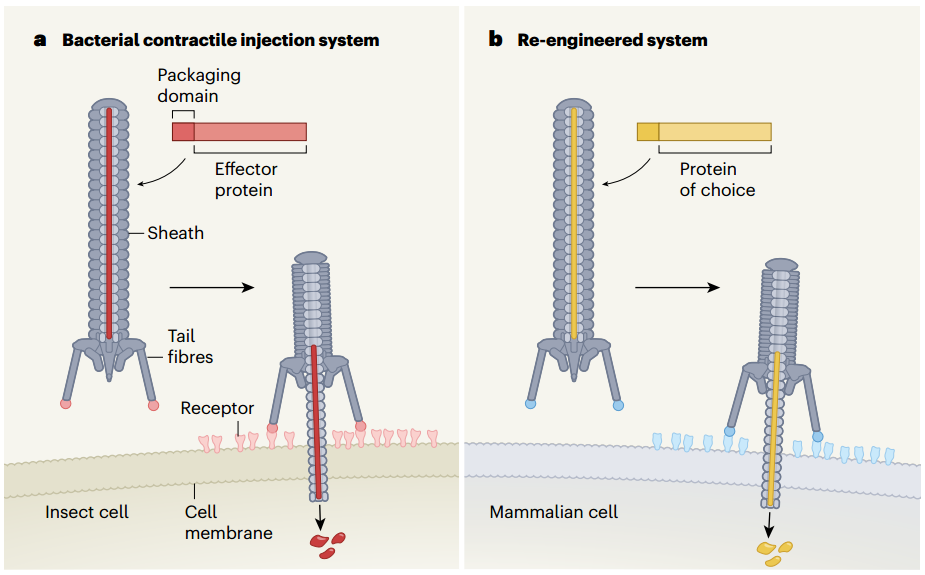
细胞和细胞之间想要传递信息,除了直接“贴贴”,就是分泌调节因子。但这些因子很多时候不能轻松穿透细胞膜,为了克服这个困难,很多“奇怪”玩意儿就出现了。其中之一就是来自细菌的细胞外可收缩注射系统(eCIS)。
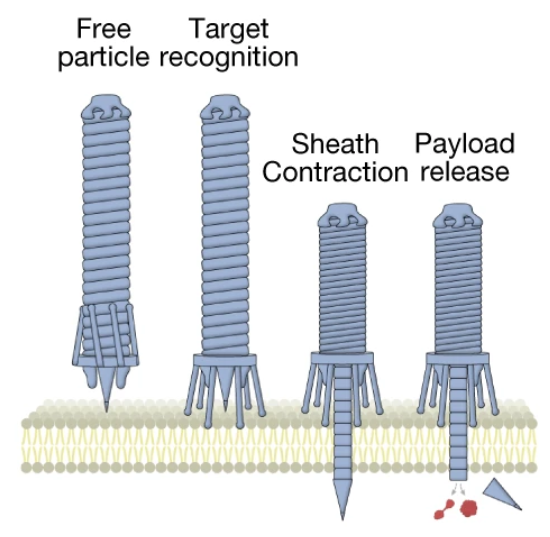
这个东西长得和噬菌体有点像,动作颇像注射器,识别到靶细胞后刺突蛋白穿透细胞膜,随后上端的鞘状结构收缩将内容物“挤”进细胞内。
细想它就只是个蛋白啊,生物真是怪神奇的。
eCIS工作流程
脑子灵活的科学家已经想到了,这东西,可以利用!
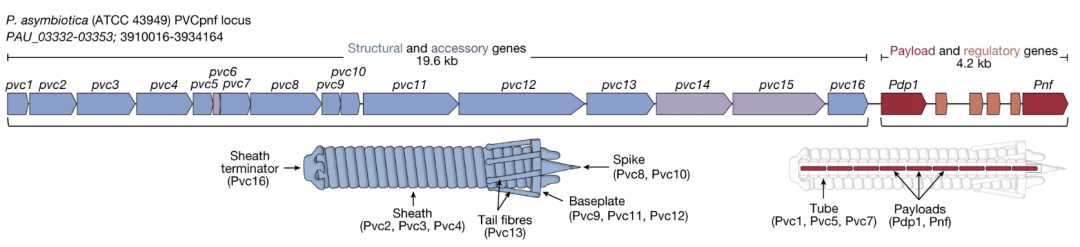
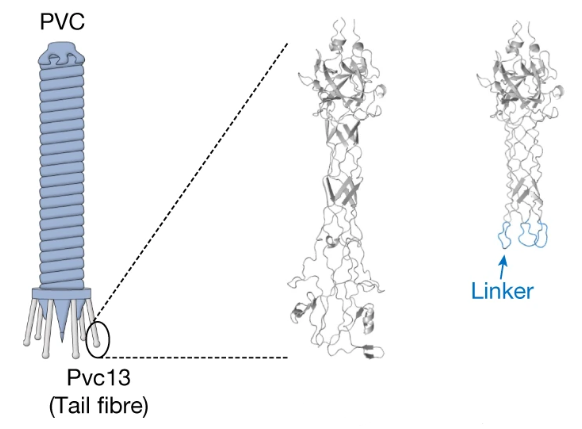
那么我们先来搞搞清楚它的结构吧。张锋团队选择的目标是来自发光杆菌(Photorhabdus)属的一种线虫共生菌,将它的eCIS命名为Photorhabdus virulence cassette(PVC)。
PVC本体基因不足20kb,含16个关键基因,这些基因哪个编码哪部分结构可以看下图↓,下游基因编码内容物,在原装PVC中就是用于杀死线虫细胞的生物毒素Pdp1和Pnf。
PVC基因
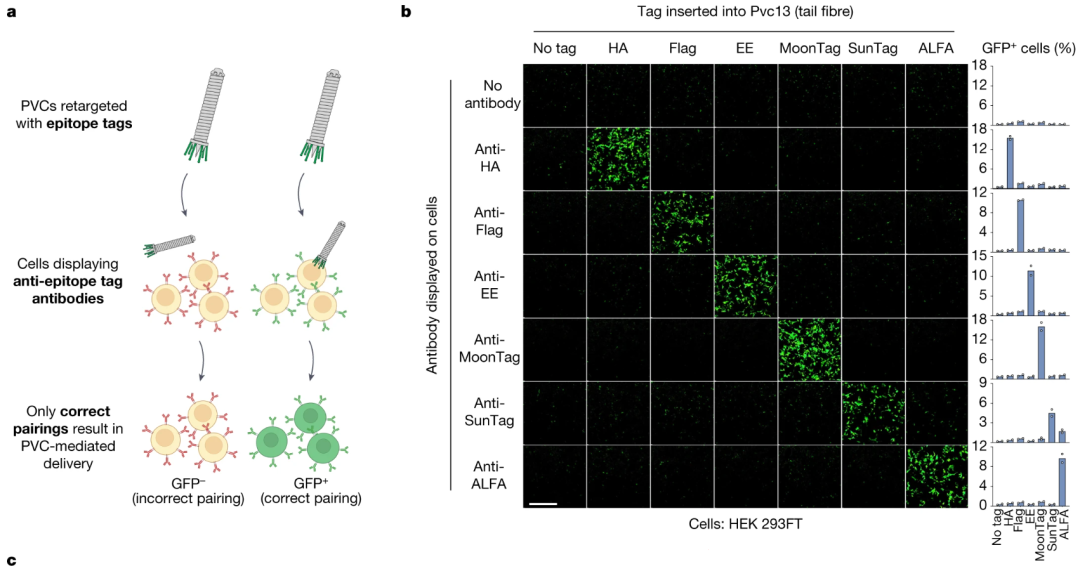
用AlhpaFold推测了一下Pvc13的结构,研究者发现在它的C端形成了一个螺旋管,尖端的球状结构域就是结合靶细胞的关键结构。改变这个部分,我们就能操纵PVC去任何我们想去的地方了。
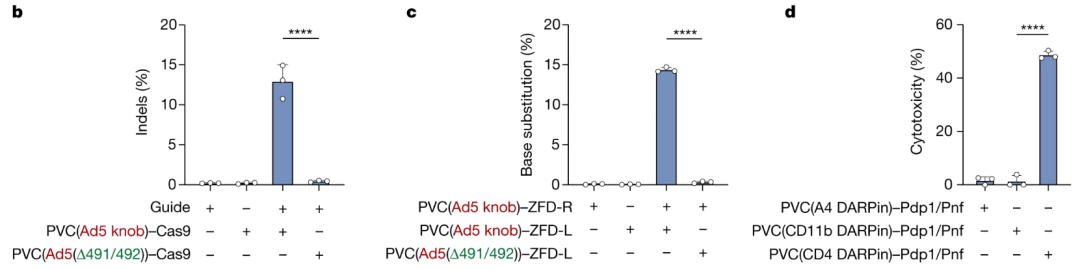
内容物则是选择了CRISPR常用的SpCas9和另一种基因编辑技术元件锌指蛋白(ZFD),以及原装的生物毒素Pdp1/Pnf。
结果真是相当令人吃惊,在A549人类肺腺癌细胞(可被Ad5识别且过表达EGFR可被针对EGFR的DARPin识别)中,改装PVC的效率相当高,几乎不会误识别其他非靶细胞,无论基因编辑还是细胞杀伤都完成得相当不错。
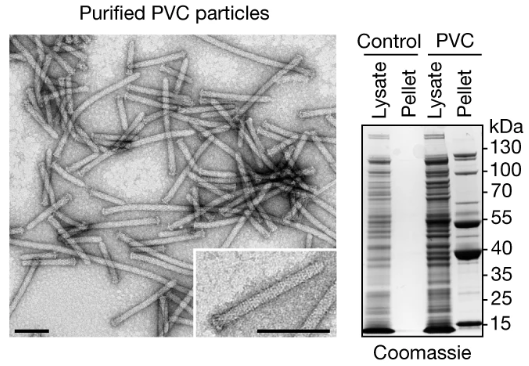
值得注意的是,Cas9蛋白大小约170kDa,而原装的Pdp1/Pnf仅有37kDa,PVC还是很“能装”的。
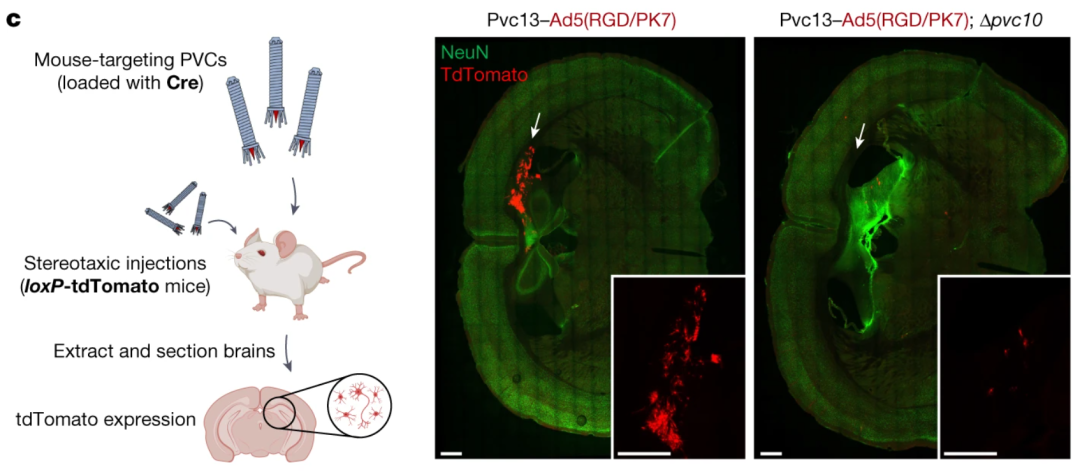
研究者再次利用AlphaFold模拟Pvc13变体,筛选出了能够靶向小鼠细胞的新结构域,令其携带Cre报告系统,并注射到红色荧光报告基因小鼠脑内海马体。
实验结果显示,小鼠海马体中出现了红色荧光,证明PVC在体内也具有活性。而且分离小鼠脑细胞后,研究者发现,荧光信号富集于神经元中,说明实现了对神经元细胞的靶向。
安全、有效、代谢快!
如此简洁有力的工具让人思路迸发,实验中已经展示了PVC在基因编辑和对特定受体细胞(EGFR/CD4)杀伤上的使用,通过改变结构域和内容物的搭配,我们还能够实现对更多生物过程的精准调控。
而且这还只是一个PVC呢,其他细菌也有自己的eCIS,它们会不会还有其他我们没发现的有趣之处呢?真是太令人期待啦!
参考资料:
[1]Kreitz, J., Friedrich, M.J., Guru, A. et al. Programmable protein delivery with a bacterial contractile injection system. Nature (2023). https://doi.org/10.1038/s41586-023-05870-7
[2]Mix-and-match tools for protein injection into cells (nature.com)
文章来源:奇点网