“XX纤维化”这几个字,背后可都是凶神恶煞一般的病魔,比如肺纤维化和肝纤维化。骨髓的纤维化虽说知晓度相比其它器官要低一些,但却同样凶险致命。
图1:骨髓对于人体有多重要?问问红细胞们就知道
在奇点糕看来,骨髓纤维化(MF)的形象和“杀手”特别相符——因为发病率很低,许多人并不了解它;但它却出手狠辣,往往是夺命于无形。放到所有血液系统恶性肿瘤中,MF的难缠和棘手程度也数一数二。
好在随着医学的进步,今天的医生和患者不再对MF束手无策了:以芦可替尼(Ruxolitinib)为代表的Janus激酶(JAK)抑制剂类药物,能有效延缓乃至逆转MF进展,延长生存并改善生活质量,助力MF患者与病魔的抗争。
可以说,JAK抑制剂把MF治疗带进了全新的时代,和新时代配套的则是对疾病的最新认知,从而为全新的疾病管理概念和模式铺路。那么就跟着奇点糕一起了解MF的疾病全貌,看JAK抑制剂如何大显身手吧。
“这个杀手很阴冷”
在世界卫生组织(WHO)血液肿瘤分类系统里,原发性MF属于髓系恶性肿瘤中经典的骨髓增殖性肿瘤(MPNs)之一。《我不是药神》里提到的慢性髓性白血病(CML),其实也属于MPNs,不过原发性MF比CML更为罕见。
据美国SEER癌症数据库2001-2016年的统计,成人原发性MF的发病率仅为0.44/10万人,是费城染色体(BCR-ABL)阴性MPNs中发病率最低的,也符合罕见癌症(发病率<6/10万人)的定义[1];此外一部分其它类型的MPNs,如真性红细胞增多症(PV)和原发性血小板增多症(ET),也可能转化为MF。
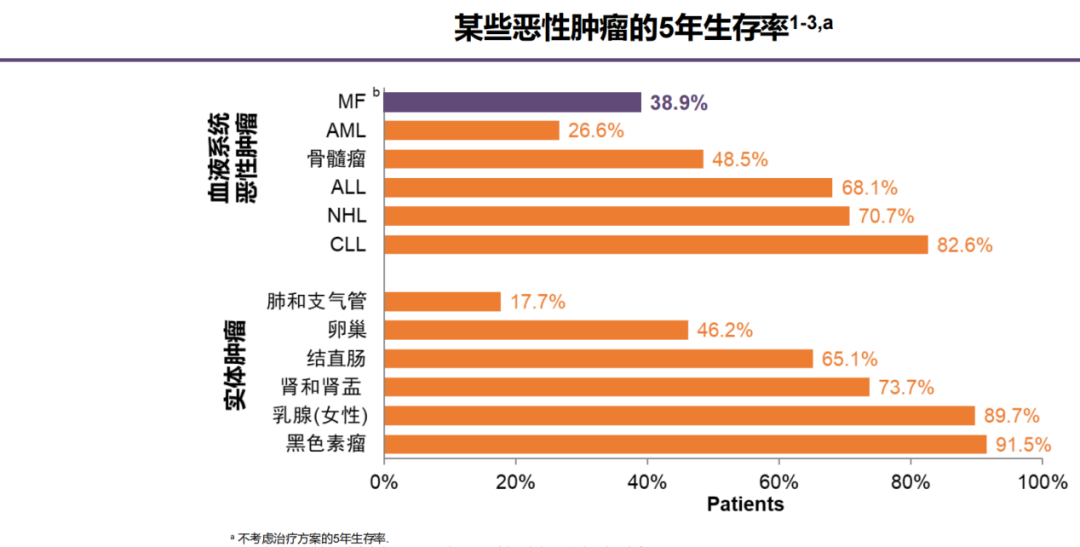
MF的发病率如此之低,就使得社会公众乃至不少临床工作者对它缺乏认知,那么MF有多“要命”呢?同样来自SEER数据库的资料显示,MF患者的5年生存率仅为38.9%,在费城染色体阴性MPNs中相对最低[1-2],且原发性MF患者整体的中位总生存期(OS)只有3.6年[2],远低于其它MPNs(往往>10年),MF的凶残程度由此可见一斑。
图2:MF与其它血液系统癌症及常见实体瘤的5年生存率对比
MF不仅对患者的生命构成巨大威胁,其典型的临床症状群,即脾肿大、全身症状和贫血/血细胞异常,还会严重影响患者的日常生活,例如脾脏肿大常导致患者腹部有明显的不适感、过早饱腹和疼痛,还可能引发门静脉高压等并发症。
还有调查显示,超过50%的MF患者因疲劳、瘙痒和盗汗等全身症状,导致各种日常生活行为和心理健康被深度困扰,疾病负担非常沉重[3]。生存和生活质量两方面都被威胁,那MF患者对有效的治疗手段有多么期待,自然就可想而知了。
不过,现实不是神话传说,“灵丹妙药”能够诞生,也是基于对疾病机制的深入探索,寻找到关键的治疗靶点。MF治疗的破局点,就是JAK抑制剂所针对的Janus激酶们。
降服“两面神”,救骨髓于危难之中
Janus激酶的命名,也算是医学史上的一段经典故事:Janus原意是罗马神话中的“两面神”,传说它有前后两张面孔,所以它的发现者们就借此来形容JAK的标志性特征——存在两个十分相似的结构域。
随着时间的推移,科学家们发现用Janus来命名JAK激酶还是一语双关,因为JAK激酶家族成员们能通过JAK-STAT信号通路,以类似开门/关门的方式调控人体内许多关键的生理功能,而这又符合Janus在罗马神话中同时担当的“门神”职责。
具体到MF而言,2005年剑桥大学的研究团队率先发现,约有一半的MF患者存在编码JAK2激酶的基因突变(JAK2-V617F突变)[4],这堪称对MF乃至全部MPNs探索的里程碑式事件,很快引发了科学界的探索浪潮。
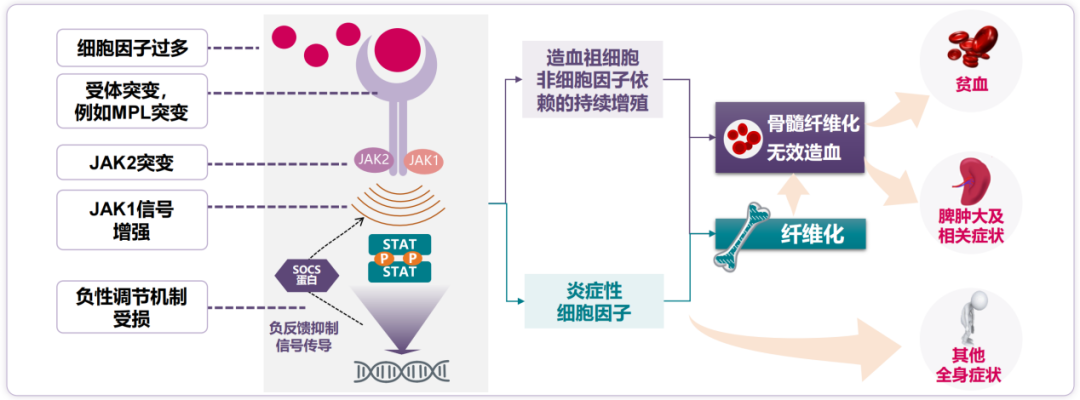
到今天,科学界对JAK-STAT通路在MF发病过程中的作用,也有了更清晰的认识:JAK2突变或其它受体突变,会使JAK-STAT通路异常地持续活化,进而引发造血祖细胞非细胞因子依赖的持续增殖,并使炎症性细胞因子表达增多;这又使MF患者体内三系(红系、粒系和巨核系)血细胞增生异常活跃,但属于“无效造血”。
而巨核细胞与中性粒细胞相互作用,释放TGF-β等细胞因子导致的纤维化和血管生成,以及基质细胞释放骨保护素导致骨硬化,都参与了MF特征性的骨髓纤维化的发生。无效造血及骨髓纤维化,主要与MF患者典型症状中的贫血、脾肿大及相关症状有关,而炎症性细胞因子同时也介导了MF的其它全身症状[5]。
图3:JAK-STAT通路异常活化导致MF的机制
明确JAK2突变参与MF致病,精准治疗药物的研发就有了靶标,芦可替尼从而应运而生。作为一种高选择性的JAK1/2抑制剂,它不受JAK2-V617F突变的影响,竞争性结合JAK2以抑制JAK-STAT通路的异常激活,有效阻断MF关键发病机制(如炎症性细胞因子表达),从而控制疾病进展、改善患者症状[6-7]。
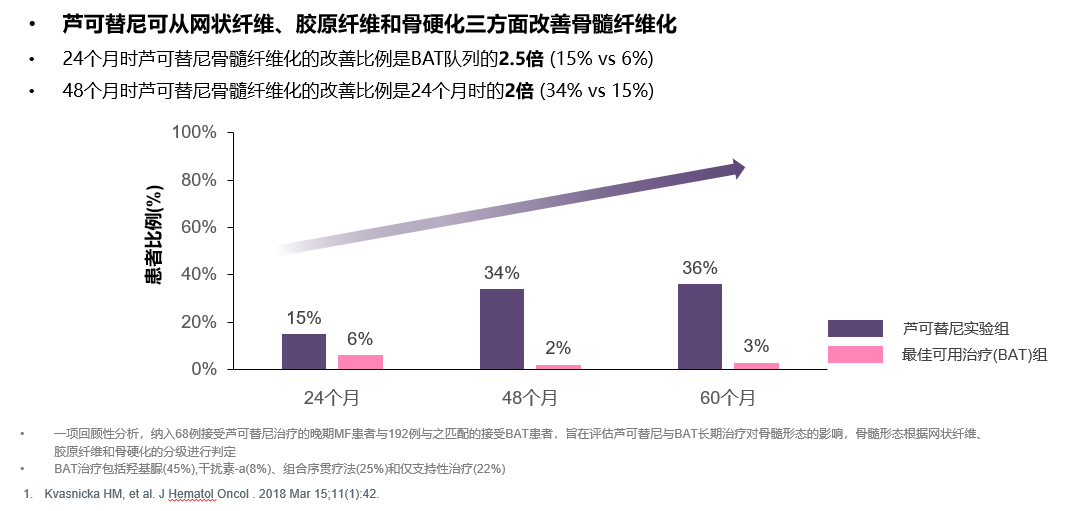
而对早期(I/II期)临床研究中,长期接受芦可替尼治疗患者的分析还显示,芦可替尼不仅能显著延缓患者病情进展,“拖住”骨髓纤维化的脚步,甚至能逆转部分患者的骨髓纤维化,可以说是改变MF疾病进程的一缕曙光[8]。
图4:芦可替尼可改善MF患者的骨髓纤维化进程
基于在关键临床研究中明确的疗效和良好的安全性,芦可替尼于2011年被美国FDA批准上市,成为首个获批治疗MF的药物[9],且迄今它仍然是唯一在我国获批MF适应证的JAK2抑制剂;相比其它用于MF治疗的JAK2抑制剂,芦可替尼的应用时间更长,循证医学证据更充分,也能有效满足患者的治疗需求。
更长生存、更好生活、更灿烂的未来
优秀的MF治疗药物,需要同时达到延长生存、改善症状两大目标,满足患者最迫切的治疗需求。作为精准靶向关键发病机制的首个MF创新治疗药物,芦可替尼的表现如何呢?
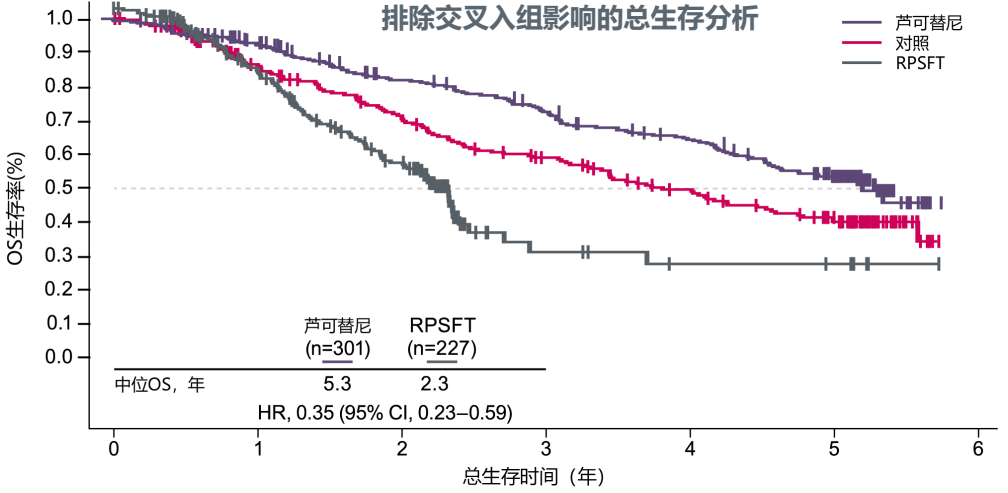
首先在延长生存方面,芦可替尼两项关键临床III期研究COMFORT-I/II的5年汇总分析数据显示,芦可替尼可较对照组(安慰剂或既往最佳可用治疗)显著延长MF患者的中位OS(5.3年 vs. 3.8年),使患者死亡风险降低30%(HR=0.70);而排除治疗交叉(即下图中的RPSFT组),即对照组患者换用芦可替尼的影响后,芦可替尼则能使患者死亡风险下降65%(HR=0.35)[10]。
图5:COMFORT-I/II研究汇总分析,提示芦可替尼对MF患者的生存获益
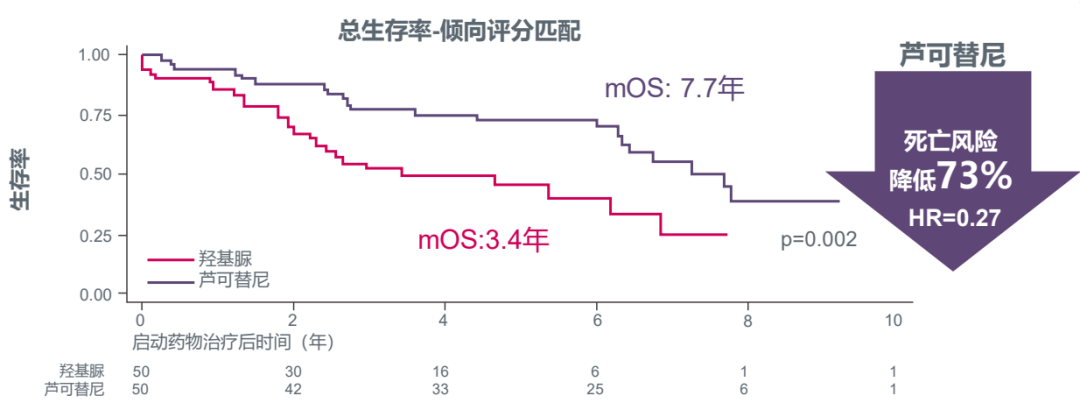
而在真实世界研究中,芦可替尼表现同样亮眼,例如纳入1010例MF患者的真实世界注册研究ERNEST显示,患者接受芦可替尼治疗,较接受羟基脲治疗的死亡风险显著下降了73%(HR=0.27);经匹配对照分析后,芦可替尼治疗患者中位OS更是达到羟基脲组的2倍(7.7年 vs. 3.4年,p=0.002)[11]。
图6:ERNEST真实世界研究提示芦可替尼可使MF患者“生存翻倍”
显著延长生存的目标达成,接下来就是有效改善症状、提高生活质量,让MF患者活得更好了。芦可替尼的表现同样优秀,首先它能快速、显著地使MF患者的脾脏缩小,在COMFORT-II研究中,一半以上的患者在任何时间都实现脾脏体积缩小≥35%,且随访5年时绝大多数患者脾脏相比基线时仍缩小[12]。
与此同时,芦可替尼治疗也能显著改善患者与MF相关的食欲减退、疲劳、疼痛等典型临床症状[13],这种改善从治疗第2个月末就开始显现,而且能够长期维持,转化为生活质量的明显提升,真正让MF患者活得更好[14]。
基于明确的治疗获益,芦可替尼已被国内外MF诊疗的众多权威指南所推荐,如《原发性骨髓纤维化诊断与治疗中国指南(2019年版)》即推荐芦可替尼作为MF一线治疗(用于有脾肿大的IPSS/DIPSS/DIPSS-Plus中危-2和高危患者,或严重脾肿大的中危-1患者),并认可芦可替尼在治疗体质性症状方面的价值[15]。
此外,由于部分MF患者缺乏明显临床症状,有真实世界研究显示超过50%的MF患者初始治疗方案仅为“观察和等待”[16],但这部分患者中也有一些属于中危或高危,甚至已存在明显的症状负担,如不及时干预可能导致不良预后。因此MF诊疗领域近年来也强调“早期干预”的理念,而芦可替尼也有望参与其中。
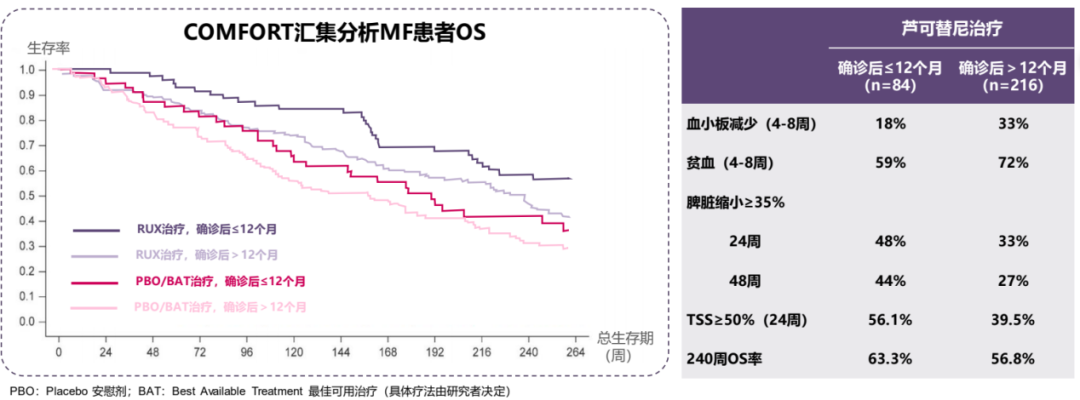
从COMFORT-I/II研究的汇总分析结果来看,患者确诊MF后12个月内即接受芦可替尼治疗,与多项临床结局改善有关[17]。这也与芦可替尼全球扩展研究的结论相似,即芦可替尼作为MF患者一线/二线治疗时,患者生存率相对更高[18];而从延缓乃至逆转骨髓纤维化的角度来看,及早使用芦可替尼也更有望实现目标。
图7:临床研究中芦可替尼早期干预获益更多
而以芦可替尼为基础,与其它治疗药物组成联合方案,或能进一步改变MF疾病进程,全面改善患者的临床结局。在2022年美国血液学会(ASH)年会上,就有多项联合治疗相关的最新研究发布,芦可替尼联合聚乙二醇干扰素α-2a,及BCL-2/BET/PI3Kδ抑制剂等在研新药的表现都非常出色,未来成果值得期待。
总而言之,既然以芦可替尼为代表的创新药物,把MF的临床治疗带进了全新时代,那么无论医生、患者还是普通人,都应该了解这个曾经极为致命的“无形杀手”,让更多的患者及早被确诊并接受规范治疗,奇点糕也相信随着不断的探索,芦可替尼会继续发光发热,通过治疗方案的不断进化,更好地惠及MF患者。
参考文献:
[1]Verstovsek S, Yu J, Scherber R M, et al. Changes in the incidence and overall survival of patients with myeloproliferative neoplasms between 2002 and 2016 in the United States[J]. Leukemia & Lymphoma, 2022, 63(3): 694-702.
[2]Brunner A M, Hobbs G, Jalbut M M, et al. A population-based analysis of second malignancies among patients with myeloproliferative neoplasms in the SEER database[J]. Leukemia & Lymphoma, 2016, 57(5): 1197-1200.
[3]Anderson L A, James G, Duncombe A S, et al. Myeloproliferative neoplasm patient symptom burden and quality of life: evidence of significant impairment compared to controls[J]. American Journal of Hematology, 2015, 90(10): 864-870.
[4]Baxter E J, Scott L M, Campbell P J, et al. Acquired mutation of the tyrosine kinase JAK2 in human myeloproliferative disorders[J]. The Lancet, 2005, 365(9464): 1054-1061.
[5]Schieber M, Crispino J D, Stein B. Myelofibrosis in 2019: moving beyond JAK2 inhibition[J]. Blood cancer journal, 2019, 9: 74.
[6]Ostojic A, Vrhovac R, Verstovsek S. Ruxolitinib: a new JAK1/2 inhibitor that offers promising options for treatment of myelofibrosis[J]. Future Oncology, 2011, 7(9): 1035-1043.
[7]Kleppe M, Kwak M, Koppikar P, et al. JAK–STAT Pathway Activation in Malignant and Nonmalignant Cells Contributes to MPN Pathogenesis and Therapeutic ResponseJAK–STAT Pathway Activation in Malignant and Nonmalignant Cells in MPN[J]. Cancer Discovery, 2015, 5(3): 316-331.
[8]Kvasnicka H M, Thiele J, Bueso-Ramos C E, et al. Long-term effects of ruxolitinib versus best available therapy on bone marrow fibrosis in patients with myelofibrosis[J]. Journal of Hematology & Oncology, 2018, 11: 42.
[9]Mascarenhas J, Hoffman R. Ruxolitinib: The First FDA Approved Therapy for the Treatment of MyelofibrosisRuxolitinib in Myelofibrosis[J]. Clinical Cancer Research, 2012, 18(11): 3008-3014.
[10]Verstovsek S, Gotlib J, Mesa R A, et al. Long-term survival in patients treated with ruxolitinib for myelofibrosis: COMFORT-I and-II pooled analyses[J]. Journal of Hematology & Oncology, 2017, 10: 156.
[11]Guglielmelli P, Ghirardi A, Carobbio A, et al. Impact of ruxolitinib on survival of patients with myelofibrosis in the real world: update of the ERNEST Study[J]. Blood Advances, 2022, 6(2): 373-375.
[12]Harrison C N, Vannucchi A M, Kiladjian J J, et al. Long-term findings from COMFORT-II, a phase 3 study of ruxolitinib vs best available therapy for myelofibrosis[J]. Leukemia, 2016, 30(8): 1701-1707.
[13]Harrison C, Kiladjian J J, Al-Ali H K, et al. JAK inhibition with ruxolitinib versus best available therapy for myelofibrosis[J]. New England Journal of Medicine, 2012, 366(9): 787-798.
[14]Harrison C N, Mesa R A, Kiladjian J J, et al. Health‐related quality of life and symptoms in patients with myelofibrosis treated with ruxolitinib versus best available therapy[J]. British Journal of Haematology, 2013, 162(2): 229-239.
[15]中华医学会血液学分会白血病淋巴瘤学组. 原发性骨髓纤维化诊断与治疗中国指南(2019年版)[J]. 中华血液学杂志, 2019, 40(1): 1-7.
[16]Mead A J, Butt N M, Nagi W, et al. A retrospective real-world study of the current treatment pathways for myelofibrosis in the United Kingdom: the REALISM UK study[J]. Therapeutic advances in hematology, 2022, 13: 20406207221084487.
[17]Verstovsek S, Kiladjian J J, Vannucchi A M, et al. Early intervention in myelofibrosis and impact on outcomes: A pooled analysis of the COMFORT‐I and COMFORT‐II studies[J]. Cancer, 2023.
[18]Gupta V, Griesshammer M, Martino B, et al. Analysis of predictors of response to ruxolitinib in patients with myelofibrosis in the phase 3b expanded-access JUMP study[J]. Leukemia & Lymphoma, 2021, 62(4): 918-926.
文章来源:奇点网