胰腺癌之所以被称为“癌王”,是因为它的杀伤力超强。
从国际癌症研究机构(IARC)发布的2020年全球癌症数据来看[1],胰腺癌发病人数排名第14,但是死亡人数却冲到了第7名。美国癌症协会去年发布的研究数据显示,胰腺癌患者的5年生存率为11%,如果发生转移的话,5年生存率只有3%[2]。
致命性如此之强,在很大程度上是由于大部分患者发现即晚期,以及只有不到一半的患者对常用治疗手段有反应[3]。更遗憾的是,在分子生物学技术如此发达的今天,科学家却发现,不能从遗传学的角度解释患者为什么会对治疗有不同的反应[4]。
我们都知道,癌症是基因和环境共同作用的结果,既然基因不能解释,那就从环境入手。2019年,德州大学MD安德森癌症中心的研究人员迈出了关键的一步,他们发现早期胰腺癌患者生存时间的长短与微生物密切相关[5]。随之而来的问题是,微生物或者患者的饮食习惯,是否会影响晚期胰腺癌患者的治疗效果呢?
今天,由德国汉堡大学艾本多夫医学中心Nicola Gagliani和Samuel Huber领衔的研究团队,在著名期刊《自然》发表了一项重要研究成果[6],给癌症的饮食干预指出了一个可行的方案。
他们发现,肠道微生物代谢色氨酸产生的3-吲哚乙酸(3-IAA)竟然是化疗的“放大器”。它会增加肿瘤中的活性氧水平,导致癌细胞自噬作用被削弱,进而促进化疗对癌细胞杀伤作用。如果阻断3-IAA相关的通路,化疗方案也就不起作用了。
更重要的是,通过饮食短期摄入色氨酸或者直接口服3-IAA,都可以增加胰腺癌人源化小鼠模型的化疗效果;而且3-IAA联合不同的化疗方案,或者治疗不同的癌症都有类似的效果。这意味着,这个新发现有广泛的适用性。
论文首页截图
正如文章开头所言,Gagliani团队的目标很明确,就是寻找影响胰腺癌患者对化疗反应的外在因素。肠道微生物理所当然地成了最大的嫌疑对象。
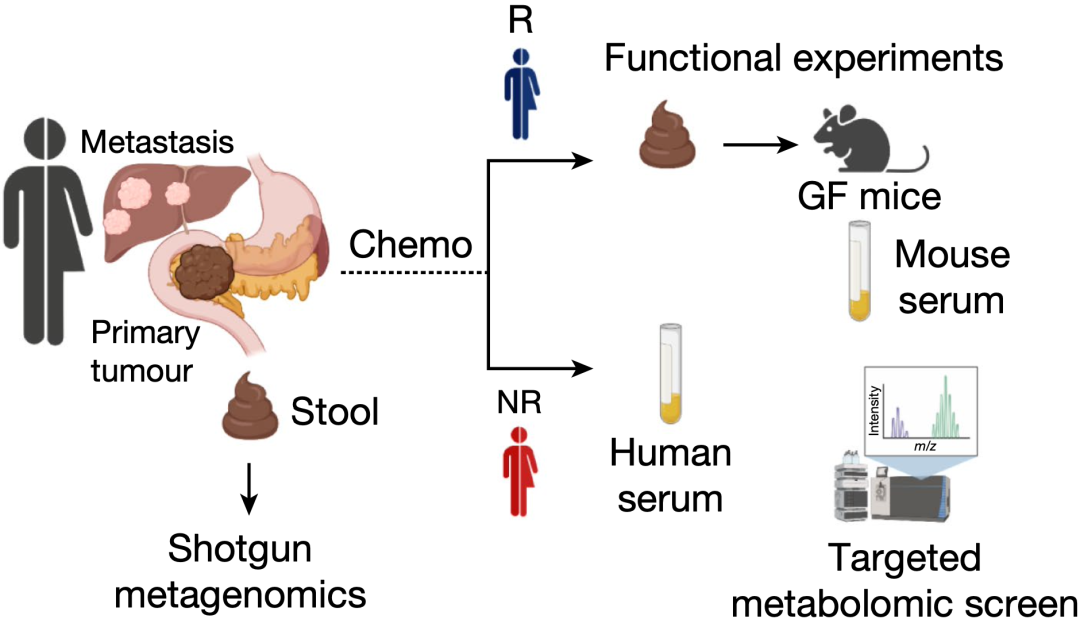
他们招募了23名晚期胰腺癌患者,其中11名响应化疗的治疗(R组),12名对化疗没有反应(NR)。毫无疑问,两组患者的预后差异很大;同样的,两组患者的肠道微生物也存在很大的差异。
为了明确肠道微生物之间的差异与化疗响应性之间的关系,他们又将响应化疗和不响应化疗患者的粪菌移植给了无菌小鼠,随后给小鼠注射胰腺癌细胞。待成瘤之后,用5-FU、伊立替康和奥沙利铂(FIRINOX)这一方案治疗,治疗一段时间之后,发现移植了响应化疗患者粪菌的小鼠肿瘤负担更小。
这说明,肠菌确实影响这化疗效果。不过,让Gagliani团队意外的是,他们在绝大部分肿瘤中没有发现细菌,所以他们将目光转移到了肠道微生物的代谢产物上。
分析完胰腺癌患者和匹配模式小鼠的血液成分之后,色氨酸代谢物3-IAA浮出水面,与不响应化疗的患者相比,响应的患者血液3-IAA水平更高。此外,他们还确定了是Bacteroides fragilis和Bacteroides thetaiotaomicron这两个微生物在发挥作用。
研究流程图
实验做到这里,意味着那个关键的变量已经找到了——就是3-IAA。
要验证3-IAA对化疗的增强作用也很简单,有两种方法可选:一是直接给小鼠上富含色氨酸的食物,二是直接补充3-IAA。两种方案Gagliani团队都尝试了。
色氨酸饮食方案实施起来虽然容易,但是有个问题,已经有研究发现色氨酸会损害抗肿瘤免疫反应,从而促进肿瘤的生长[7]。
为了拿捏好色氨酸饮食的合适干预长度,他们做了好几组实验,最终发现14天的色氨酸饮食确实会促进肿瘤的生长,而4-5天的色氨酸饮食则不会。好消息是,4天的色氨酸饮食足以提升移植了响应化疗患者肠菌的小鼠血清3-IAA水平。
他们注意到,当色氨酸饮食干预与FIRINOX相结合时,小鼠肿瘤重量下降,而且血清3-IAA水平与肿瘤重量成反比。在移植了不响应化疗患者肠菌的小鼠身上,没有出现上述现象。如果直接补充3-IAA的话,也观察到增强化疗效果的现象,而色氨酸的其他代谢产物则不具有类似的效果。
直接补充3-IAA的效果
在研究的最后,Gagliani团队检测了3-IAA的抗癌潜力。
他们发现3-IAA和FIRINOX单独使用都不能延长小鼠的生存时间,但是二者联合可以显著延长小鼠的生存时间。此外,3-IAA联合FIRINOX在结直肠癌(MC38)或肺癌(LLC)模型小鼠,以及3-IAA联合吉西他滨/白蛋白紫杉醇(GnP)治疗胰腺癌模型小鼠,都展现出协同作用。
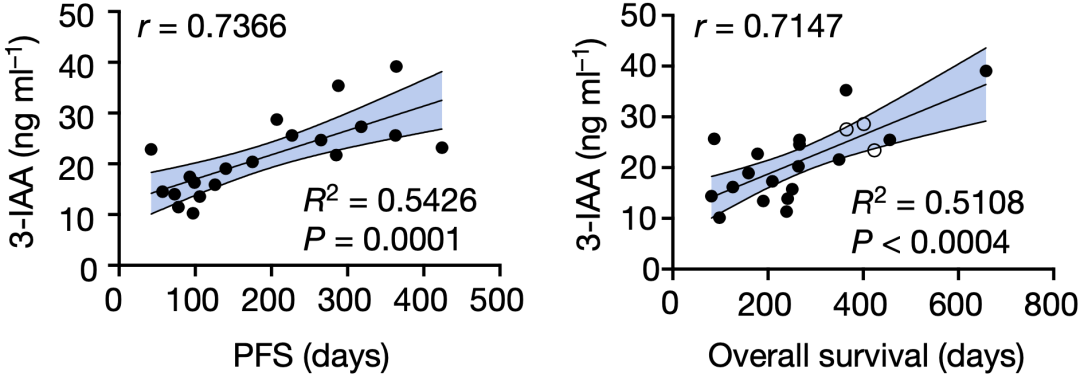
重要的是,他们在两个临床队列中发现:血清3-IAA浓度与无进展生存期或总生存期有明显的相关性。这意味着3-IAA在癌症的临床治疗中可能有广泛的作用。
临床队列中发现血清3-IAA浓度与无进展生存期或总生存期有明显的相关性
至于3-IAA引爆化疗反应的机制,Gagliani团队也做了深入的探索。
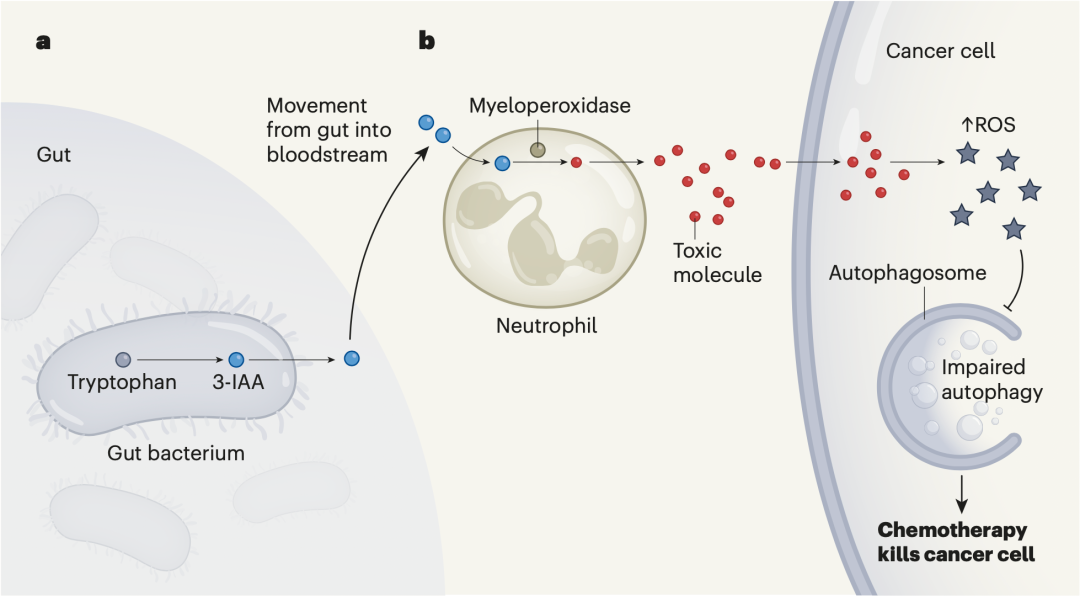
他们发现这是一个不依赖于CD8阳性T细胞,而依赖于中性粒细胞的过程。简单来说,肠道中的Bacteroides fragilis和Bacteroides thetaiotaomicron等微生物,会将人体摄入的色氨酸代谢成3-IAA;随后3-IAA从肠道进入血液,被中性粒细胞所吸收,在骨髓过氧化物酶的作用下,3-IAA转化成一种毒性分子,这个毒性分子进入癌细胞导致癌细胞内活性氧水平上升,抑制癌细胞的自噬作用,也就是在这个档口,化疗药物乘机杀死了癌细胞。
3-IAA引爆化疗反应的机制
Gagliani团队认为,他们发现的3-IAA是化疗反应的一个关键放大器,为饮食联合化疗治疗难治癌症的临床研究奠定了基础。他们认为,在化疗期间提高血清3-IAA的浓度,或许能提高对化疗不响应患者的生存率。
虽然通过饮食增加补充3-IAA的底物色氨酸很容易,但是色氨酸对免疫的抑制作用不可忽视,在临床研究中,色氨酸的摄入量和干预时间需把控好,否则可能会出现相反的作用。此外,补充色氨酸还收到肠菌的影响,如果患者体内缺少必要的肠菌,也起不到治疗的效果。
在Gagliani和他的同事们看来,如果能大规模生产出临床使用级别的3-IAA是最理想的,不仅可以排除色氨酸对免疫的抑制作用,还不用考虑肠菌的影响。
德州大学MD安德森癌症中心的Florencia McAllister等,在同期《自然》上发表的评论性文章表示[8],这一发现为通过营养干预改善化疗效果指明了方向。
参考文献:
[1].Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-249. doi:10.3322/caac.21660
[2].Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022. CA Cancer J Clin. 2022;72(1):7-33. doi:10.3322/caac.21708
[3].Von Hoff DD, Ervin T, Arena FP, et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med. 2013;369(18):1691-1703. doi:10.1056/NEJMoa1304369
[4].Raghavan S, Winter PS, Navia AW, et al. Microenvironment drives cell state, plasticity, and drug response in pancreatic cancer. Cell. 2021;184(25):6119-6137.e26. doi:10.1016/j.cell.2021.11.017
[5].Riquelme E, Zhang Y, Zhang L, et al. Tumor Microbiome Diversity and Composition Influence Pancreatic Cancer Outcomes. Cell. 2019;178(4):795-806.e12. doi:10.1016/j.cell.2019.07.008
[6].Tintelnot, J., Xu, Y., Lesker, T.R. et al. Microbiota-derived 3-IAA influences chemotherapy efficacy in pancreatic cancer. Nature (2023). https://doi.org/10.1038/s41586-023-05728-y
[7].Hezaveh K, Shinde RS, Klötgen A, et al. Tryptophan-derived microbial metabolites activate the aryl hydrocarbon receptor in tumor-associated macrophages to suppress anti-tumor immunity. Immunity. 2022;55(2):324-340.e8. doi:10.1016/j.immuni.2022.01.006
[8].https://www.nature.com/articles/d41586-023-00476-5
文章来源:奇点网