惊悚或科幻类型的影视剧作品中,有个经典故事背景设定:因地球板块变动、全球变暖、人为开采或探险等变化因素,深埋冰层之中或隐匿于地底之下的超强生物体(病毒、细菌、真菌、虫虫、外星人、小怪物之类的)从休眠状态中苏醒,并开始袭击人类。
可你知道吗,随着细胞衰老、表观遗传学的改变,埋藏在我们基因组中的“远古病毒”也会被唤醒。
来自中国科学院的刘光慧研究组、曲静研究组、张维绮课题组联手合作,借助各种灵长类动物和啮齿动物的衰老模型,揭秘人体内的“远古病毒”在人体衰老过程中的重要作用。文章于近日发表在顶刊《细胞》上[1]。
研究结果显示,随着年龄增长,细胞内发生的表观遗传修饰会导致人类基因组中的人内源性逆转录病毒(HERV)转录激活。HERV的反转录产物可通过激活细胞的先天免疫反应来诱导细胞衰老,并以旁分泌的形式在细胞间传递衰老信息,触发其它年轻细胞的衰老程序。通过阻断HERV的转录或细胞间传染,则能够有效改善细胞、组织和个体的衰老现象。
论文首页截图
在几百万年前,外源性逆转录病毒入侵人体并整合至人类基因组 。经过突变、缺失等遗传变异的积累在人体中进入“沉睡”状态,成为人内源性逆转录病毒(HERV),占人类基因组8%[2]。
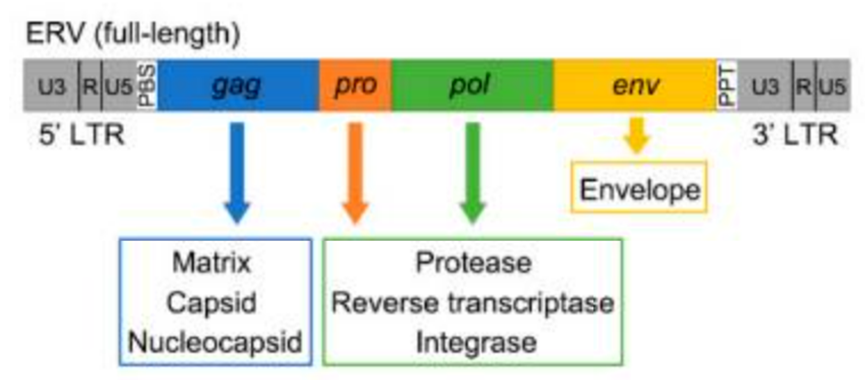
HERV序列由两侧的两个长末端重复序列(LTRs),以及编码基因gag、pro、pol和env组成(分别编码衣壳和基质蛋白、蛋白酶、整合酶、包膜蛋白)[2]。大多数HERV高度失活,不再编码蛋白质,不过也有部分家族成员仍具备编码完整病毒蛋白颗粒所需的开放阅读框,例如整合入人类基因组时间最短的HERV家族成员,即HERV-K(HML-2)亚组[3,4]。
HERV序列结构[2]
在过去很长一段时间里,HERV被视作“垃圾”DNA序列。然而随着研究愈加深入,科学家们意识到,HERV在特定生理和病理条件下,可通过遗传或表观遗传机制对宿主造成有害或有利的影响。比如,某些HERV的表达对于人类胚胎发育至关重要;同时,一些HERV的异常激活却与癌症、自身免疫性疾病等相关[2]。可以说,HERV激活正如同打开“潘多拉魔盒”一般。
刘光慧、曲静、张维绮等研究人员注意到,随着年龄增长细胞会发生一系列表观遗传学变化,进而启动相关衰老程序。那么,本来属于基因组中非编码部分的HERV,是否会在此条件下意外苏醒?
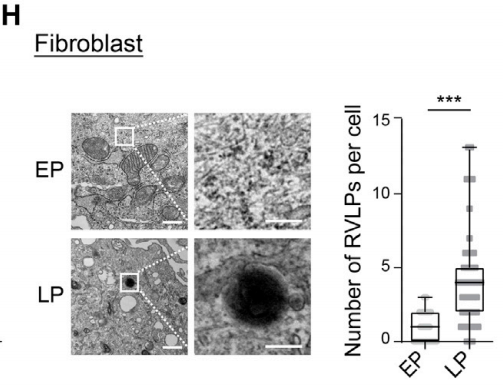
首先,基于体外构建的儿童早衰综合征、成年早衰综合征、复制性衰老、生理性衰老的人间充质干细胞模型和人成纤维细胞衰老模型,以及RNA荧光原位杂交(RNA-FISH)、免疫荧光染色等技术,他们发现,衰老细胞中HERV-K发生表观遗传去抑制修饰,且HERV-K转录被异常激活,细胞内HERV-K的反转录产物(病毒蛋白和病毒样颗粒)积累。
HERV-K的逆转录病毒样颗粒在衰老细胞(LP)中积累;
而在年轻细胞(EP)几乎没有
此外,研究者们还获取了年轻人和老年人的原代间充质干细胞进行对比。结果显示,老年人比年轻人的原代间充质干细胞中HERV-K转录物水平高5倍以上。
果然,在衰老过程中,深埋HERV-K的冻土出现融化。那么,HERV-K激活对细胞衰老和个体衰老有何影响呢?
利用CRISPR-dCas9系统,研究者们靶向操纵HERV-K的转录活性。结果发现,靶向激活HERV-K转录活性,可诱导年轻个体来源的间充质干细胞衰老;反之,在衰老细胞中靶向抑制HERV-K转录活性,则减轻了细胞衰老现象。
另外,使用DNA甲基化抑制剂(5-AZA)来调控年轻细胞的表观遗传修饰后同样可以观察到,HERV-K转录激活,并加速细胞衰老。
也就是说,细胞中发生的表观遗传修饰(例如与衰老相关的DNA去甲基化)“唤醒”了这个古老病毒,而HERV-K的反转录产物水平上调是细胞衰老的驱动因素。
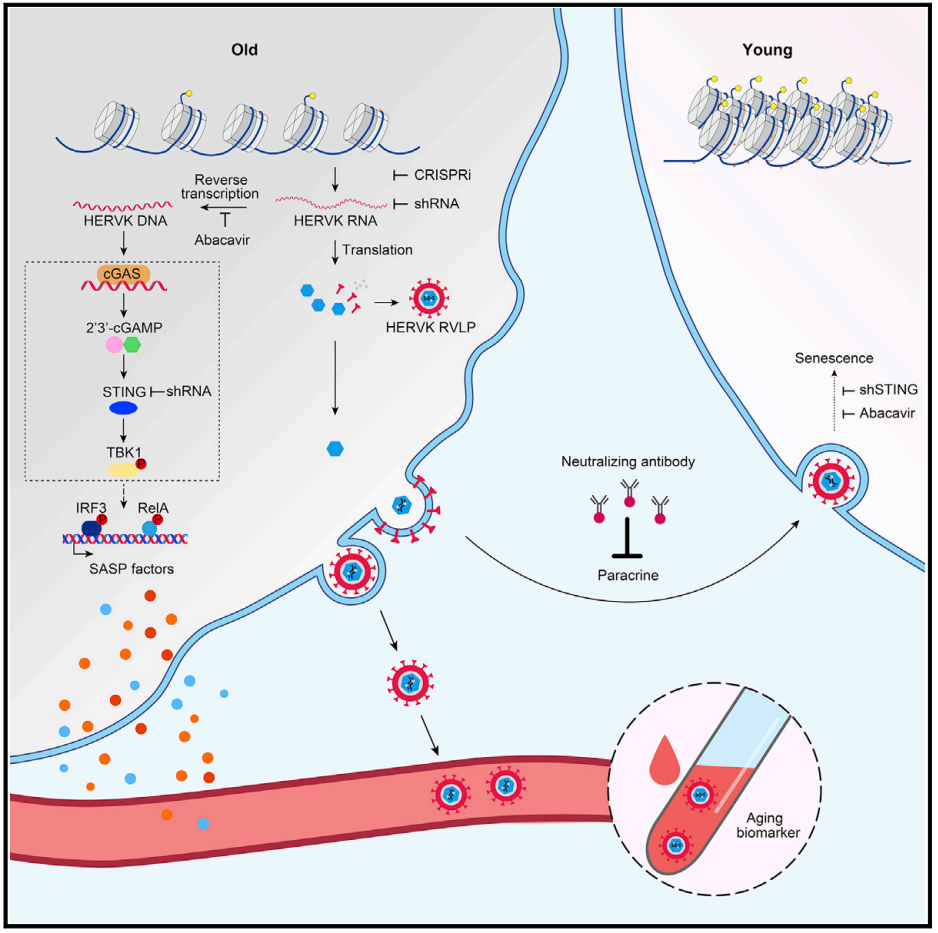
进一步研究表明,正是细胞固有的病毒防御机制,将自己一步步推向衰老。在细胞内,HERV-K的反转录产物会激活cGAS-STING通路介导的先天免疫反应,导致细胞内IL1-β、IL-6等促炎因子水平上调,表现出衰老相关分泌表型(SASP)。
另一方面,衰老细胞还会将衰老“传染”给年轻细胞。HERV-K的逆转录病毒样颗粒被衰老细胞释放出来后,通过旁分泌将衰老信号传递给年轻细胞,并依赖于cGAS-STING通路驱动其衰老。
机制图,配合上面部分内容食用
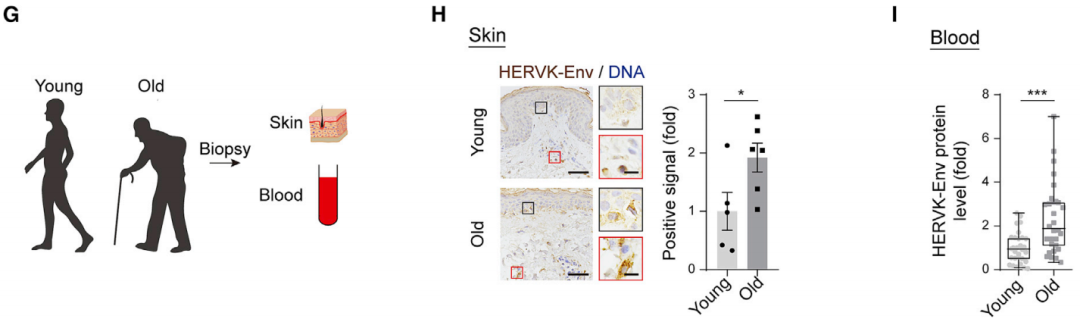
随后,研究者们检测了不同年龄的食蟹猴和人类个体中,ERVW (猴体内的一种内源性逆转录病毒亚科)和HERV-K表达水平。
根据人类捐赠者的皮肤和血清样本检测结果显示,HERV-K反转录产物水平随年龄增长而显著增加。不仅如此,他们还用志愿者的血清在体外培养人间充质干细胞,结果观察到,来自老年人的血清会增加细胞内HERV-K反转录产物水平,引发先天免疫反应,促进细胞衰老。
HERV-K可作为评估人类衰老的潜在生物标志物
最后,研究者们试图寻找应对“远古病毒”的策略。
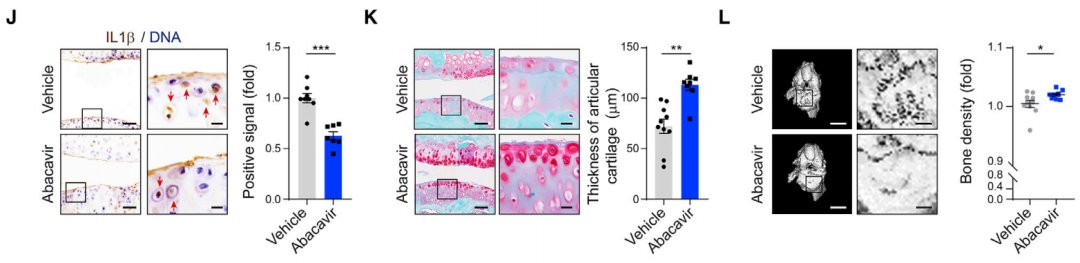
结果显示,利用遗传学手段敲低小鼠内源性逆转录病毒(MMTV)的表达,或者使用逆转录酶抑制药物(阿巴卡韦)治疗小鼠后,老年小鼠的软骨厚度、骨密度增加,握力增强,且整体身体得分提高和短期记忆力提高,衰老以及衰老相关炎症减轻。在体外实验中,靶向病毒包膜蛋白(env编码蛋白)的中和抗体则可以保护年轻细胞免受“感染”,阻断HERV-K逆转录病毒样颗粒在细胞间的传递。
给22个月大的小鼠关节腔每周注射阿巴卡韦,小鼠的炎症反应减轻、骨骼退化得到缓解
总体来说,刘光慧、曲静、张维绮等研究人员基于多种衰老模型发现,随着年龄增长,内源性逆转录病毒被异常激活,其反转录产物不仅会促进细胞衰老,还可以“感染”其它年轻细胞、通过旁分泌在组织内扩大衰老信号。
这项研究结果表明,人内源性逆转录病毒HERV-K可作为评估人类衰老的潜在生物标志物,以及减轻组织和细胞衰老的潜在治疗靶点。同时,研究者们在此也提出有效的应对策略,成功缓解小鼠的个体衰老现象,并表示,需要进一步研究来摸清衰老过程中HERV-K的整个生命周期,以及从衰老细胞到年轻细胞的传递过程。
参考文献:
[1]https://www.cell.com/cell/fulltext/S0092-8674(22)01530-6
[2]Zhang Q, Pan J, Cong Y, Mao J. Transcriptional Regulation of Endogenous Retroviruses and Their Misregulation in Human Diseases. Int J Mol Sci. 2022 Sep 4;23(17):10112. doi: 10.3390/ijms231710112.
[3]Subramanian, R.P., Wildschutte, J.H., Russo, C., and Coffin, J.M. (2011).
Identification, characterization, and comparative genomic distribution of
the HERV-K (HML-2) group of human endogenous retroviruses. Retrovir[1]ology 8, 90.
[4]Vargiu, L., Rodriguez-Tome´ , P., Sperber, G.O., Cadeddu, M., Grandi, N.,
Blikstad, V., Tramontano, E., and Blomberg, J. (2016). Classification and
characterization of human endogenous retroviruses; mosaic forms are
common. Retrovirology 13, 7.