ELISA是将抗原、抗体的免疫反应和酶的高效催化反应有机结合而发展起来的一种综合性技术。检测时,样品中的受检物质(抗原或抗体)与固相载体表面的抗体或抗原结合,经过洗板洗去非结合物,再加入酶标记的抗原或抗体,通过反应结合在固相载体上形成酶标复合物,此时,能固定下来的酶量与样品中被检物质的量相关。再通过加入与酶发生显色反应的底物后,根据反应颜色的深浅可以判断样品中物质的含量,进行定性或定量分析。
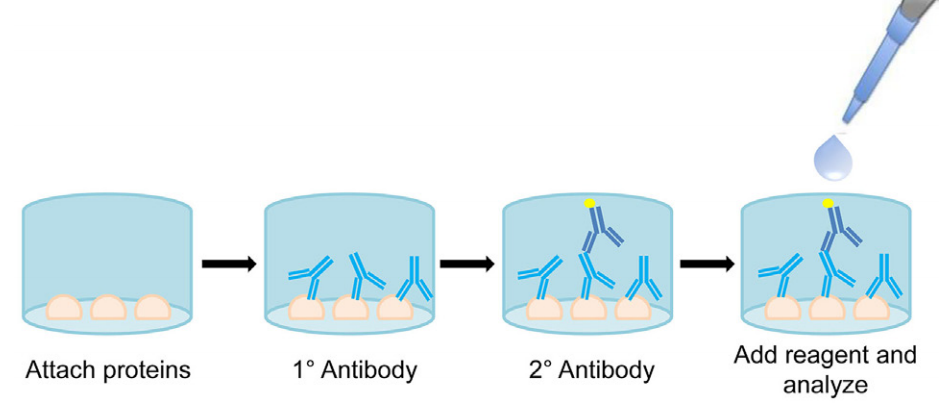
样本收集—标准品制备—样品稀释—样品捕获抗体,孵育—生物素标记的抗体孵育—洗板—亲和素过氧化物酶孵育—洗板—底物显色孵育—终止液终止反应—酶标仪读数—根据OD值计算样本浓度
图1 ELISA实验步骤示意图(Gates et al., 2017)
ELISA检测方法具有特异性强、灵敏度高、成本低、检测速度快、选择性强等优点,但由于目前被检测的物质分为很多类,且每次的结构与特征都不相同,为了进一步提高检测的特异性和灵敏性,根据ELISA实验原理及操作的不同,将ELISA大致分为四种:直接法、间接法、竞争法和夹心法。其中直接法和竞争法应用较少,间接法操作相对简便,结果清晰,在抗体的检测中最为常用,应用最多的是双抗夹心法,其在敏感性及特异性上有明显的优势。
1、直接法(Direct ELISA)
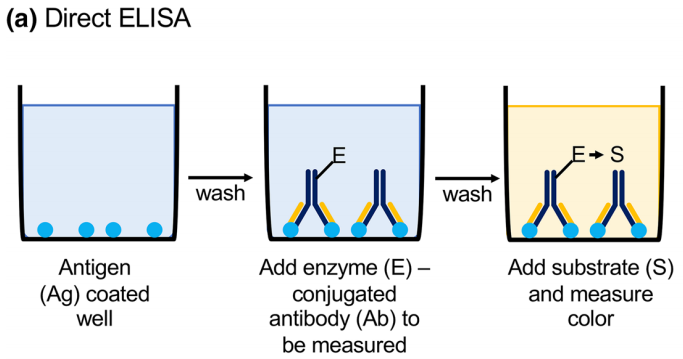
将抗原或抗体以非特异性的方式直接固定在包被板上,加入酶标记的一级抗体或一级抗原,与之特异性结合,洗涤未结合的酶标抗体,再加入底物显色,根据产生的颜色变化进行测量和量化。直接法主要用于测定抗原。
图2 直接法ELISA示意图(Boguszewska et al., 2019)
2、间接法(Indirect ELISA)

3、夹心法(Sandwich ELISA)
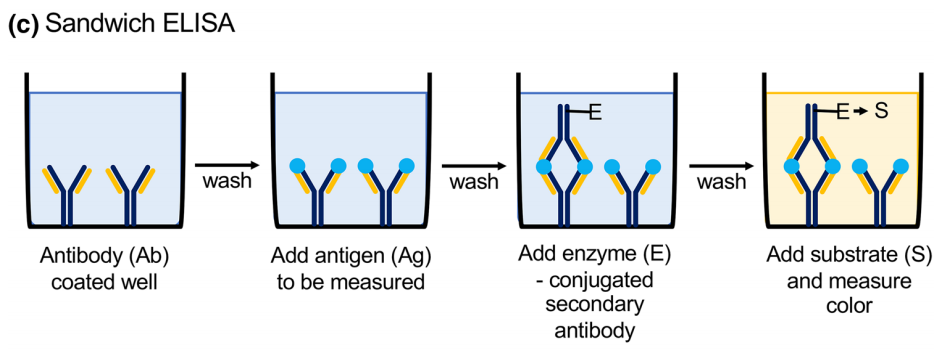
夹心法分为双抗体夹心法和双抗原夹心法,适用于检测具有多个识别位点的大分子蛋白等。所谓双抗体夹心法即是被检测的抗原包被在两个抗体之间,形成“sandwich”的结构,其中第一个抗体固定在固相载体上,通过特异性结合捕获抗原,即捕捉抗体;另一个是检测抗体,此抗体可用酶标记后直接测定抗原的量,或不标记,再通过酶标记的二级抗体来测定抗原的量,结果由加底物后的显色反应呈现。双抗原夹心法测抗体的反应模式与测抗原相似,用特异性抗原进行包被和检测抗原与之结合,加酶催化底物显色,以检测相应抗体。
图4 夹心法ELISA示意图(Boguszewska et al., 2019)
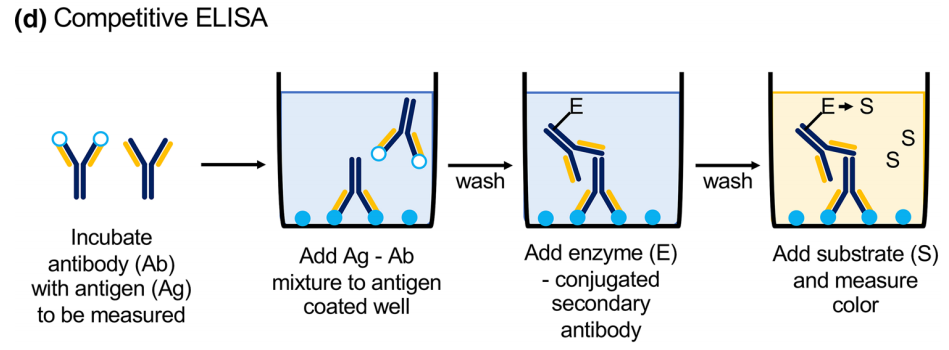
4、竞争法(Competitive ELISA)
ELISA竞争法,也被称为ELISA抑制法或ELISA阻断法,是ELISA里最复杂的一种,通常用于检测小分子如半抗原、激素、药物等。竞争法既可用于检测抗体,也可用于检测抗原,如果待检测物是抗体,则待检抗体就与加入的酶标抗体竞争结合包被在固相载体上的抗原,如果待检测物是抗原,则待检抗原就与加入的酶标抗原竞争结合包被在固相载体上的抗体,经洗涤除去系统中未与固相抗原/抗体竞争结合上的酶标抗体/抗原,只留下待检抗体/抗原与固相抗原/抗体的结合物,最后加底物显色,显色结果与待检抗体或抗原的量成反比。
图5 竞争法ELISA示意图(Boguszewska et al., 2019)
表1 四种ELISA方法优缺点比较
EMSA技术操作简单、快捷,可在一天内完成实验,EMSA可以较为真实的模拟体内的检测环境,重复性高,是验证分离纯化的特定蛋白质与DNA结合的经典实验方法。但该方法检测通量低,一次检测只能获取少数核酸信息,无法确定蛋白与哪个核酸位点发生互作。
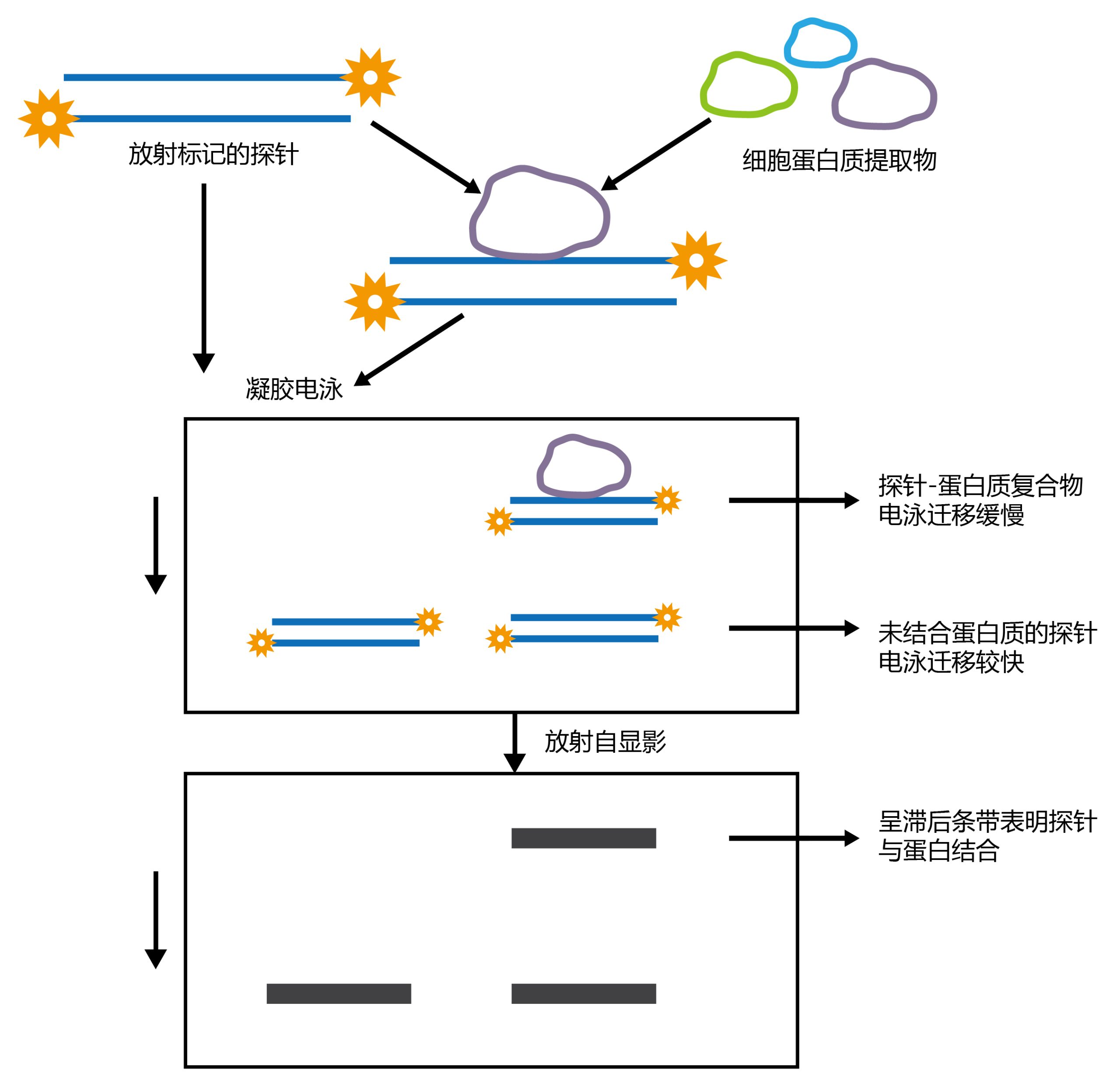
EMSA是基于蛋白-DNA复合物或蛋白-RNA复合物在聚丙烯酰胺凝胶电泳(PAGE)中具有不同的迁移率,将纯化的蛋白或蛋白提取液与末端标记的核酸探针混合孵育,然后跑PAGE胶,DNA在凝胶电泳中朝正极迁移的速率与自身相对分子质量成正比,分子量越小,迁移速率越快,反之则迁移速度越慢。如果蛋白和探针结合,会形成蛋白-探针复合物,迁移速率慢(凝胶延滞),滞留在泳道上方;而未结合蛋白质的探针迁移速率大,堆积在泳道下方。再将凝胶转移到尼龙膜上,使用链霉亲和素-HRP共轭物和化学发光底物进行检测。这样,就可以根据转膜后条带的位置判断该蛋白是否和特定序列结合或者该序列是否和蛋白结合。
蛋白纯化—探针制备—样品制备—配制PAGE胶—预电泳—电泳—转膜—紫外交联—封闭—抗体孵育—洗涤—显影—信号检测
EMSA根据实验方案设计的不同,分为验证型EMSA、竞争型EMSA和超迁移EMSA,现在大部分的EMSA实验都是竞争型EMSA。
1、验证型EMSA
用于验证探针是否含有可以与蛋白质结合的位点。蛋白提取液中蛋白质混杂,种类不单一,探针可能与多种蛋白结合。将探针与蛋白提取液混合孵育,可以验证探针上是否含有蛋白结合位点,但是无法得知是何种蛋白与探针结合。或可设计两组实验:阴性对照组和实验组,实验组添加蛋白提取液和标记探针,可设不同的浓度梯度,阴性组只添加标记探针,两组结果的对比,可以表明探针和蛋白的互作关系。
2、竞争型EMSA
在验证型EMSA的基础上,增加一组冷竞争,即冷探针——与探针序列相同但不含修饰基团的DNA片段,目的是为了排除蛋白和探针因非特异结合造成的假阳性结果,增加实验结果的准确性。
在探针与蛋白提取液孵育前或孵育时加入非标记冷探针,因为冷探针含有和探针相同的DNA序列,会竞争结合蛋白,干扰探针与蛋白的结合,导致电泳带信号变弱或消失,竞争越强则信号越弱。此外,冷探针也可以设置浓度梯度。
为了验证蛋白与DNA探针的结合是依赖于DNA序列里某一段特定序列,还可以在冷竞争的基础上衍生出突变冷竞争。将标记探针和非标记的突变探针与蛋白提取液一同孵育,若突变有效,蛋白与标记探针结合,电泳胶上出现结合带;若突变无效,蛋白与非标记突变探针结合,电泳胶上无结合带出现。
突变探针还有一种使用方式,那就是对其标记,将标记后的突变探针和蛋白提取液一起孵育。此时,若突变有效,蛋白不与标记突变探针结合,不出现结合带;若突变无效,则出现结合带。结果与突变冷竞争刚好相反,但这本质上属于验证型EMSA。
3、超迁移EMSA
超迁移EMSA是以竞争型EMSA为基础,利用特异性抗体与蛋白质结合产生条带。适用于样品是细胞抽提液或表达蛋白不纯时,因为如果溶液内容不是单一的纯化蛋白,无论使用验证型EMSA还是竞争性EMSA,都无法证明和探针结合的蛋白就是我们所预期的。这时就需要在实验体系中加入特异性抗体,使之与目标蛋白-探针复合物结合,形成三聚复合物,分子量变大,迁移速率变更慢,则在蛋白-探针复合物的电泳带上方再出现一条结合带,反之不会出现。这个结果高度依赖于抗体的特异性,可以很好的验证探针是否和蛋白结合,是否是特异性结合,与探针结合的蛋白是否是预期的蛋白。
Gates KV, Pereira NL, Griffiths LG. Cardiac Non-Human Leukocyte Antigen Identification: Techniques and Troubles. Front Immunol. 2017 10:18;8:1332.