在Aducanumab争议不断、Gantenerumab宣告失败的当下,Lecanemab是否能够取得正面的结果,是关注AD新药研发、尤其是Aβ这一争议靶点的学者和大众都颇为在意的问题。
令人高兴的是,Clarity AD试验的结果无疑是充满希望的。Lecanemab治疗18个月,治疗组相对安慰剂组临床痴呆评分总和量表(CDR-SB)评分下降减缓了27%,其他次要终点指标均有改善。论文同步发表在《新英格兰医学杂志》(NEJM)上[1]。
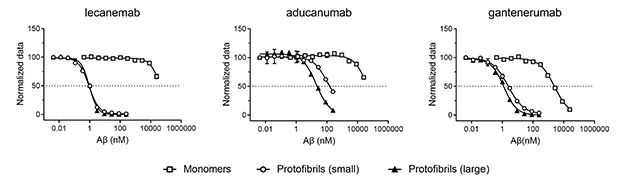
Lecanemab(BAN2401)是人源化IgG1抗体,可选择性与较大的可溶性Aβ原纤维结合。曾有研究者横向对比了Lecanemab、Aducanumab和Gantenerumab对Aβ各种形式聚合物的结合能力,结果显示Lecanemab结合75-300kD较小原纤维的亲和力是Gantenerumab的10倍、Aducanumab的100倍;对于300-500kD的较大的原纤维,Lecanemab亲和力则是Aducanumab的25倍[2]。
此外研究者还指出,Lecanemab与沿血管壁沉积的不可溶纤维亲和力较低,这可能是Lecanemab治疗中淀粉样蛋白相关成像异常(ARIA)发生率较低的原因。
在此前的2b期临床研究中,Lecanemab表现出了一定的治疗潜力,且蛋白斑块的减少与认知测试评分改善存在正相关。由此确定了Clarity AD试验的方案。
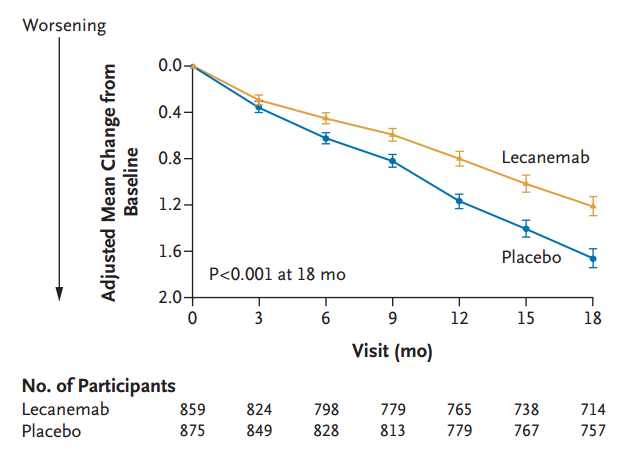
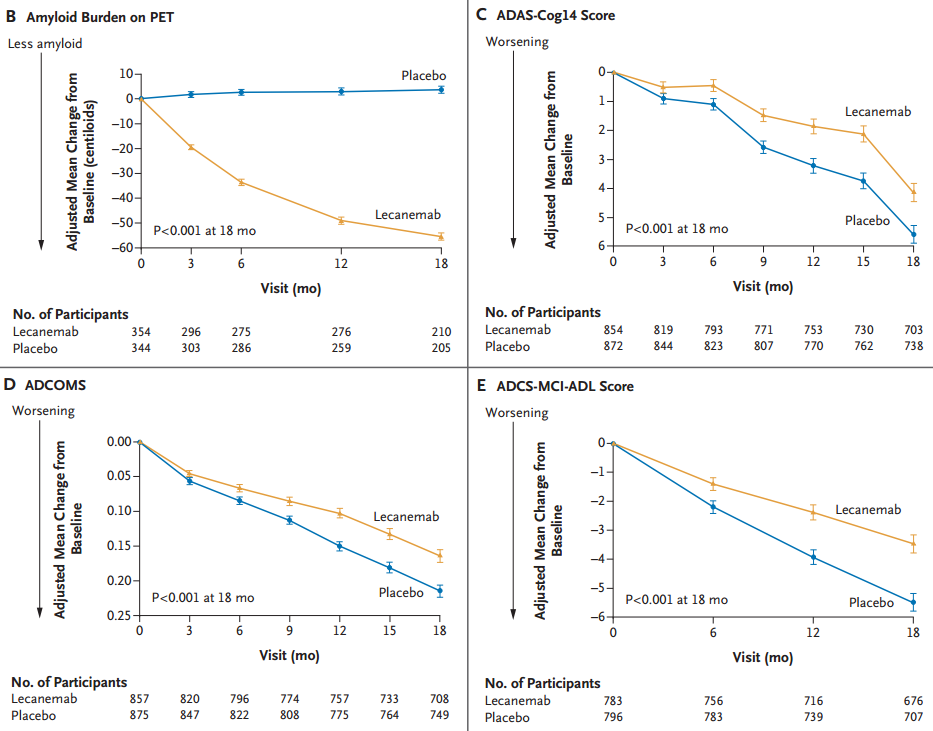
两组患者基线CDR-SB评分均为3.2,符合早期AD标准范围(0.5-6)。18个月时,治疗组CDR-SB评分为1.21,安慰剂组为1.66,绝对差值-0.45,评分下降延缓了27%。其他三项认知/行为评估结果也显示,Lecanemab带来了显著的改善。
Lecanemab的安全性相对较好。治疗组中26.4%的患者出现了输液相关反应,12.6%出现了ARIA-E。ARIA-E中91%为轻度至中度,78%无症状,71%发生在治疗的前三个月,81%在发生4个月内消退。Lecanemab治疗发生ARIA-E的比例仅有此前获批的Aducanumab的三分之一左右,可以说Lecanemab的安全性是值得肯定的。
问题在于,18个月的治疗周期,对于AD来说显然是并不够长的,后续的数据将在Clarity AD的开放标签研究中继续公布。
此外值得关注的是,认知量表数值的变化与临床上有意义的认知改善之间到底是怎样的关系,目前还有争议。此前一项研究系统估算了认知量表分值与临床意义之间的关系,结果显示最小临床意义差异随疾病严重程度增加,对于MCI和轻度AD来说,CDR-SB最小差异为0.98和1.63[3]。
一直以来,AD新药困难重重,尤其是走得最远也跌倒得最多的Aβ类药物,始终未能以有力的姿态改变局面。但时至今日,AD理论已经向多个方向发展,Aβ早已不再是唯一的选择,相信在不远的将来,我们可以揭开AD的神秘面纱,拿到攻克AD的关键武器。
参考资料:
[1]https://www.nejm.org/doi/pdf/10.1056/NEJMoa2212948
[2]https://www.alzforum.org/news/conference-coverage/lecanemab-sweeps-toxic-av-protofibrils-catches-eyes-trialists
[3] Andrews JS, Desai U, Kirson NY, Zichlin ML, Ball DE, Matthews BR. Disease severity and minimal clinically important differences in clinical outcome assessments for Alzheimer’s disease clinical trials. Alzheimers Dement 2019; 5: 354–63.
文章来源:奇点网