蛋白质-蛋白质相互作用(PPI)网络广泛存在于细胞代谢、信号转导等各种生命过程中,对维持机体正常发育、行驶正常生理功能等十分关键。传统的亲和纯化技术(如:免疫沉淀、Pull-Down等)主要用于检测强相互作用或体外相互作用,无法捕捉到体内的弱或瞬时的PPI,随着邻近标记(Proximity Labeling, PL)技术的兴起,越来越多的研究者选择应用PL进行PPI研究,其详细介绍及发展历程与应用小医在“邻近标记技术:研究蛋白互作的利器(一)”、“邻近标记技术:研究蛋白互作的利器(二)”、“邻近标记技术:研究蛋白互作的利器(三)”、“邻近标记技术:研究蛋白互作的利器(四)”中已进行了相关介绍,感兴趣的同学可自行点击链接,进行阅读。
虽说PL作为新兴PPPI检测技术,受到广大研究者的推崇,但其仍有一些不可避免的弊端,基于HRP发展起来的PL技术仅限于在氧化环境以及细胞外应用;基于APEX发展起来的APEX系列PL技术因其其依赖于具有细胞毒性的H2O2而无法应用于活细胞及活体中;基于BirA发展起来的BioID系列PL技术需标记16-18 h,假阳性或假阴性结果出现概率较高;基于BirA发展起来的TurboID系列PL技术虽将标记时间缩短至1-10 min的分钟级,但其标记效率仍有待提升;使用有机光催化剂的PL方法通常仅限于特定细胞器,未能在各种细胞内环境中广泛应用。因此,在活体及活细胞体系中深入剖析生命进程中瞬息万变的PPI网络,尤其是其在动态环境下的瞬时互作,仍旧是一项极具挑战性的任务。下面,小医就来总结下2024年PL的高分文章及其最新研究进展。
Part.01
案例一
2024年12月10日,中国科学院上海营养与健康研究所潘巍峻团队在Cell Research(IF:28.1)上发表了题为“Photoactivated SOPP3 enables APEX2-mediated proximity labeling with high spatio-temporal resolution in live cells”的研究性论文,报道了一种基于光敏蛋白SOPP3和过氧化物酶APEX2的新型PL技术。光敏蛋白SOPP3在5-10秒蓝光照射下,能够在活细胞中直接触发APEX2活性,首次在活细胞中实现了无需过氧化氢参与、且具备更高时空分辨率的PL技术。SOPP3作为光敏蛋白家族(LOV)的一员,已被证实是一种受遗传基因编码的光敏剂,在蓝光照射下通过超氧化物歧化酶(SOD)刺激直接生成高浓度的H2O2。鉴于SOD在细胞中普遍存在,因此,作者假设在蓝光刺激下SOPP3可能使APEX2将生物素苯酚(BP)氧化成活性苯氧基自由基,从而优先标记活细胞中的近端蛋白质,而无需外源H2O2(图1)。
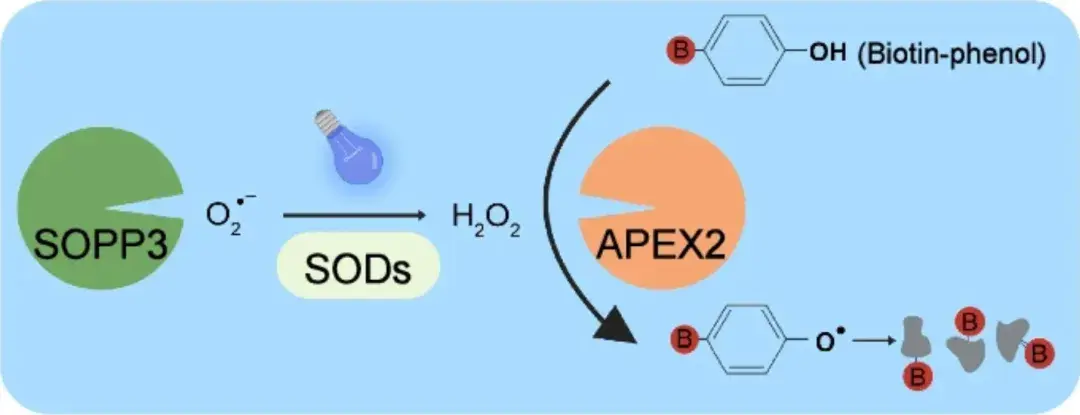
相较于其他标记方法,基于APEX2与SOPP3介导的PL技术展现出了显著的优势。首先,其将标记时间提升到了秒级(5-10 s),为在活细胞中研究高度动态性的蛋白质组提供了有力的技术支持。其次,介于该技术不仅对APEX2、SOPP3的空间距离有着极高的敏感度,且需依赖蓝光刺激,能够精准标记特定区域,并控制标记反应的开始与结束,为实验提供了高度的灵活性和可控性。最后,APEX2-SOPP3标记系统几乎不产生细胞毒性。因此,与其他邻近标记方法相比,该系统是一项新的PL技术,为精准刻画PPI网络的动态变化提供了更高效的工具。
Part.02
案例二
2024年7月19日,加利福尼亚大学旧金山分校的James A. Wells团队在Science(IF:44.7)上发表了题为“Multiscale photocatalytic proximity labeling reveals cell surface neighbors on and between cells”的研究性论文,提出了一种名为MultiMap的多尺度光催化PL平台,在不同距离的邻近蛋白利用同一种催化剂进行标记,从而更加精准地描绘目标蛋白的相互作用蛋白组,即利用可见光照射下光催化剂Eosin Y能够激活不同种类光探针的特性,确定了关键细胞表面受体的大量伴侣蛋白,并在T细胞免疫突触模型中分析了细胞间相互作用,为细胞表面和细胞间PPI分析提供了新的策略(图2)。
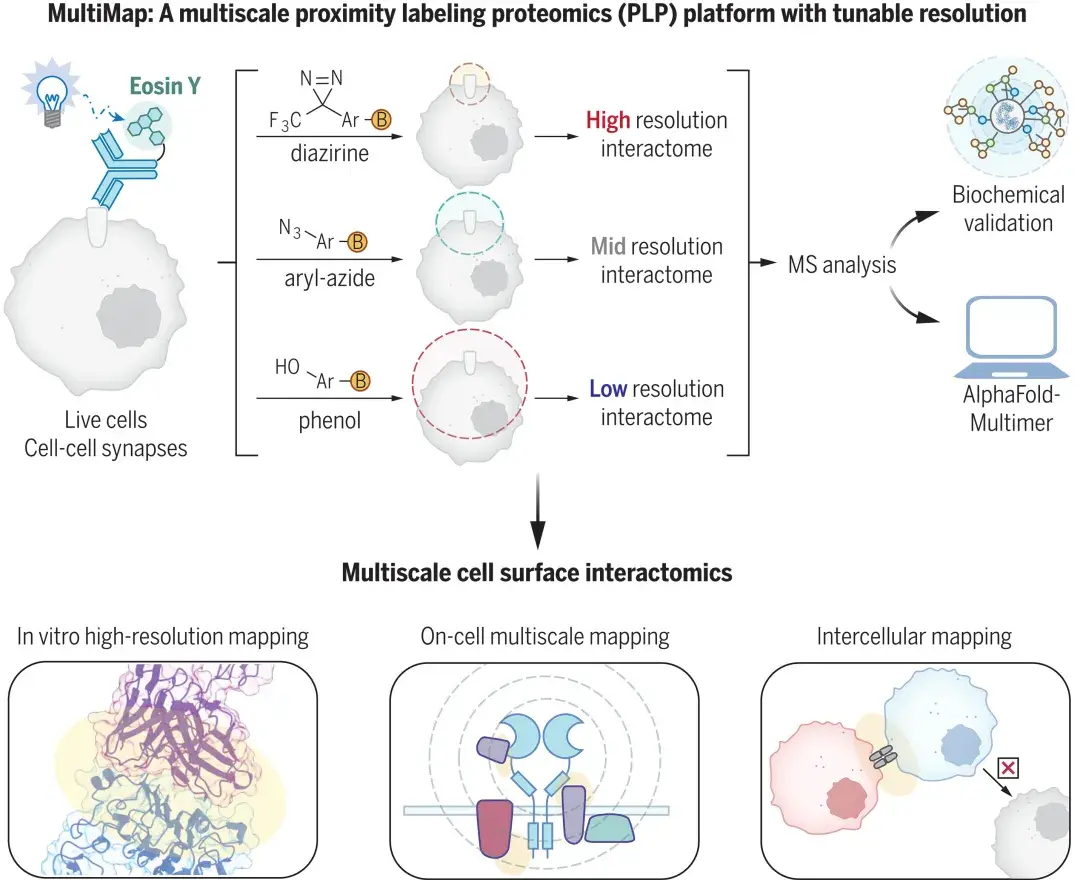
近年来新发展出的μMap技术,其利用金属催化剂产生卡宾集团,能够将标记范围缩小至100~700A,极大地提高了PL的精确度。团队在此基础上,进一步开发的MultiMap技术能够以可调节的分辨率分析细胞表面及细胞间的蛋白质相互作用组,依赖于单一有机光催化剂Eosin Y(可以通过简单的生物偶联与目标抗体偶联)的发现,其能够在可见光照射下激活多种类型的光探针,而每种探针又都具有不同的标记半径与反应半衰期,从而捕获和可视化细胞上和细胞间高、中、低分辨率的蛋白质邻域,揭示细胞表面和细胞间在不同尺度上的蛋白质相互作用网络,无需在细胞上和细胞之间进行广泛的蛋白质工程。每项新技术的开发都会与遇到一些困难与瓶颈,例如,需要确保光探针在生物体内的稳定性和生物相容性,避免非特异性标记;可能引入大量假阳性靶点信息,需要优化数据分析流程;需要找到合适的化学探针以满足不同标记半径的需要等等。
Part.03
案例三
2024年2月1日,北京大学药学院药剂学系何冰教授团队在Nano-Micro Letters(IF:31.6)上发表了题为“Molecular Mechanisms of Intracellular Delivery of Nanoparticles Monitored by an Enzyme-Induced Proximity Labeling”的研究性论文,由于缺乏技术手段来实时检测纳米药物在细胞内递送过程中的相互作用蛋白,研究团队开发了一种酶诱导的邻近标记技术(nano-EPL),用于实时监测与细胞内纳米药物相互作用的蛋白质,揭示纳米药物在细胞内的递送机制(图3)。
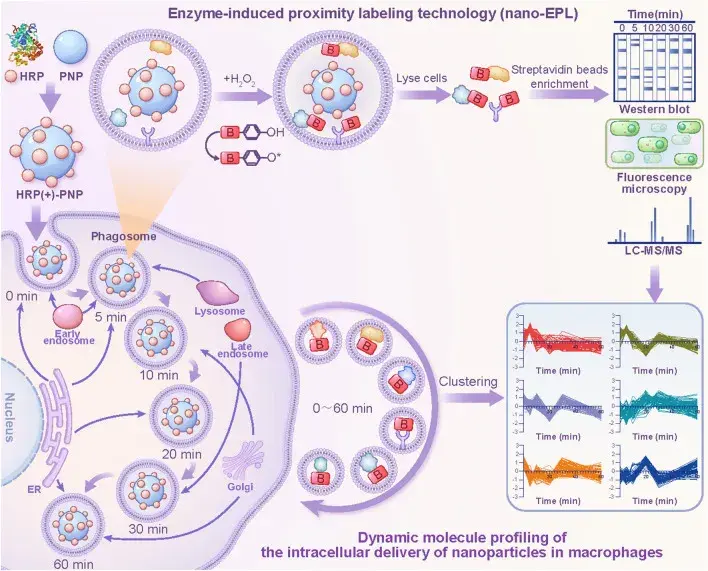
团队通过制备聚乳酸-羟基乙酸共聚物(PLGA)纳米颗粒,与HRP偶联构建具有EPL标记能力的纳米药物模型(HRP(+)-PNPs),选择J774A.1细胞系作为巨噬细胞模型,并与标记探针生物素-苯酚(BP)预孵育,然后将HRP(+)-PNPs添加到培养基中以诱导巨噬细胞吞噬作用。在纳米颗粒的细胞内递送过程中,在不同时间点添加H2O2作为HRP的底物,以快速触发酶催化反应,产生高反应性自由基。这些自由基被迅速转移到细胞中的标记探针BP上,以诱导BP激活。活化的BP分子可以通过偶联酪氨酸、丝氨酸和苏氨酸残基与近端蛋白快速反应,导致BP中的生物素标记这些蛋白质。这种酶催化反应是一个快速高效的过程,整个标记反应在几秒钟内完成。通过亲和素偶联的磁珠进一步分离和纯化生物素化蛋白质,并通过基于质谱的蛋白质组学策略进行鉴定和表征,最后,绘制出巨噬细胞中纳米颗粒细胞内递送过程中的动态蛋白质谱,基于动态图,进一步研究和评估纳米粒子在分子水平上传输的详细时间表。
Part.04
案例四
2024年3月6日,中山大学松阳洲教授团队在Cell Research(IF:28.1)上发表了题为“The rapid proximity labeling system PhastID identifies ATP6AP1 as an unconventional GEF for Rheb”的研究性论文,开发了一种新型的快速邻近标记系统Pyrococcus horikoshii生物素连接酶(PhBPL)辅助生物素鉴定系统——PhastID,该系统可在添加生物素后几分钟内捕获PPI,利用其快速标记动力学,团队详细研究了胰岛素刺激下Rheb的邻近蛋白质网络发生的变化,发现ATP6AP1是Rheb的非经典鸟苷酸交换因子,且其通过末端30个氨基酸(C-tail)发挥调控mTORC1信号通路的活化(图4)。
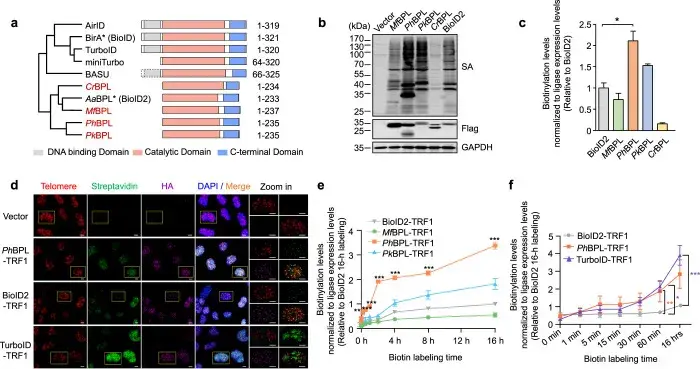
由于快速有效的标记是团队的主要关注点,因此着重比较了添加生物素后不同时间点PhBPLs-TRF1、BioID2-TRF1和TurboID-TRF1融合蛋白的标记动力学,时间跨度为1分钟到16小时,结果显示,PhBPL最早表现出新的BPL候选蛋白中最高的标记效率,并且生物素化信号在1小时后继续上升(尽管速度较慢),表明内源性蛋白质的高效生物素化。团队认为,PhastID作为一种新开发的PL技术,具有标记快速、高效的特点,可用于研究细胞内动态和调控性的蛋白质相互作用。与BioID2相比,PhastID无DNA结合域,可减少非特异性结。且PhBPL来源于高温古菌,具有更高的热稳定性,有利于在极端条件下应用。未来,通过定向进化的方式可优化酶结构、扩展标记能力等方式,PhastID的应用前景还可进一步拓展。
小医叨叨
在过去的十年中,PL领域呈指数级增长,因此影响了生物学的许多领域,随着PL技术和质谱技术的快速发展,阐明新的蛋PPI网络及其动力学使以前难以进行的生物学研究成为可能,鉴于其个体优势,最佳系统选择取决于所涉及的生物学问题。例如,生物素连接酶具有较小的标记半径和较低的催化效率,非常适合在不同年龄、不同遗传背景以及健康状况与疾病中以相对较高的特异性绘制邻域;基于过氧化物酶的标记特别适合研究快速信号转导事件;对于怀疑涉及募集或删除相互作用子的信号转导事件,APEX2标记与TMT多路径检测相结合具有非凡的特异性。近年来,随着生物技术的蓬勃发展,PL技术的创新应用仍是居高不下的热点,越来越多的研究者开发出了新型PL技术,但当前技术仍存在固有的局限性,例如,外源性操纵细胞的PL技术可能会扰乱天然细胞生理学,导致假阳性或假阴性结果的出现,干扰科研的准确性。相信,未来日益复杂的PL技术的不断发展可能会极大地扩展基于PL的发现范围并解决更具挑战性的问题,例如确定分子相互作用的亲和力、化学计量和接触位点。
参考文献
[1]Qu D, Li Y, Liu Q, et al. Photoactivated SOPP3 enables APEX2-mediated proximity labeling with high spatio-temporal resolution in live cells[J]. Cell Research, 2024: 1-4.
[2]Lin Z, Schaefer K, Lui I, et al. Multiscale photocatalytic proximity labeling reveals cell surface neighbors on and between cells[J]. Science, 2024, 385(6706): eadl5763.
[3]Ren J, Zhang Z, Geng S, et al. Molecular Mechanisms of Intracellular Delivery of Nanoparticles Monitored by an Enzyme-Induced Proximity Labeling[J]. Nano-Micro Letters, 2024, 16(1): 103.
[4]Feng R, Liu F, Li R, et al. The rapid proximity labeling system PhastID identifies ATP6AP1 as an unconventional GEF for Rheb[J]. Cell Research, 2024, 34(5): 355-369.

