之前已经通过两期文章 《蛋白互作检测之FRET荧光共振能量转移:分子间距离的微妙舞者》和《蛋白互作检测之FRET荧光共振能量转移:分子间距离的微妙舞者(二)》分别给大家介绍了FRET的技术原理、实验步骤以及应用案例。本期,就由伯小医带大家一起学习FRET技术的常用分析方法。
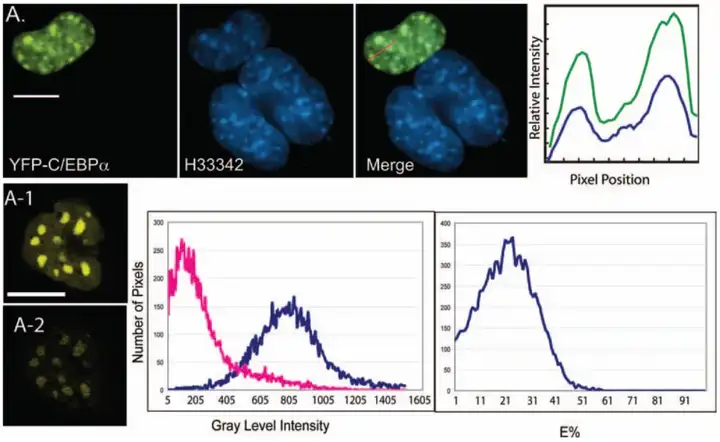
在FRET技术中,对于FRET效率的定量检测的主要影响因素有两个:(1)光谱串扰,包括供体荧光串扰受体通道和激发供体时直接激发受体。在选择FRET实验荧光对时可通过选择两个发射光谱分离较大的供受体荧光对降低光谱串扰。(2)参与FRET作用的供体和受体在整个荧光基团中的比例,由于自由的供体和受体相互作用时,并非所有的分子都参与相互作用,因此各种方法对于FRET效率的计算仅能测量表观FRET效率。目前常用的FRET分析方法主要包括荧光寿命成像、光谱法、受体光漂白法以及敏化发射法,以下给大家逐一介绍这几种常用的分析方法。
荧光寿命成像
荧光寿命成像法(Fluorescence Lifetime Imaging Microscopy, FLIM-FRET)主要通过测量荧光基团从激发态恢复到基态的平均时间即荧光寿命进行成像,从而分析FRET效率的一种方法。由于荧光寿命是荧光基团的固有性质,与样品浓度、样品吸收、光漂白和激发光强度等因素无关,但对荧光基团周围的微环境如细胞温度、pH值分布、离子浓度、分子结合等因素十分敏感,因此能够灵敏的反映激发态分子与周围微环境的相互作用以及能量转移,用于分析供体荧光分子和受体荧光分子之间的FRET效率。
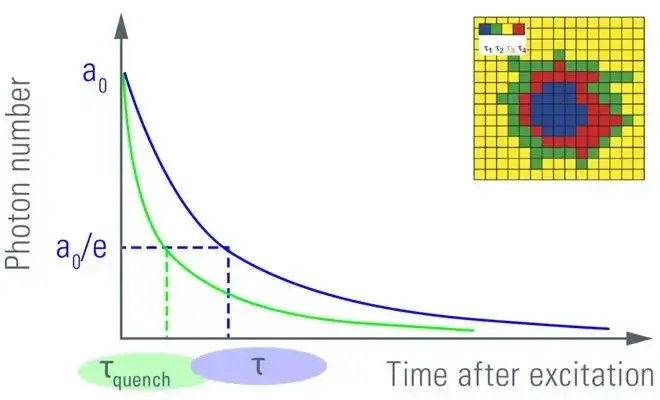
FLIM-FRET方法主要通过测量受体存在和不存在时供体分子的荧光寿命τD和τDA来确定FRET效率E,具体公式为:
在实际操作中,一般通过测量多个分子的荧光强度指数衰减计算供体的荧光寿命,采用供体的平均寿命计算FRET效率。FLIM方法能够作为其他FRET定量检测方法的对照标准,具有高时空分辨率、高检测灵敏度和准确性的优势;但该法需要FLIM系统价格昂贵,并需要专业人员进行操作,极大限制FLIM方法的推广和应用。
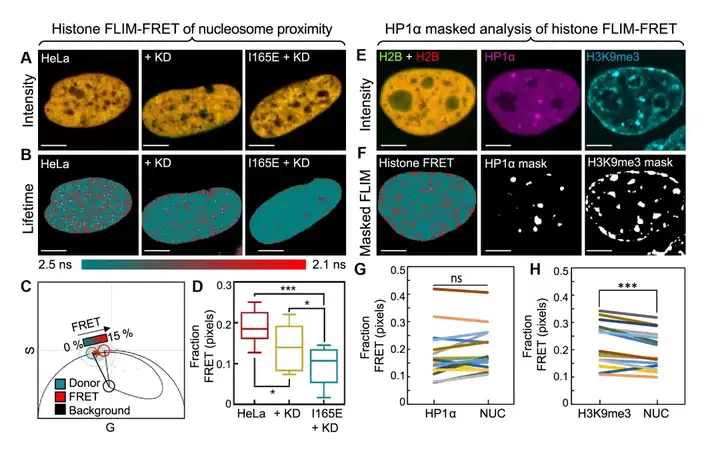
Lou等人利用FLIM-FRET技术揭示了核小体排列受 HP1α 寡聚状态的差异调节,发现 HP1α 单体在整个基因组结构中赋予以前未描述的全局核小体间距,该间距由组蛋白 H3 赖氨酸 9 (H3K9me3) 上的三甲基化介导,并在 HP1α 二聚化时局部减少。表明 HP1α 对染色质具有双重作用,从而增加了核小体邻近的动态范围。
光谱法
每个荧光团都有各自的激发和发射光谱,光谱法FRET(spectral FRET, sFRET)首先获得供体样本、受体样本以及供体-受体样本的发射光谱,然后通过供体样本和受体样本的光谱对供体-受体样本的光谱进行拟合分析从而得到FRET效率。
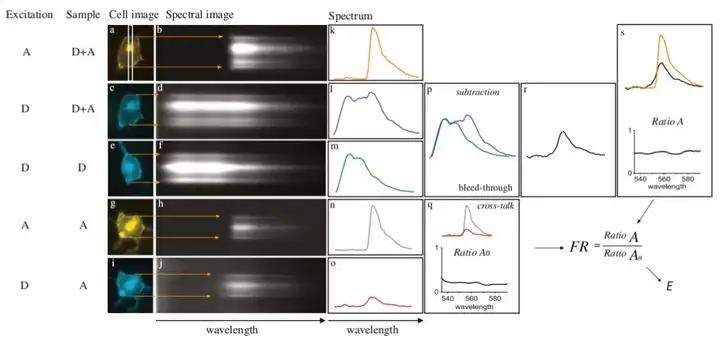
sFRET方法通过测量供体荧光、受体荧光和供体-受体荧光计算FRET效率,具体公式为:
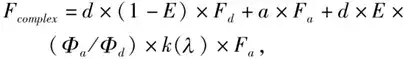
其中Fcomplex代表存在FRET时的混合光谱,E代表FRET效率值,Fa 和Fd 代表单位浓度的供体和受体的发射谱,a和d代表供体和受体的浓度,Φa和Φd代表供体和受体的量子产率,κ(λ)代表波长为λ的激发光分别激发单位浓度的供体和受体所得的荧光强度比值。通过2种不同激发光分别得到的2个不同的混合光谱方程,对方程简化处理及设定关系式获得供体浓度、受体浓度以及FRET效率。光谱法目前是测量FRET效率最为灵敏的方法,最低可检测出小于5%的FRET信号。sFRET能够有效去除背景光和自发荧光的干扰,并消除光谱串扰问题。但sFRET对于数据采集要求高,需要对背景光和自发荧光数据进行严格校正。
受体漂白法
受体漂白法(Acceptor Photobleaching, AP-FRET)主要原理是在FRET存在时,供体由于将能量部分转移至受体,导致荧光强度降低;在对受体进行光漂白后,由于失去FRET效果,供体荧光强度增加。
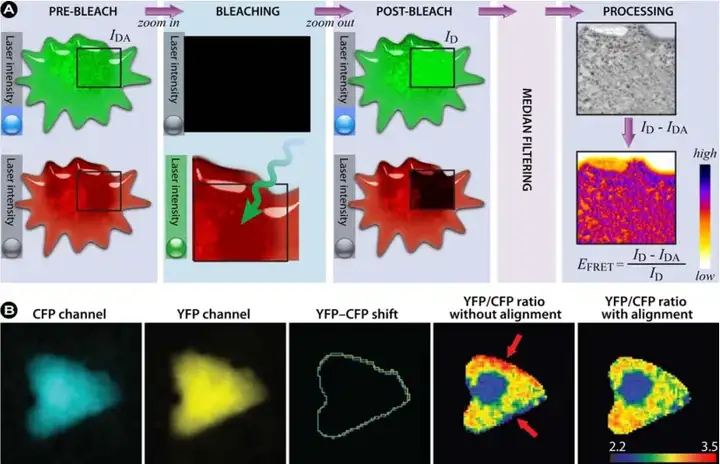
受体光漂白法主要通过检测受体光漂白前后供体的荧光强度计算FRET效率,具体公式为:
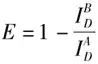

在FRET实验过程中,通常难以实现受体的完全光漂白,因此多数FRET实验通过进行受体部分光漂白进行分析,此时FRET效率计算公式则为:
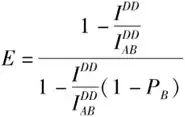

AP-FRET对于FRET效率的检测不依赖系统参数和荧光对的固有物理性质,效率值通过光漂白前后供体的荧光强度便可计算。
AP-FRET由于操作简单,对显微镜要求低,普通共聚焦显微镜便可实现照片采集,因此应用广泛。但由于活细胞存在荧光漂白恢复,并且光漂白对于活细胞具有损伤,因此AP-FRET不利于在单细胞中多次进行测量,并且无法实现细胞内的实时动态监测。
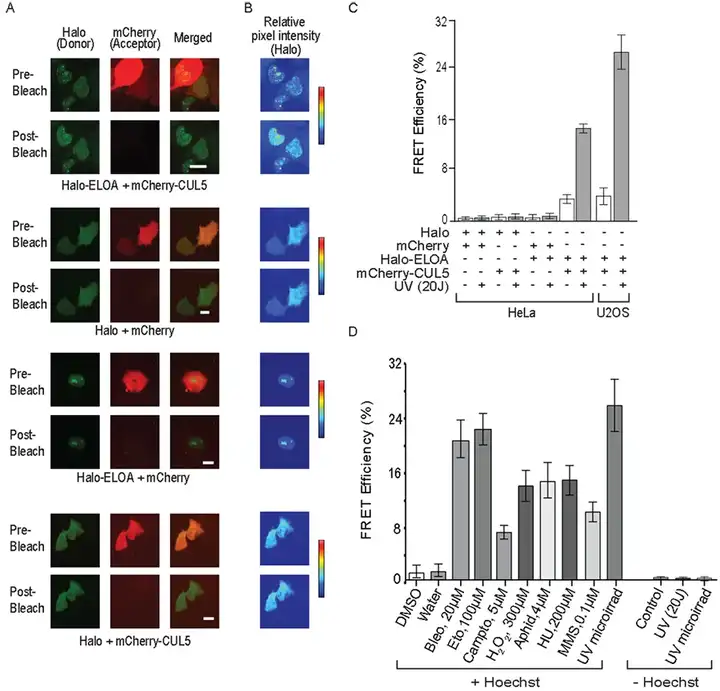
Weems等人利用FRET测量Halo-Elongin A与mCherry-CUL5的相互作用,通过比较受体光漂白前后供体的荧光强度,证实Elongin A泛素连接酶的组装是在Hoechst致敏细胞的紫外照射后诱导。
敏化发射法
敏化发射法(Sensitized Emission, SE-FRET)通过算法校正供体和受体之间的光谱渗透,获取FRET图像并计算FRET效率。使用敏化发射方法测量 FRET 效率需要一个供体-受体校准系统。这些校准因子之一称为G因子,主要取决于与供体和受体测量通道相关的仪器参数以及荧光团量子效率,可以通过几种不同的方式确定。
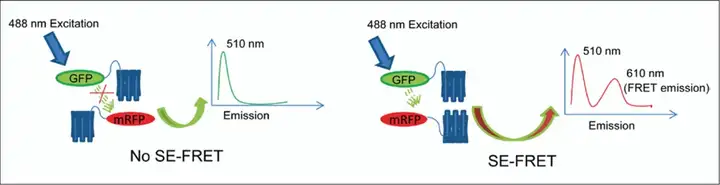
SE-FRET在实验中除待检测的FRET样本外,还需要只有供体荧光样本、只有受体荧光的样本以及已知FRET效率的校正样本,其中已知FRET效率的校正样本用于获得固定成像条件下的校正因子G。首先分析已知FRET效率的校正样本获得校正后FRET信号Fc,具体计算公式为:
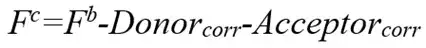
随后,利用校正后FRET信号Fc计算校正因子G用于后续分析,具体计算公式为:
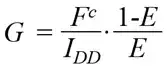
其中,Fc为校正后FRET信号,Fb为测量的FRET信号,Donorcorr为供体贡献,Acceptorcorr为受体贡献,G为校正因子,IDD为供体样本信号。SE-FRET方法由于无需进行荧光漂白,不会对细胞造成损伤,并且能够对光谱串扰和系统参数进行校正,因此成为活细胞中动态监测FRET效率的最适方法。但SE-FRET需要多组样本进行图像采集,在确定校正因子G后不能对系统参数进行任何修改,并且每次实验都需重新进行系统校正,因此极大增加实验工作量,是限制该方法应用的主要因素之一。
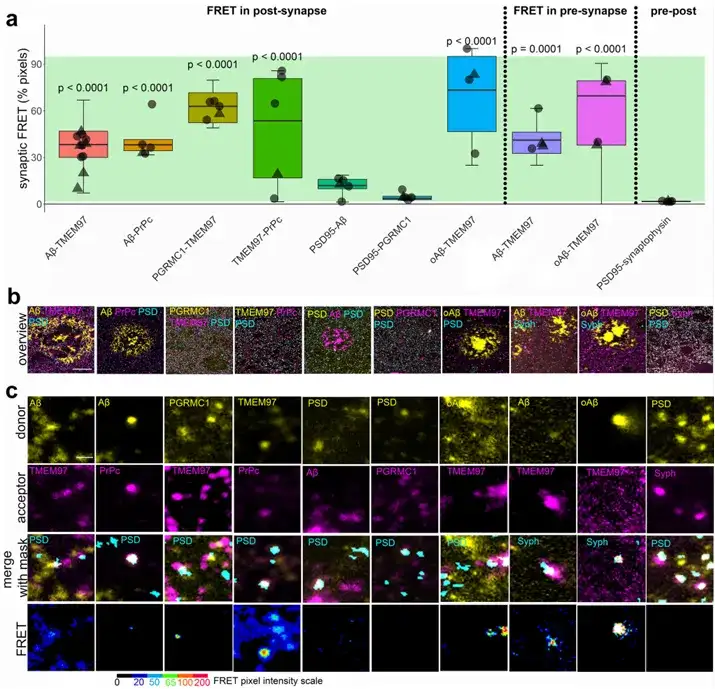
Cadene等人利用SE-FRET分析发现在突触前和突触后密度,Aβ与TMEM97存在FRET信号,证实Aβ和TMEM97在突触中存在相互作用。
综上,伯小医为大家介绍了常用的四种FRET分析方法,大家可根据自身的实验需求以及硬件支撑选择合适的FRET分析方法,也欢迎大家咨询伯远医学进行沟通讨论。
参考文献
Lou J, Deng Q, Zhang X, et al. Heterochromatin protein 1 alpha (HP1α) undergoes a monomer to dimer transition that opens and compacts live cell genome architecture [J]. Nucleic Acids Res, Nucleic Acids Research, 2024, 52, 10918–10933.
Geddes C D, Lakowicz J R. Reviews in Fluorescence 2007 [B]. Springer, 2007.
Chen Y E, Mauldin J P, Day R N, et al. Characterization of spectral FRET imaging microscopy for monitoring nuclear protein interactions [J]. Journal of Macroscopy, 2007, 228(Pt 2):139-152.
Ishikawa-Ankerhold H C, Ankerhold R, Drummen G P C. Advanced Fluorescence Microscopy Techniques—FRAP, FLIP, FLAP, FRET and FLIM [J]. molecules, 2012,17(4):4047-4132.
Weems J C, Slaughter B D, Unruh J R, et al. Assembly of the Elongin A Ubiquitin Ligase Is Regulated by Genotoxic and Other Stresses [J]. The Journal of biological chemistry, 2015, 290(24): 15030-15041.
Ahmed S, Clayton A H A, Herrmann A, et al. Practical manual for fluorescence microscopy techniques. PicoQuant, 2016.
Cadena M C, Toombs J, Simzer E, et al. Transmembrane protein 97 is a potential synaptic amyloid beta receptor in human Alzheimer’s disease [J]. Acta Neuropathologica, 2024, 147(1):32.

