认识衰老
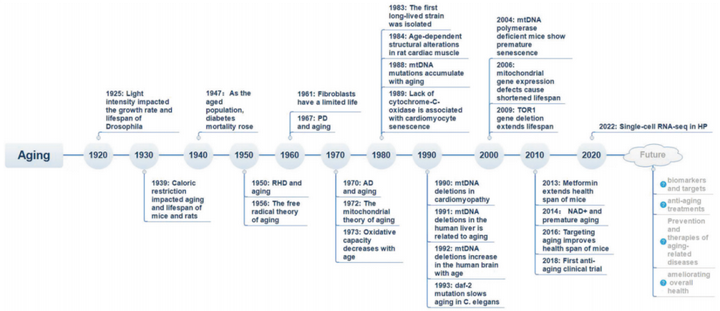
衰老是一个复杂的生物学过程,涉及到多个层面的变化,包括分子、细胞、组织和器官等,其中细胞衰老是最基本的衰老机制。虽然它是一个不可避免的自然过程,但通过健康的生活方式和医疗干预,可以减缓衰老的速度,提高生活质量。在历史过程中,我们也一直在致力于深入研究和对抗衰老,从1925年研究者证实动物的寿命可以人为干预以来,越来越多对衰老过程以及与衰老相关疾病的研究成果在逐渐积累,针对性的治疗和干预策略也陆续发表,随着遗传学的发展以及生物技术的不断突破,人类对衰老的认识也会更加深入全面。
国自然热点中的衰老
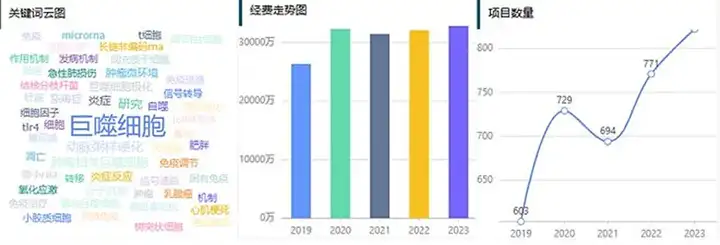
细胞衰老是当前科学研究的热点之一,尤其在国自然的申报和研究中占有重要位置。在国自然热点研究中,细胞衰老的标志物、表型、信号通路、检测方法以及与疾病的关联都是研究的重点。例如,衰老细胞的显著特征包括增殖能力的丧失、抗凋亡途径的上调、衰老相关分泌表型(SASP)的释放、染色质结构的改变、代谢方式的适应性调整、受损大分子的积累以及基因组不稳定性的增加。此外,细胞衰老与肿瘤的关系也是一个重要的研究方向,其中细胞衰老被视为防止细胞癌变的屏障,但过度的衰老也可能导致肿瘤的发生。2023年,细胞衰老领域的国自然中标项目数量达到了5796项,在今年中标项目中也依然稳居热点,显示出该领域的研究受到越来越多的关注,细胞衰老在国自然申请中也越来越占据优势。
表观遗传与衰老
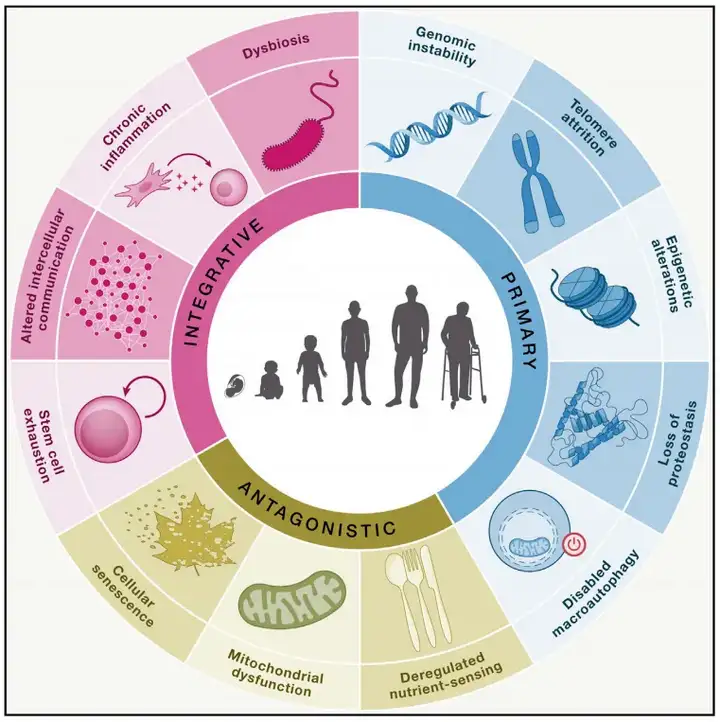
2023年1月发表在《Cell》上的文章详细阐述了衰老的十二大特征,主要包括:基因组稳定性丧失、端粒损耗、表观遗传改变、蛋白稳态丧失、细胞衰老、细胞间通讯改变、线粒体功能障碍、干细胞耗竭、大自噬功能失效、慢性炎症、营养感应失调以及生态失调。其中,表观遗传调控扮演着至关重要的角色,其程序化的改变被认为是衰老的重要标志和关键因素(López-Otín et al., 2023)。
近期哈佛医学院David A. Sinclair团队,通过使用表观基因组诱导变化(Inducible changes to the epigenome,ICE)系统,发现表观遗传信息的紊乱导致小鼠衰老,而恢复表观基因组的完整性可以逆转衰老的迹象,进一步明确了DNA变化不是衰老的唯一原因,甚至不是主要原因,而表观遗传变化是哺乳动物衰老的主要驱动因素(Yang et al., 2023)。所以深入研究表观遗传如何影响衰老过程,对于揭示衰老的本质、评估其发展速度、以及开发抗衰老策略和治疗与衰老相关的疾病,可以提供关键的分子层面的理解。
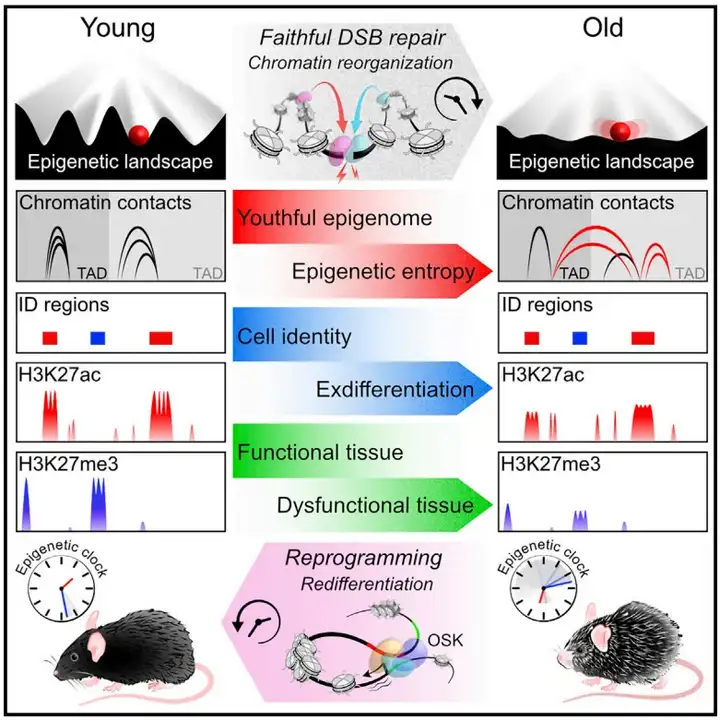
表观遗传学是研究基因表达调控的一门科学,它关注的是在不改变DNA序列的情况下,基因表达如何受到修饰和调控。在衰老的过程中,表观遗传修饰如DNA甲基化、组蛋白修饰等都发挥着重要作用。本期伯小医带大家从表观遗传调控的几种主要作用机制的经典案例分别了解对衰老过程的研究思路。
一
DNA甲基化
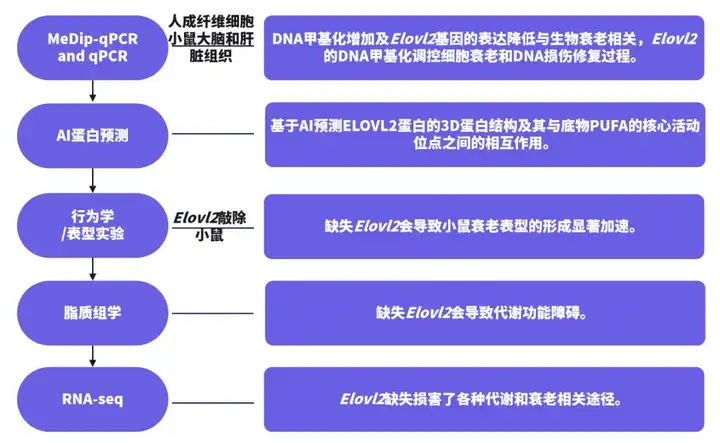
DNA甲基化是表观遗传学中的一种重要机制,它涉及在DNA分子上添加甲基化团,通常发生在胞嘧啶的5’位置,尤其是在胞嘧啶后面紧跟着鸟嘌呤的CpG位点上。这种修饰不会改变DNA序列,但可以改变基因的表达模式,影响基因的活性。在衰老的过程中,DNA甲基化模式会发生改变,这些改变被认为是衰老的重要标志和关键因素。针对大范围的人群全基因组DNA甲基化模式纵向研究证实随着年龄的增长,全基因组呈现低甲基化(Bjornsson et al., 2008),总甲基胞嘧啶水平因为衰老降低,但是启动子区域在许多基因中倾向于发生超甲基化(Ong and Holbrook., 2014)。下面这篇文章通过检测Elvol2的甲基化水平和表达水平,并应用人工智能的方法预测Elvol2的蛋白质结构及其与底物之间的相互作用,揭示了促进衰老的表观遗传代谢轴(Li et al., 2022)。

期刊:Signal Transduction and Targeted Therapy
IF:40.8
研究思路
二
组蛋白修饰
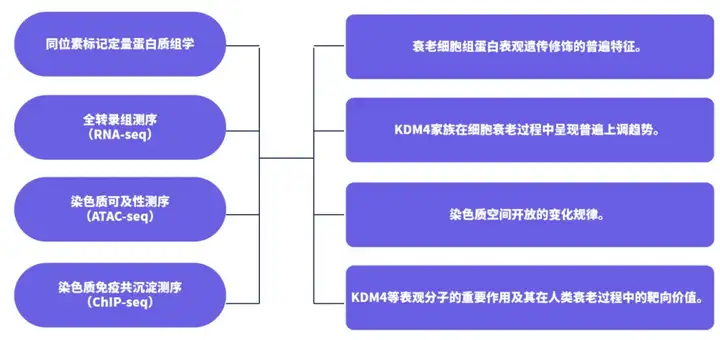
组蛋白的多种翻译后修饰,如甲基化、乙酰化、磷酸化等,可以在不改变DNA序列的情况下调控基因的表达,影响细胞的功能和状态,包括细胞的衰老过程。在衰老细胞中,某些组蛋白修饰的模式可能会发生变化,这些变化可能与衰老相关基因的表达调控有关,还可能成为延缓衰老或治疗衰老相关疾病的潜在靶点。例如,韩敬东实验室的研究发现,组蛋白H3K27me2/3去甲基酶UTX-1/UTX对衰老发挥了重要的调控作用,其功能依赖于胰岛素样信号通路,从而影响寿命和抗逆性(Tao et al., 2024)。中国科学院上海营养与健康研究所的研究发现,组蛋白H3特异性去甲基酶KDM4是衰老相关分泌表型的关键调节因子,它在衰老过程中的表达上调与细胞的生存率呈显著负相关,靶向调节KDM4提供了一种新的治疗途径来调控细胞衰老并限制其对衰老相关疾病,包括癌症的影响(Zhang et al., 2021)。

期刊:Nature Aging
IF:17
研究思路
三
染色质重塑
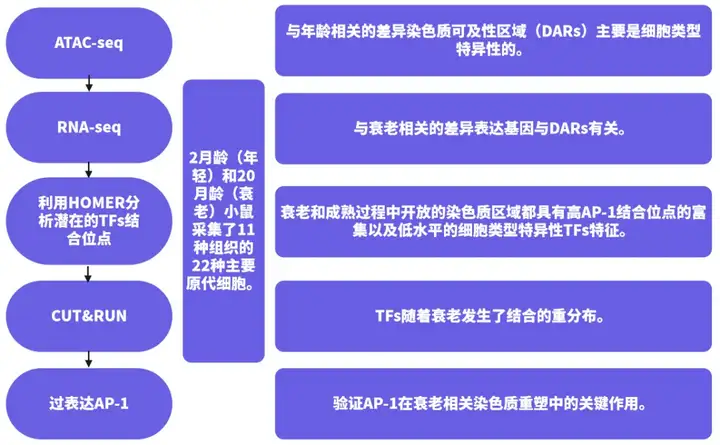
细胞衰老和衰老过程中涉及多种细胞和分子功能衰退,同时伴随着显著的染色质结构变化,包括异染色质的交替和高级染色质结构的破坏。染色质结构的改变不仅影响细胞的衰老过程,还与衰老相关疾病的发生有关。例如,衰老过程中的染色质重塑可能激活某些与疾病发生相关的基因,从而促进疾病的发生和发展。近日,昆士兰大学的Christian M. Nefzger课题组对22种小鼠细胞类型的染色质重塑和转录变化进行了全面分析,揭示了早期染色质可及性与衰老过程之间的关键联系。通过两个过程的组学分析发现了基因组调控元件中共享的转录因子结合模式,构建了与年龄相关的染色质和转录动态图谱,强调了先锋因子AP-1和细胞特性转录因子的结合位点丰度差异的关键作用(Patrick et al., 2024)。

期刊:Cell Metabolism
IF:27.7
研究思路
小医叨叨
总的来说,表观遗传在衰老过程中扮演着重要角色,它们的变化直接影响基因的表达模式,从而影响细胞的衰老和相关疾病的发生。随着研究的深入,这些成果可能成为延缓衰老或治疗衰老相关疾病的潜在靶点。伯远生物提供全面的表观基因组学技术方案,包括对染色质构象、组蛋白修饰、DNA甲基化等的研究技术均可提供一站式服务,除了成熟的表观组学技术服务(ChIP-seq、CUT&Tag、BS-seq、DAP-seq、ATAC-seq和Hi-C等),也可提供周到的个性化服务,有需要的小伙伴欢迎致电详询哦!
参考文献
[1] Guo J, Huang X, Dou L, et al. Aging and aging-related diseases: from molecular mechanisms to interventions and treatments[J]. Signal Transduction and Targeted Therapy, 2022, 7(1): 391.
[2] López-Otín C, Blasco M A, Partridge L, et al. Hallmarks of aging: An expanding universe[J]. Cell, 2023, 186(2): 243-278.
[3] Yang J H, Hayano M, Griffin P T, et al. Loss of epigenetic information as a cause of mammalian aging[J]. Cell, 2023, 186(2): 305-326. e27.
[4] Bjornsson H T, Sigurdsson M I, Fallin M D, et al. Intra-individual change over time in DNA methylation with familial clustering[J]. Jama, 2008, 299(24): 2877-2883.
[5] Ong M L, Holbrook J D. Novel region discovery method for Infinium 450K DNA methylation data reveals changes associated with aging in muscle and neuronal pathways[J]. Aging cell, 2014, 13(1): 142-155.
[6] Li X, Wang J, Wang L Y, et al. Lipid metabolism dysfunction induced by age-dependent DNA methylation accelerates aging[J]. Signal transduction and targeted therapy, 2022, 7(1): 162.
[7] Tao W, Yu Z, Han J D J. Single-cell senescence identification reveals senescence heterogeneity, trajectory, and modulators[J]. Cell Metabolism, 2024, 36(5): 1126-1143. e5.
[8] Zhang B, Long Q, Wu S, et al. KDM4 orchestrates epigenomic remodeling of senescent cells and potentiates the senescence-associated secretory phenotype[J]. Nature aging, 2021, 1(5): 454-472.
[9] Patrick R, Naval-Sanchez M, Deshpande N, et al. The activity of early-life gene regulatory elements is hijacked in aging through pervasive AP-1-linked chromatin opening[J]. Cell Metabolism, 2024, 36(8): 1858-1881. e23.