上期“蛋白互作检测之FRET荧光共振能量转移:分子间距离的微妙舞者”伯小医给大家介绍了FRET的技术原理、实验步骤以及优缺点,本期,小医就通过几篇文献案例,带大家一起来了解下FRET的实际应用吧。
案例一:单分子荧光多路复用检测
2024年5月15日,芝加哥大学Allison H. Squires在nature nanotechnology上发表了题为“Single-molecule fluorescence multiplexing by multi-parameter spectroscopic detection of nanostructured FRET labels”的研究性文章,通过设计新型FRET荧光体实现单分子水平的多重实时荧光检测,支持数千种标签的复用,提高了光谱复用前景。团队设计了几十种复合荧光标记,称为FRET荧光体(FRETfluor),可实现更加优异的单分子水平多重光谱测量,该技术无需清洗,可高精度鉴定生物分子靶标,对生命科学研究提供有力支持。
单分子水平的多重实时荧光检测可以揭示混合物和其他复杂样品中多种分子种类的化学计量、动力学和相互作用。然而,由于信噪比低、光谱重叠高以及需要保持染料的化学相容性,基于荧光的传感通常仅限于一次检测3-4种颜色。团队设计的FRETfluors突破性技术,开启了化学检测新纪元。
FRETfluors由三种化学成分(DNA、Cy3和Cy5)构成致密紧凑型纳米结构,该结构可通过改变几何形状、荧光团附着化学和DNA序列来调控光谱特性。其能够在反布朗运动电动力(ABEL)阱中进行生物分子靶标的高精度多参数识别,如亮度、荧光寿命和FRET效率等,光谱参数差异分析显示出不同团簇,从而对单个FRETfluors进行分类和识别。其设计理念如图1所示。
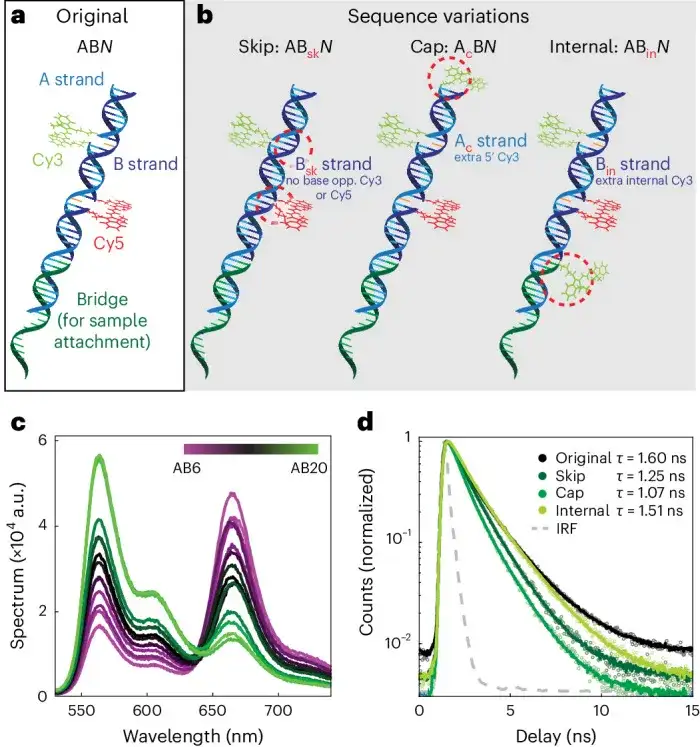
总体而言,FRETfluor设计利用染料光物理的特定位点可调性作为额外的测量维度,以最少的化学构件来补充和组合扩展FRET的多重标记能力。该设计策略在其他纳米结构和荧光团组合上具有通用性,可进一步扩大FRETfluor集合数量,为多重检测提供强大的标记工具。
案例二:生物传感器的开发
2024年9月11日,首尔国立大学医学院Jihye Seong在Small Methods上发表了题为“Novel FRET-based Immunological Synapse Biosensor for the Prediction of Chimeric Antigen Receptor-T Cell Function”的研究性文章,提出了一种基于FRET的创新免疫突触(Immunological synapse,IS)生物传感器,用于实时评估CAR-IS结构和信号传导能力,是预测CAR-T细胞功能的强大工具,代表了一种强大的工具,可以弥合传统体外scFv表征测定与生理相关细胞环境之间的差距,从而提供更准确的CAR-T细胞活化预测(图2)。
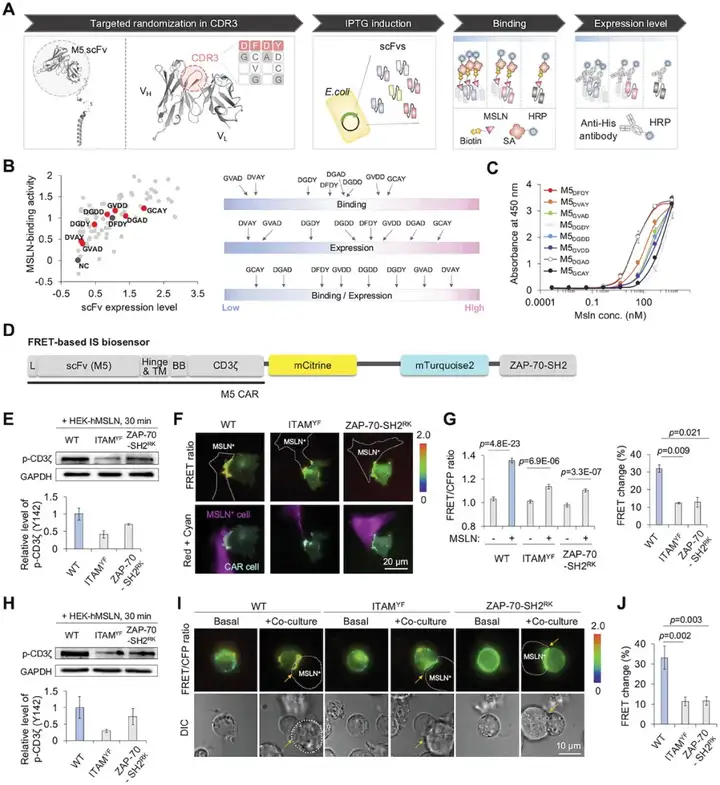
详细而言,该生物传感器可以评估活细胞中IS的质量,从而选择候选CAR,在与肿瘤细胞上的靶抗原结合后,生物传感器中CAR的ITAM结构域被磷酸化,随后与ZAP-70-SH2结构域结合,导致CFP和YFP之间的FRET水平升高。IS生物传感器平台还允许对具有不同scFv变体的MSLN-CAR构建体库的IS定性参数进行有效和全面的评估。总而言之,基于FRET的创新IS生物传感器能够评估初始CAR-T细胞活化,可以指导优化下一代CAR构建体,以实现CAR-T细胞疗法中的有效治疗反应。
无独有偶,2024年9月11日,法国雷恩大学Giulia Bertolin在STAR protocols上发表了题为“Protocol for quantifying LC3B FRET biosensor activity in living cells using a broad-to-sensitive data analysis pipeline”的研究性文章,提出使用LC3B Förster FRET生物传感器的读数全面量化自噬起始,并描述了细胞接种、转染、FRET/FLIM成像和图像分析的步骤。该方案可用于任何生理学或疾病相关范式,可表达LC3B生物传感器以确定自噬是否已启动或停滞。
为了监测活细胞中LC3B上的ATG4B活性,团队开发了LC3B生物传感器,即在proLC3B的N端和C端各设置一对Aquamarine供体和tdLanYFP受体的FRET对,当ATG4B处于非活性状态且无法在传感器内引发proLC3B时,FRET发生在Aquamarine和tdLanYFP之间;反之,ATG4B引发活性在残基G120后裂解并分离Aquamarine和tdLanYFP,导致FRET丢失(图3)。
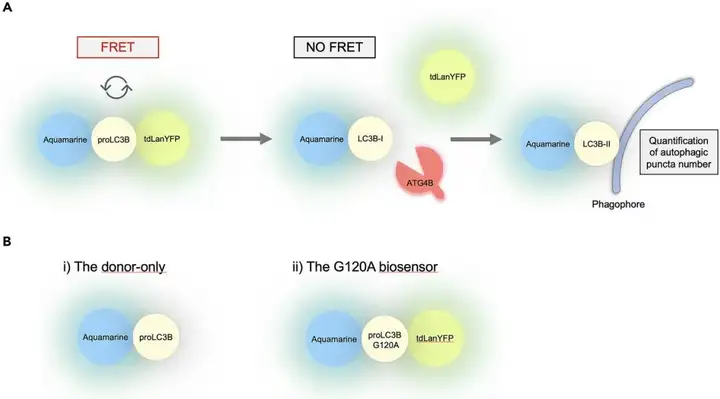
案例三:药物检测
2024年7月31日,暨南大学药学院Ping Hu在Pharmaceutics上发表了题为“Quantification of Microsphere Drug Release by Fluorescence Imaging with the FRET System”的研究性文章。作者以精神分裂症为研究背景,以利用FRET原理建立一个平台,在体外量化药物从微球中释放的药物,从而实时评估药物释放为目的,制备了两种不同种类的微球,每种微球都在PLGA聚合物中封装了不同的药物。选择Cy5作为供体,选择Cy7作为受体,通过FRET技术对促进的微球药物释放进行可视化和定量(图4)。体外实验的结果表明FRET荧光改变与微球的药物释放曲线之间存在相关性。
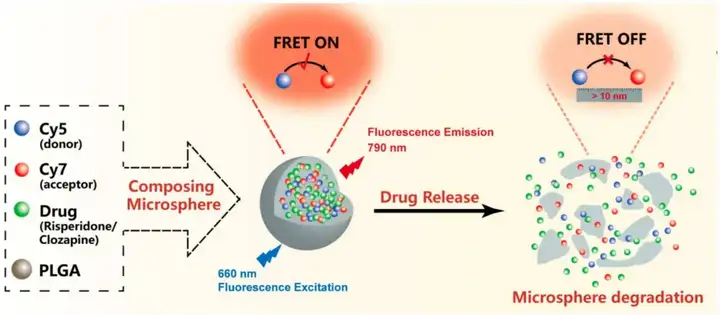
2024年7月26日,北京药理毒理研究所Yi Li在Biosensors上发表了题为“Label-Free and Ultra-Sensitive Detection of Dexamethasone Using a FRET Aptasensor Utilizing Cationic Conjugated Polymers”的研究性论文,提出了一种无标记的FRET适体传感器平台,用于利用共轭聚合物(CPs)、阳离子共轭聚合物(CCPs)和基因查找器探针(GFs)进行地塞米松(Dex)检测。该系统通过利用带正电荷的CCP和带负电荷的DNA之间的静电相互作用来运行,从而促进灵敏和特异性的Dex检测(图5)。无标记FRET适配传感器平台在检测Dex方面表现出强大的性能,具有高选择性和灵敏度。该系统能够有效地将Dex与干扰分子区分开来,并在常用的运动饮料基质中实现一系列浓度的稳定检测。总体而言,无标记FRET Dex检测系统为检测各种样品基质中的Dex提供了一种简单、经济高效且高度灵敏的方法。它的简单性和有效性使其成为反兴奋剂工作和其他需要快速准确Dex检测的应用的理想选择。
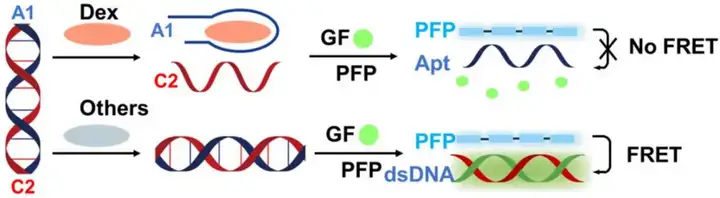
在检测之前,Dex适配体(A1)和互补DNA(C2)被设计并形成双链DNA复合物。在没有目标分子的情况下,适配体仍与C2形成稳定的双链体。然后GF可以嵌入到双链DNA中,与游离态相比,荧光增强超过100倍。带正电荷的PFP和双链DNA带负电荷的骨架之间的静电相互作用缩短了PFP和GF之间的距离,导致FRET从PFP到GF导致PFP荧光显着猝灭,从而增强GF的荧光强度。一旦Dex存在,双链DNA就会分解,导致GF与DNA解离。随后,A1与Dex形成比与C2更特异性和稳定的复合物。因此,GF的游离态最终会破坏FRET系统。因此,通过评估FRET淬灭的程度,可实现Dex的超灵敏定量检测。
案例四:G蛋白活化定量成像
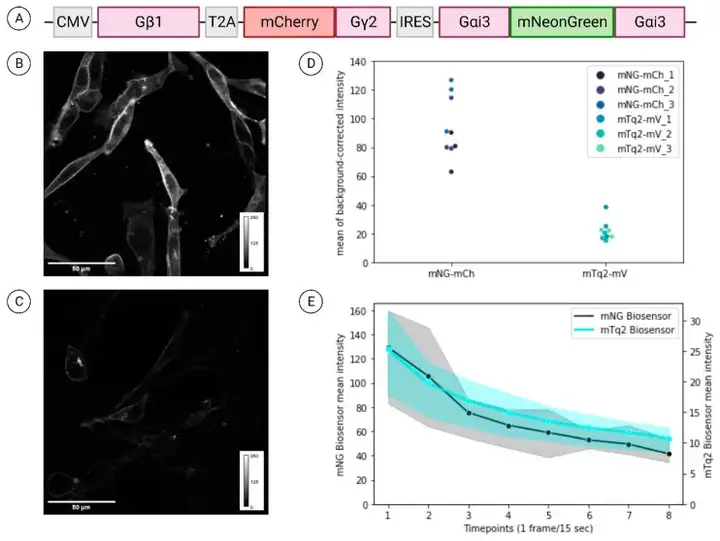
2024年6月27日,伦敦大学Robert H Insall在Cells上发表了题为“A Reliable System for Quantitative G-Protein Activation Imaging in Cancer Cells”的研究性论文,介于目前关于可用于临床相关体外实验的细胞模型的文献存在很大差距,因此,团队使用了更直接的肿瘤相关胰腺癌细胞(PDAC)进行开发,调整现有Gαi3-Gβ1γ2生物传感器,采用mNeonGreen-mCherry替换mTurquoise2-mVenus供体-受体荧光蛋白对,以其他方式保留它们在序列中的原始位置,通过其同源的LPAR1/3探测PDAC细胞中的LPA信号传导。结果表明,在小鼠原代PDAC细胞中,mNeonGreen-mCherry G蛋白生物传感器具有明确的膜定位,是mTurquoise2-mVenus更亮的替代品,使得2光子TCSPC FLIM可以检测到微小的FRET变化。
参考文献
Chen Y, Lu H, He Q, et al. Quantification of Microsphere Drug Release by Fluorescence Imaging with the FRET System[J]. Pharmaceutics, 2024, 16(8): 1019.
Chu J, Ejaz A, Lin K M, et al. Single-molecule fluorescence multiplexing by multi-parameter spectroscopic detection of nanostructured FRET labels[J]. Nature Nanotechnology, 2024: 1-8.
Lee H N, Lee S, Hong J, et al. Novel FRET‐based Immunological Synapse Biosensor for the Prediction of Chimeric Antigen Receptor‐T Cell Function[J]. Small Methods, 2024: 2401016.
Gökerküçük E B, Tramier M, Bertolin G. Protocol for quantifying LC3B FRET biosensor activity in living cells using a broad-to-sensitive data analysis pipeline[J]. STAR protocols, 2024, 5(3): 103181.
Mandrou E, Thomason P A, Paschke P I, et al. A Reliable System for Quantitative G-Protein Activation Imaging in Cancer Cells[J]. Cells, 2024, 13(13): 1114.
Xue Y, Liu H, Zhang Y, et al. Label-Free and Ultra-Sensitive Detection of Dexamethasone Using a FRET Aptasensor Utilizing Cationic Conjugated Polymers[J]. Biosensors, 2024, 14(8): 364.

