*仅供医学专业人士阅读参考
在我们的大脑中,不同类型的脑细胞协同工作,脑细胞主要可分为两大类:神经元和神经胶质细胞,最常见的神经胶质细胞当属星形胶质细胞,它们为神经元提供能量,也是血脑屏障的组成部分,还具有调节突触和支持免疫细胞的能力。
有一小部分星形胶质细胞聚居在成年大脑的特殊区域,能够产生神经元和神经胶质细胞,它们就是神经干细胞,神经干细胞和普通星形胶质细胞的基因表达几乎没有差异,但它们的功能却如此不同,这种差异是如何产生的?此前,科学家们对此完全不清楚。
然而最近,德国癌症研究中心(DKFZ)和德国海德堡大学的研究团队揭示了这个问题的答案,将最新研究成果发表在顶级期刊《自然》上[1]。
他们发现,关键在于表观遗传学的差异,神经干细胞相比星形胶质细胞具有特殊的DNA甲基化模式,干细胞功能是由星形胶质细胞基因的甲基化和后来表达的干细胞基因的去甲基化介导的。他们还发现,大脑缺血会触发星形胶质细胞向神经干细胞的重编程,由DNA甲基转移酶3α(DNMT3A)介导。这为成体神经元再生研究提供了新的希望。

在很长的一段时间里,学界都认为哺乳动物成年后,大脑就不会产生新的神经元了,但是后来的研究揭示,新神经元还是可以产生的,只是存在于特定的脑区中,包括齿状回和脑室-脑室下区(vSVZ)。
小鼠vSVZ中的神经干细胞在激活后成为转运扩增祖细胞,经历多轮分裂并产生神经母细胞,随后迁移到嗅球,分化为神经元,整合入神经回路,也会有一小部分分化为神经胶质细胞。神经干细胞可以处于静息或激活状态,静息神经干细胞中与星形胶质细胞表型相关的基因,包括参与脂质代谢和糖酵解的基因的表达在过渡到激活状态期间逐渐下降。
因此,研究人员使用单细胞核小体、甲基化组和转录组测序(scNMT-seq)同时对成年小鼠的神经干细胞的转录组、染色质可及性和DNA甲基化进行了表征。
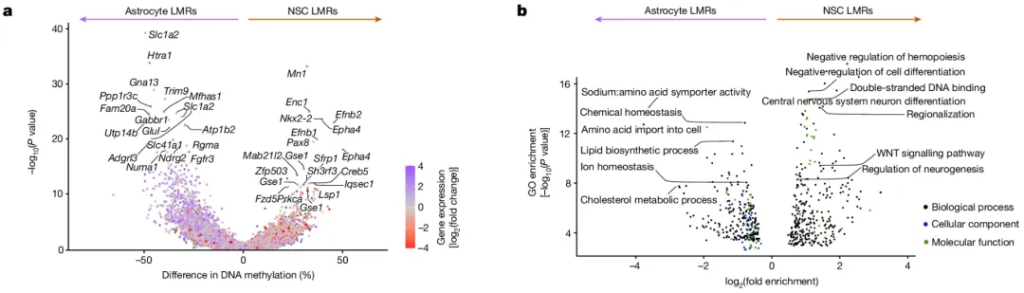
他们发现,静息与激活的神经干细胞的甲基化特征明显分离,静息状态与其他不同脑区的星形胶质细胞非常相似,但由于表达干细胞标志物TLX和TROY,可以与其他星形胶质细胞区分开来,研究人员将它们称为vSVZ星形胶质细胞。
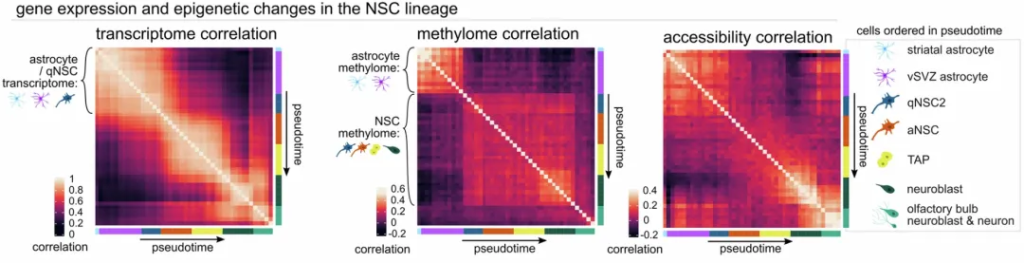
静息与激活的神经干细胞的转录组、DNA甲基化和染色质可及性
通过拟合不同时间点的甲基化水平,研究人员揭示了从vSVZ星形胶质细胞到激活的神经干细胞这一转变中的甲基化和去甲基化变化,转变时,星形胶质细胞相关标志物的甲基化急剧增加。在转运扩增祖细胞阶段晚期,研究人员观察到一批主要在神经母细胞中表达的基因的去甲基化,表明这一阶段去甲基化为神经母细胞基因的后期表达提供了铺垫。
vSVZ星形胶质细胞和激活的神经干细胞之间的差异化甲基化区域中,vSVZ星形胶质细胞的低甲基化出现在参与氨基酸(Slc1a2和Glul)、离子(Slc41a2)和胆固醇(Lcat)等物质转运和代谢的基因附近,激活的神经干细胞的低甲基化出现在细胞分化(Ascl1和Dlx1)和DNA结合(Nkx2-2和Pax8)调节因子附近,像Slc1a2等一些基因的甲基化水平在激活的神经干细胞中则显著升高。
vSVZ星形胶质细胞和激活的神经干细胞之间的差异化甲基化基因和途径
先前的研究发现,脑缺血性损伤可以增加神经母细胞的产生,以及vSVZ中的星形胶质细胞在被缺血性损伤激活后会以干扰素依赖性的方式离开静息状态,这种变化是否与甲基化重塑有关?
研究人员选择了2月龄的小鼠,让它们经历了22分钟的短暂性整体脑缺血,导致了纹状体中的中等多棘神经元和白质的损伤,但没有对vSVZ造成影响。
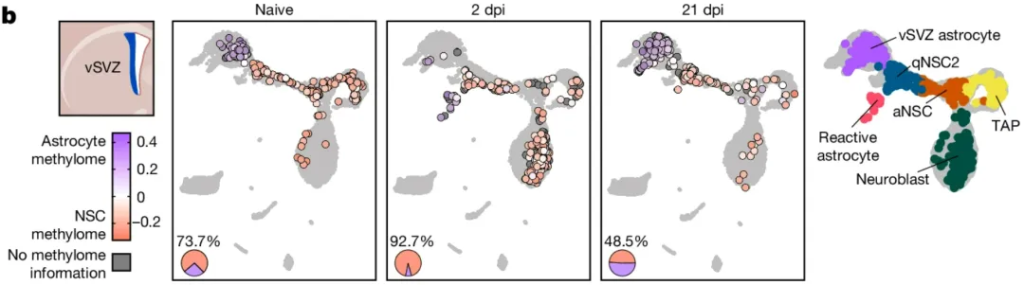
相比未处理的小鼠,缺血2天后,小鼠的vSVZ和纹状体中,神经球形成都有所增加,这是由于大多数vSVZ星形胶质细胞转化为了激活的神经干细胞,它们表现出与前述激活的神经干细胞相一致的甲基化特征,这表明脑缺血小鼠的神经发生随神经干细胞的甲基化变化增加。21天后,这种变化消失。
vSVZ中,缺血后2天(2dpi)小鼠激活的神经干细胞占比显著增加,21天后变化消失
第21天时检测的差异化甲基化区域与编码DNA甲基转移酶3α(DNMT3A)的Dnmt3a基因重叠,DNMT3A负责DNA的从头甲基化,研究人员发现,在Dnmt3a缺失的小鼠中,脑缺血几乎无法增加神经发生,表明DNMT3A是这一过程的重要介导因素。
综上,这项研究揭示了成年的大脑中,具有干细胞特征的星形胶质细胞与激活的神经干细胞尽管转录组相近,但甲基化组差异明显,通过脑缺血等方式调控甲基化的变化,可以将它们重编程为激活的神经干细胞,促进神经发生,为通过再生医学治疗神经疾病提供了新的可能。
参考文献:
[1] Kremer L P M, Cerrizuela S, El-Sammak H, et al. DNA methylation controls stemness of astrocytes in health and ischaemia[J]. Nature, 2024: 1-9.
文章来源:奇点神思