背景介绍
RNA与蛋白质之间的相互作用是细胞生命活动中极其重要的一部分,涉及多种生物学过程,RNA结合蛋白(RBPs)都起着关键的调控作用。RNA结合蛋白(RBPs)调控mRNA的转换和mRNA的翻译,有助于快速和有目的的免疫细胞反应;同时,与mRNA 3’非翻译区(3’UTR)中富AU元件(AREs)相互作用的RBPs已被证明可直接调节细胞质中的mRNA翻译或其稳定性。另外,lncRNAs可以通过与转录因子、核糖核蛋白和染色质修饰复合物等结合来靶向多种蛋白质。lncRNAs在表观遗传调控过程中充当RBPs的诱饵或向导,影响其结合蛋白的修饰、稳定性、定位和活性,在转录和翻译水平上调控基因翻译水平。
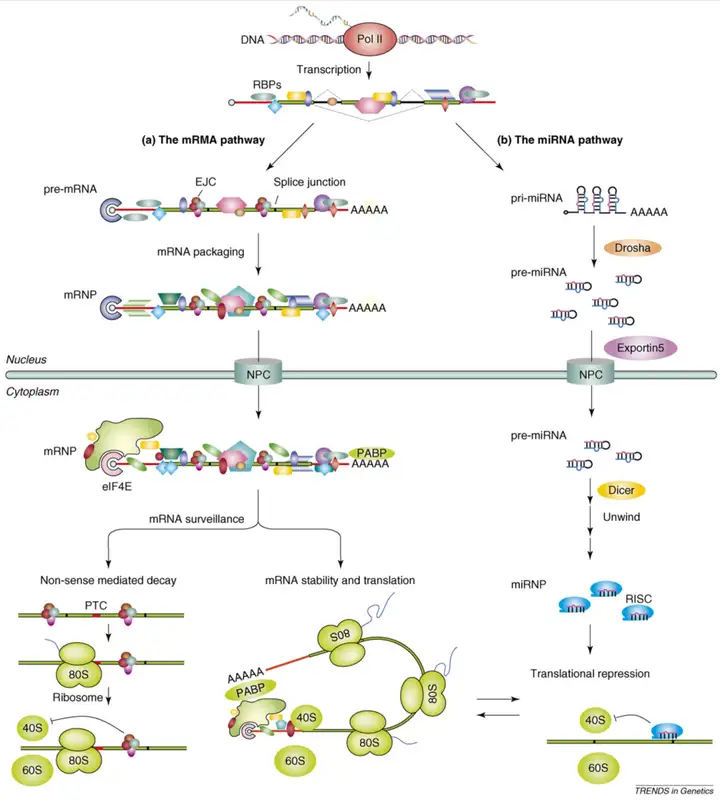
RNA Pull-down和RNA免疫沉淀(RNA Immunoprecipitation, RIP)是研究RNA和蛋白互作的主流技术。RNA Pull-down更倾向于通过目标RNA(已知的RNA)去找到相互作用的未知蛋白,而RIP技术则更多应用于通过目标蛋白(已知蛋白)去找到相互作用的未知RNA。
技术原理
RNA Pull-down用于研究RNA与蛋白质之间的相互作用。这项技术在细胞裂解液中使用生物素标记的RNA探针来捕获与其结合的蛋白质。随后,通过链霉亲和素偶联的磁珠将这些RNA-蛋白质复合物分离出来,从而实现对结合蛋白的富集。之后可以通过质谱分析、Western blot等方法鉴定所富集的蛋白质。
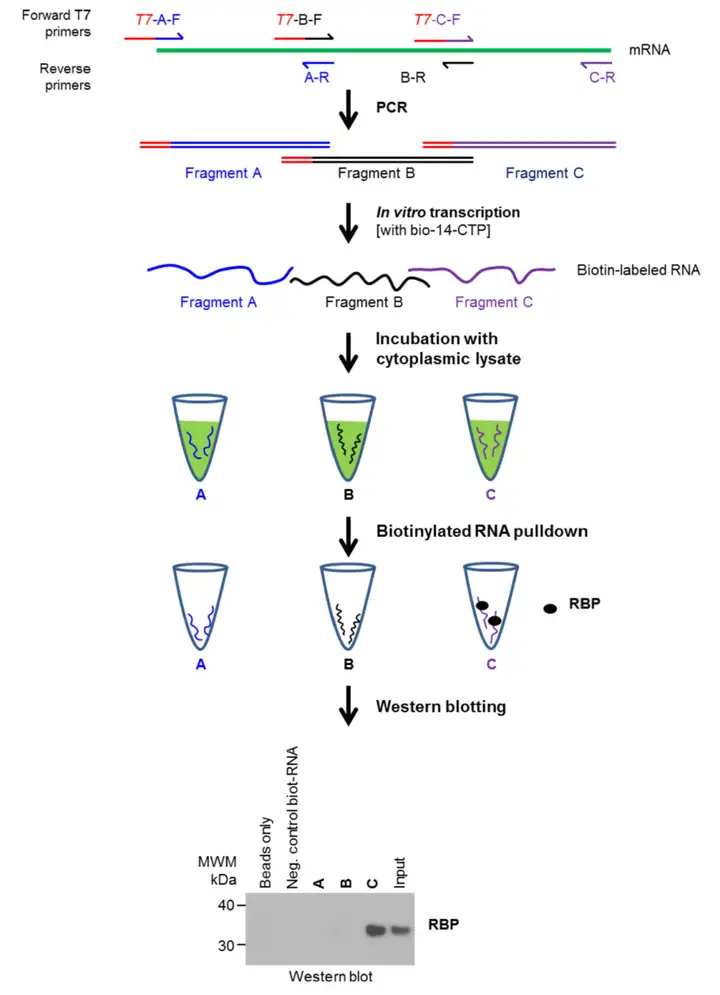
RNA Pull-down技术实验流程主要包括以下几个步骤:
(1)构建含目的基因序列质粒:选择自己感兴趣的基因,根据其序列用同源重组方式或全基因合成构建含目的基因序列质粒;并测序验证序列准确性,并提取含目的基因序列质粒备用;
(2)转录模板的获取:T7 RNA聚合酶特异性识别来自T7噬菌体的启动子序列。为了使T7 RNA聚合酶能够转录任何特定的DNA片段,在用PCR扩增获取转录模板的时候,需要在引物前面加上T7启动子序列。这样,当T7 RNA聚合酶与模板DNA结合时,它会在启动子处开始转录,沿着DNA链移动并合成一条互补的RNA链。在引物前面加入 T7 启动子序列对含目的基因序列质粒进行扩增,同时扩增包括正义链(sense strand)和反义链(Anti-Sence strand),反义链作为阴性对照,琼脂糖凝胶电泳检测扩增PCR产物情况,然后切取目的条带纯化回收、备用;
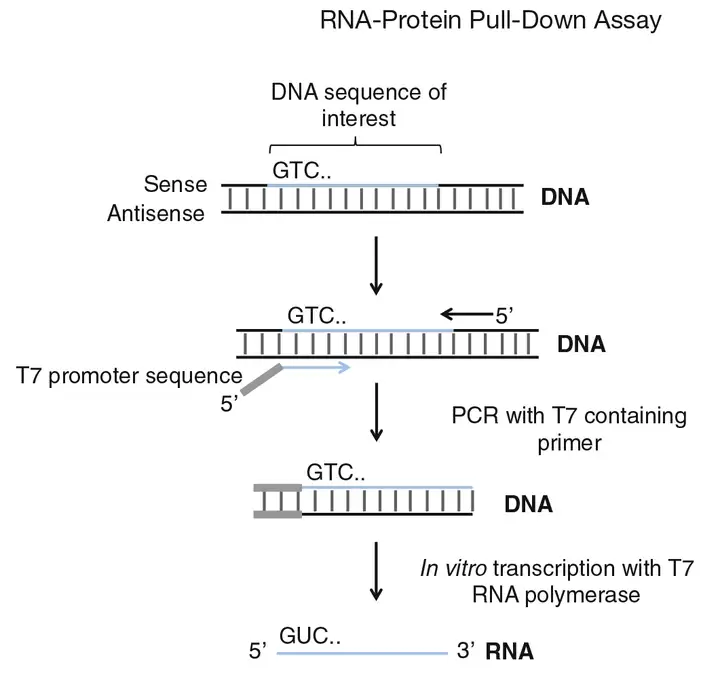
(3)体外转录:将步骤2中获得的PCR产物,用体外转录试剂盒进行体外转录实验以获得目标RNA(含 sense 及 Anti-sense 两组);在体外转录的过程中,主要由T7 RNA聚合酶将转录模板DNA转录成RNA;
(4)RNA生物素标记:为了方便RNA-蛋白的富集,需要在RNA 3’端进行生物素标记或者标签标记,然后与链霉亲和素磁珠结合,通过磁分离实现RNA-蛋白的富集。可通过体外转录标记生物素法来实现,在体外转录过程中加入生物素标记的核苷酸(如生物素-11-UTP或生物素-16-UTP)来实现标记RNA;
(5)细胞裂解:处理细胞以释放细胞内的成分,包括各种可能与RNA相互作用的蛋白质;
(6)RNA-蛋白质复合物形成:生物素标记RNA与链霉亲和素磁珠结合,生成生物素RNA-链霉亲和素磁珠;然后加入细胞裂解液中,生物素RNA-链霉亲和素磁珠复合物富集目的蛋白;
(7)洗脱与鉴定:通过洗涤去除未结合的蛋白质和其他杂质,然后将富集的RNA-蛋白质复合物中的蛋白质洗脱下来,并使用如质谱分析、Western blotting等方法进行鉴定;
(8)数据分析:分析鉴定出的蛋白质,确定哪些蛋白质与特定的RNA序列直接相互作用。
实验常见问题
RNA Pull-down实验是研究RNA-蛋白质相互作用的重要工具之一,但它也可能遇到一系列的实验问题。伯小医为大家列举了一些常见的问题,并提供了相应的解决方案:
(1)RNA未能结合到目的蛋白
问题描述:在结果鉴定中,未发现RNA能结合到目的蛋白。
解决方案:
①确保RNA的质量和完整性,避免降解;
②优化RNA与磁珠的结合条件,如浓度、孵育时间和温度;
③考虑使用不同的RNA修饰方式(如生物素标记、荧光标记等),以提高结合效率。
(2)非特异性结合
问题描述:实验中出现了大量的非特异性蛋白结合,增加了背景噪音。
解决方案:
①使用更高浓度的未标记RNA作为竞争抑制剂,以减少非特异性结合。
②优化洗涤步骤,使用更严格的洗涤条件来去除非特异性结合的蛋白。
③在孵育之前,先用高盐溶液预处理磁珠,以降低非特异性吸附。
(3)蛋白质鉴定困难
问题描述:即使成功捕获了RNA-蛋白质复合物,后续的蛋白质鉴定结果仍然不佳。
解决方案:
①增加样本量,提高蛋白质的回收率;
②对于低丰度蛋白质,可以尝试低丰度蛋白富集处理;
③使用更敏感的蛋白质检测方法,如用新一代Astral质谱分析。
(4)标记RNA效率低
问题描述:生物素标记RNA的效率低下,导致标记不完全。
解决方案:
①选择高效的标记试剂,确保其与RNA的反应条件最佳;
②调整RNA与标记试剂的比例,以达到最佳标记效果。
我司案例展示
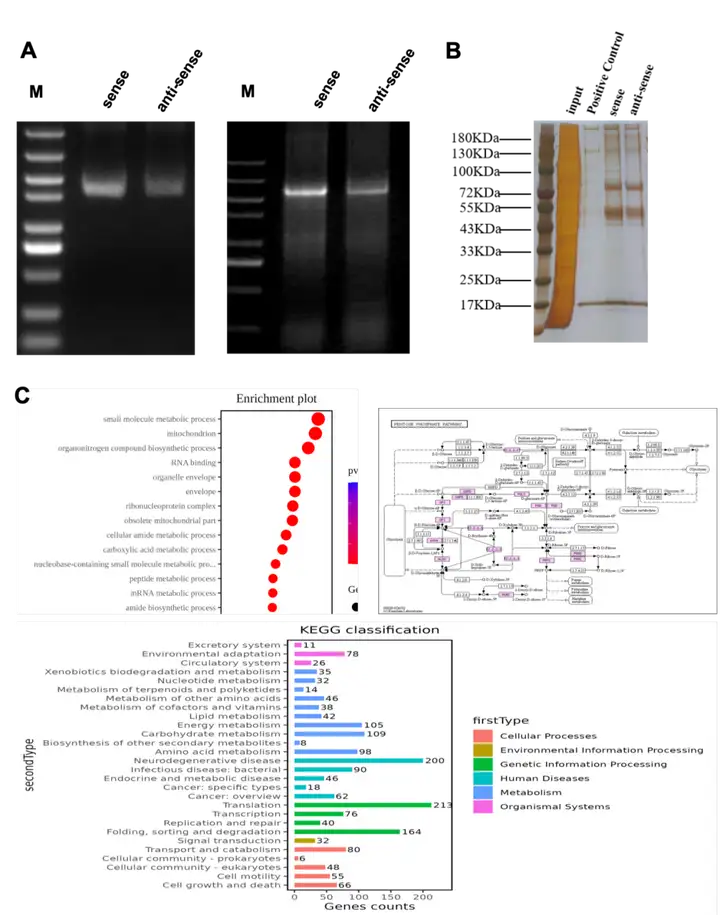
有研究报道了一个在胃肿瘤组织中过表达的lncRNA LINC00501,其通过hnRNPR/SLUG途径促进GC进展,暗示LINC00501是一种很有前景的GC生物标志物和靶点(Dou et al., 2023)。我司用HEK 293T细胞,以LINC00501为目标RNA,富集到了差异蛋白HNRNPR。
伯远医学拥有一流的技术团队、丰富的项目经验,提供专业RNA Pull-down技术服务,适用于RNA与蛋白结合的领域研究,欢迎大家前来咨询RNA Pull-down实验。
参考文献
Barnes C, Kanhere A. Identification of RNA–protein interactions through in vitro rna Pull-down assays[J]. Polycomb Group Proteins: Methods and Protocols, 2016: 99-113.
Dou R, Han L, Yang C, et al. Upregulation of LINC00501 by H3K27 acetylation facilitates gastric cancer metastasis through activating epithelial‐mesenchymal transition and angiogenesis[J]. Clinical and Translational Medicine, 2023, 13(10): e1432.
Gebauer F, Schwarzl T, Valcárcel J, et al. RNA-binding proteins in human genetic disease[J]. Nature Reviews Genetics, 2021, 22(3): 185-198.
Panda A C, Martindale J L, Gorospe M. Affinity Pulldown of biotinylated RNA for detection of protein-RNA complexes. Bio-protocol. 2016; 6[J].

