近日,国家自然科学基金委员会公布了2024年项目评审结果,在各类中标项目中组蛋白修饰依旧是热点关键词,比如大家比较熟悉的甲基化、乙酰化和磷酸化等等。今年频繁登上Cell、Nature等顶刊的乳酸化修饰更是成为了最大的赢家,属于中标数目可观的热点中的热点。虽然目前乳酸化修饰历史文章数目还不是很多,文章分数和质量却很可观,抓住乳酸化修饰的热潮,明年的国自然方向就是它了!
组蛋白乳酸化修饰
染色质是由组蛋白八聚体和缠绕在上面的DNA构成的。在组蛋白的N-末端区域有一段富含赖氨酸和精氨酸的尾巴,上面的氨基酸可以被一些修饰酶添加各种修饰基团,比如甲基、乙酰基和磷酸基等,这个过程就叫组蛋白修饰。组蛋白修饰是表观遗传中最为重要和多样的调控方式,几乎作用于所有生物学过程,调控着基因表达。
乳酸是人体在进行无氧代谢时产生的一种代谢产物,尤其是在剧烈运动后,肌肉中乳酸的积累会导致肌肉疲劳和酸痛。但它的功能并不仅限于代谢终产物的角色,越来越多的研究表明乳酸在生物体内具有复杂的作用。2019年芝加哥大学的赵英明老师课题组发表在Nature上的研究揭示了乳酸在表观遗传途径中的作用,首次发现乳酸能够通过修饰组蛋白来调节基因的转录过程,引发了对乳酸化修饰的广泛关注(Zhang et al., 2019)。组蛋白乳酸化修饰也成为了表观修饰的新热点。
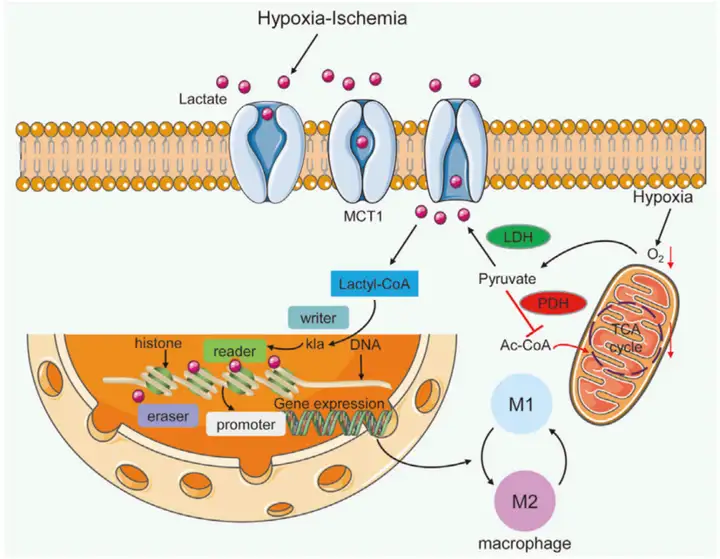
表观组学技术助力
只要有对应的抗体就可以通过表观组学技术获得任意样品和特定时期对应的组蛋白修饰位点分布情况。ChIP-seq和CUT&Tag是检测特定组蛋白修饰位点常用的技术,也是目前研究DNA表观的金标准。ChIP-seq是将染色质免疫共沉淀和高通量测序相结合的技术,通过组蛋白特异性抗体,将带有特定修饰的组蛋白-DNA复合物沉淀下来,从而获取该组蛋白结合的DNA。通过对DNA进行高通量测序,即可获得该组蛋白在染色体上的分布情况,从而确定组蛋白修饰相关的特定位点,还可以确定组蛋白修饰酶类的靶标。CUT&Tag则利用Tn5转座酶的活性特异性通过转座切割目标蛋白周边DNA,可以在全基因组范围内检测目标组蛋白的修饰位点和靶标。
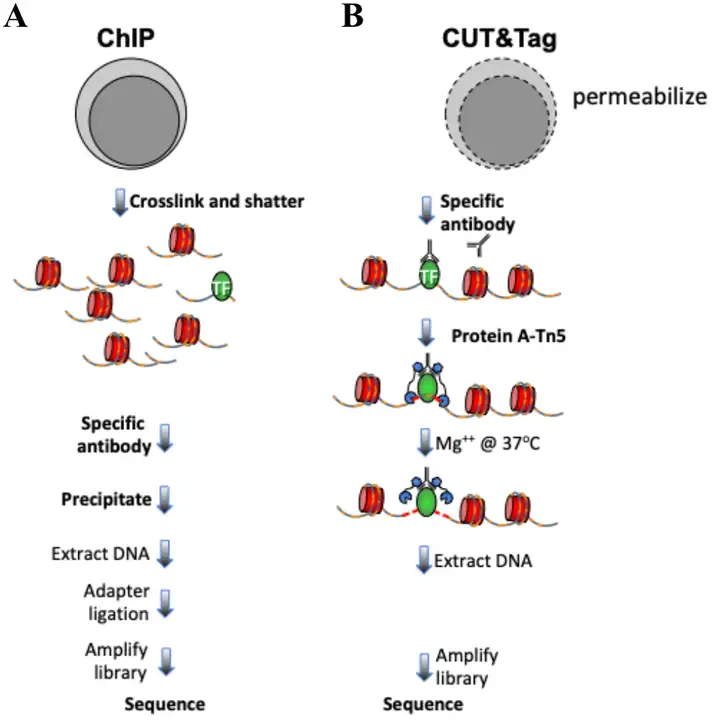
研究思路经典案例
在医学类研究中肿瘤细胞内的乳酸水平较高,对乳酸化修饰的研究对于相关疾病的治疗研究至关重要,可以说乳酸化修饰是研究肿瘤疾病发生发展的又一新方向和新赛道。这篇发表在Genome Biology上的文章是研究组蛋白乳酸化修饰对肿瘤发生过程影响的经典文章,全文路线清晰,希望能为您的研究提供新的思路和方向。

研究思路
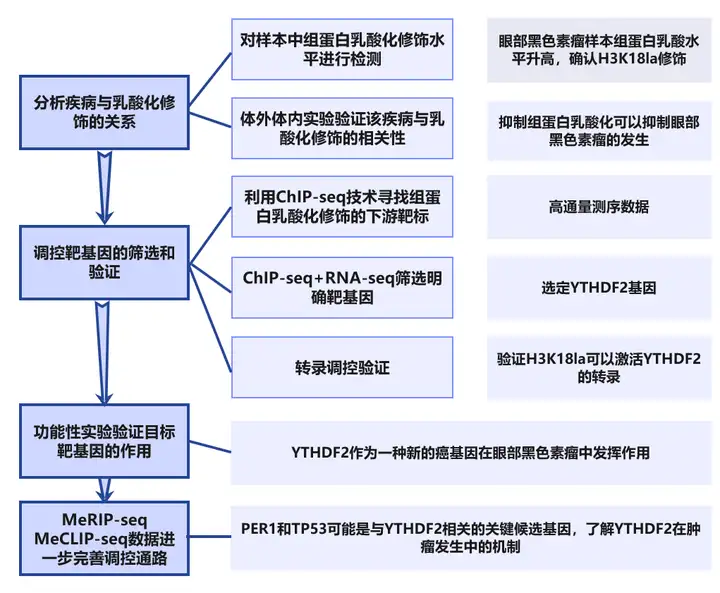
故事机制
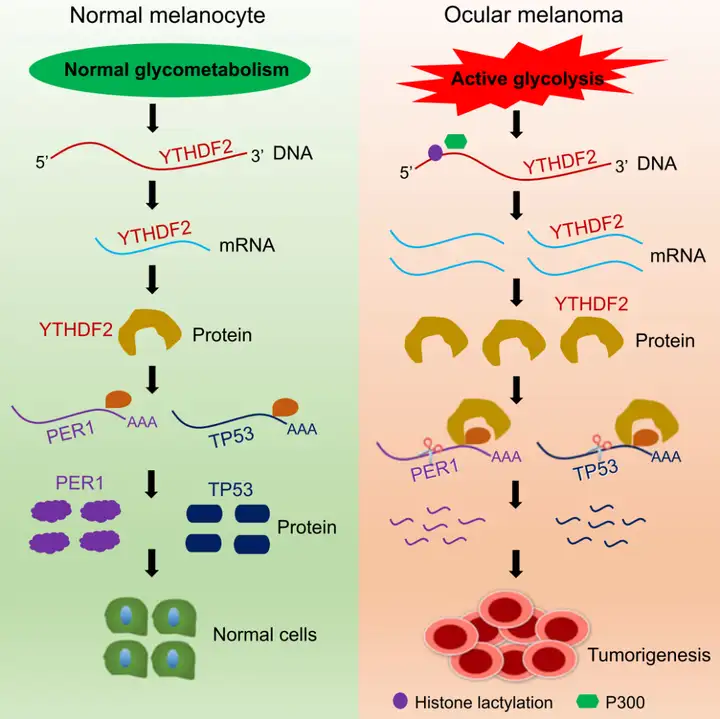
研究内容
1、分析疾病与乳酸化修饰的关系。
1.1 对样本中组蛋白乳酸化修饰水平进行检测。【眼部黑色素瘤样本组蛋白乳酸水平升高,确认H3K18la修饰。】
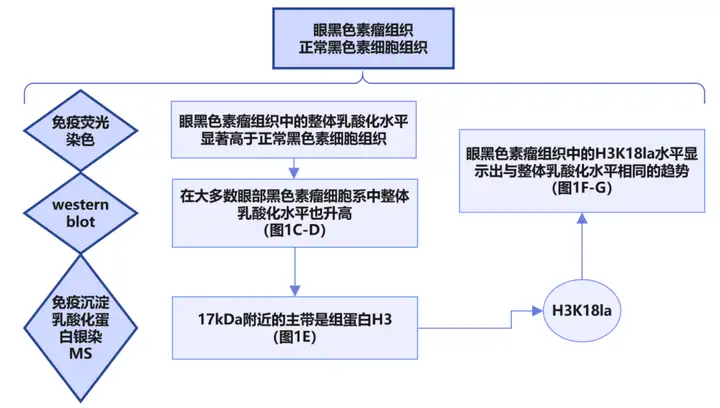
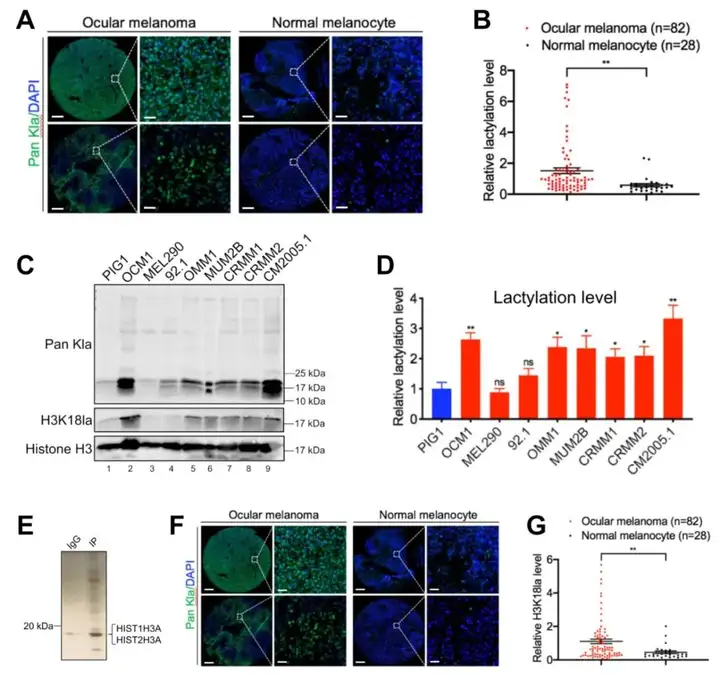
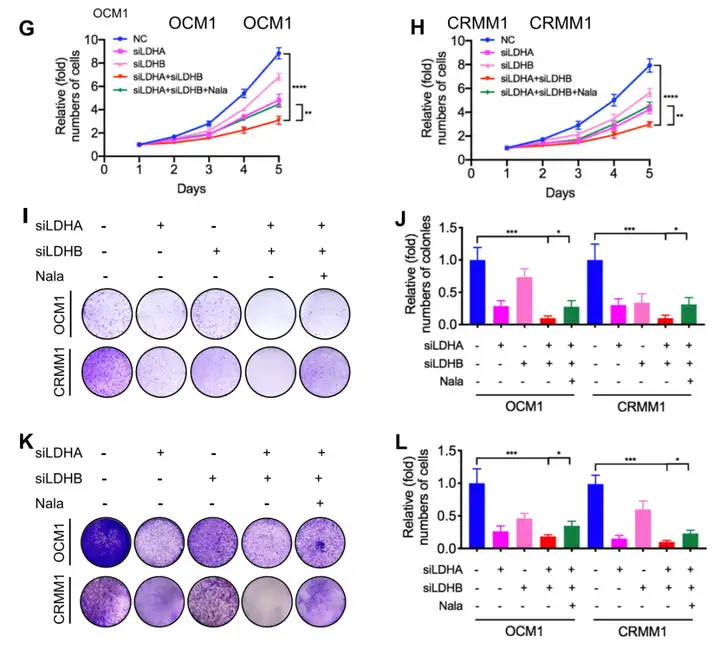
1.2 体外体内实验验证该疾病与乳酸化修饰的相关性。【抑制组蛋白乳酸化可以抑制眼部黑色素瘤的发生。】
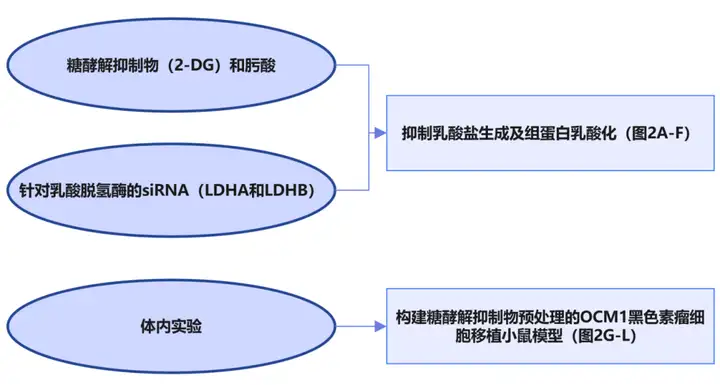
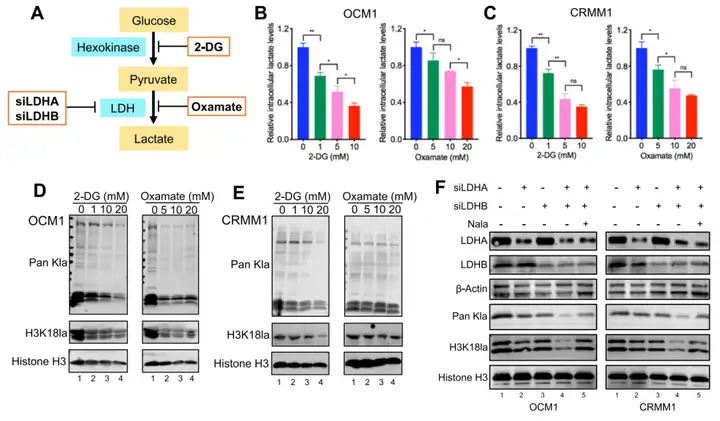
2、调控靶基因的筛选和验证。
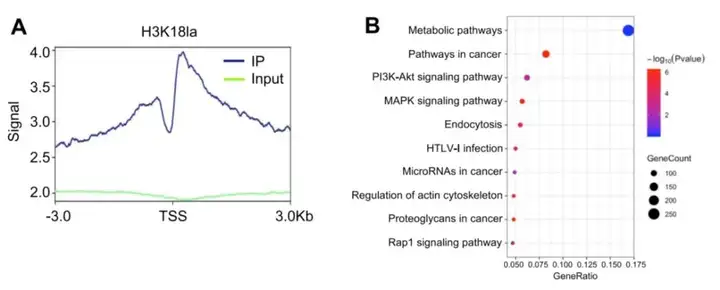
2.1 利用ChIP-seq技术寻找组蛋白乳酸化修饰的下游靶标。【高通量测序数据。】
H3K18la ChIP-seq结果:H3K18la在启动子区域有一定占比(图3A),GO和KEGG显示H3K18la特异性基因在代谢和肿瘤相关通路中富集(图3B),表明组蛋白乳酸化修饰在肿瘤发生过程中发挥了调节作用。
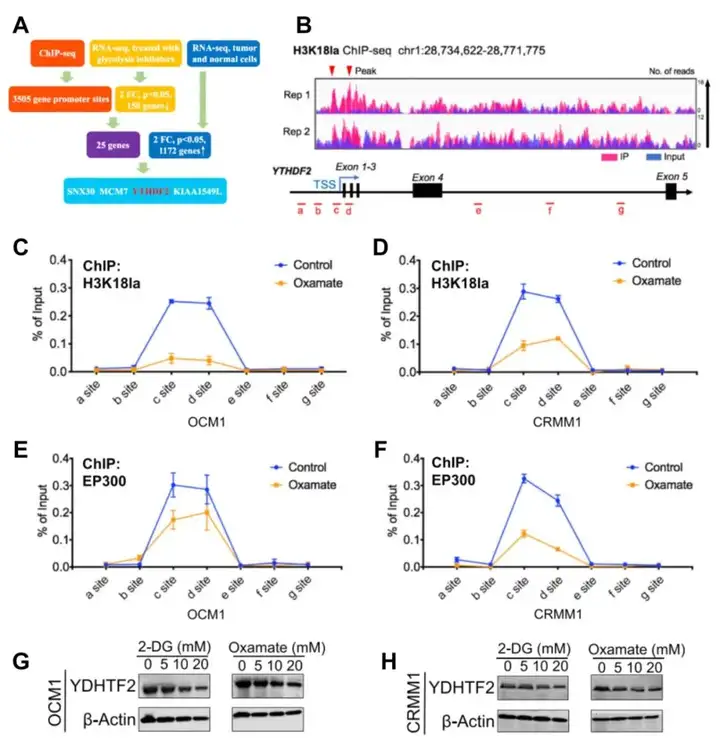
2.2 ChIP-seq+RNA-seq筛选明确靶基因。【选定YTHDF2基因。】
鉴定了4个H3K18la ChIP靶基因,这些基因在糖酵解抑制剂处理的细胞中mRNA水平显著降低,在肿瘤细胞中高度表达(图4A)。其中经典的m6A reader YTHDF2基因被重点关注,并且该基因已经被报道在几种肿瘤中作为癌基因起作用。
2.3 转录调控验证。【验证H3K18la可以激活YTHDF2的转录。】
(1)YTHDF2启动子处H3K18la信号显著富集(图4B);(2)ChIP-qPCR分析表明H3K18la在YTHDF2启动子区域中富集,而且糖酵解抑制剂处理后富集减少(图4C-D);(3)ChIP-qPCR分析显示组蛋白乳酸化writer EP300在YTHDF2启动子区域显著富集(图4E-F);(4)WB验证糖酵解抑制物处理后YTHDF2表达减少(图4G-H)。
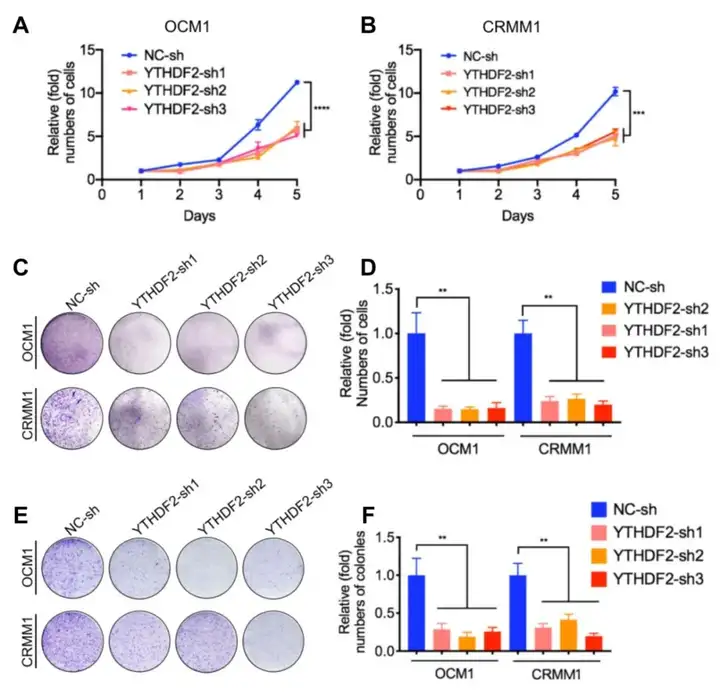
3、功能性实验验证目标靶基因的作用。【YTHDF2作为一种新的癌基因在眼部黑色素瘤中发挥作用。】
(1)敲低YTHDF2后:CCK-8实验显示与正常细胞相比肿瘤细胞的生长速率显著降低(图5A-B);平板集落形成实验和transwell实验显示肿瘤细胞迁移能力降低(图5C-F);(2)过表达YTHDF2后:YTHDF2在眼部黑色素瘤细胞中的过表达加速了肿瘤发生。
4、MeRIP-seq MeCLIP-seq数据进一步完善调控通路。【PER1和TP53可能是与YTHDF2相关的关键候选基因,了解YTHDF2在肿瘤发生中的机制。】
作者利用公共数据库中MeRIP-seq和MeCLIP-seq数据筛选出YTHDF2在肿瘤发生中的PER1和TP53靶标,并通过MeRIP-qPCR和MeCLIP-qPCR验证了YTHDF2可以通过结合它们各自的m6A位点促进PER1和TP53 mRNA降解。
参考文献
[1] Yu J, Chai P, Xie M, et al. Histone lactylation drives oncogenesis by facilitating m6A reader protein YTHDF2 expression in ocular melanoma[J]. Genome biology, 2021, 22: 1-21.
[2] Zhang D, Gao J, Zhu Z, et al. Lysine l-lactylation is the dominant lactylation isomer induced by glycolysis[J]. Nature Chemical Biology, 2024: 1-9.
[3] Zhou Y, Yang L, Liu X, et al. Lactylation may be a novel posttranslational modification in inflammation in neonatal hypoxic-ischemic encephalopathy[J]. Frontiers in pharmacology, 2022, 13: 926802.
[4] Ye Zheng, Kami Ahmad, Steven Henikoff. CUT&Tag Data Processing and Analysis Tutorial. Protocol .io, 2020.

