最近几年生酮饮食(Ketogenic diet,KD)是比较火的饮食方案,既可以减肥又可以减少炎症、增强大脑功能和预防癌症等。生酮饮食是一种以高脂肪(占到总热量的70%~80%)、极低碳水化合物(每日的碳水化合物摄入通常小于50g)和适量蛋白质为比例的饮食方式。生酮饮食之所以被称为“生酮”,是因为人体在饥饿状态下,会从葡萄糖供能模式转换到酮体供能模式。生酮饮食导致游离脂肪酸在肝脏中转化为乙酰乙酸、β-羟基丁酸和丙酮3种酮体,其中β-羟基丁酸是最丰富的形式。了解生酮饮食发挥作用的机制,有助于开发更为健康的饮食方式或疾病治疗手段。
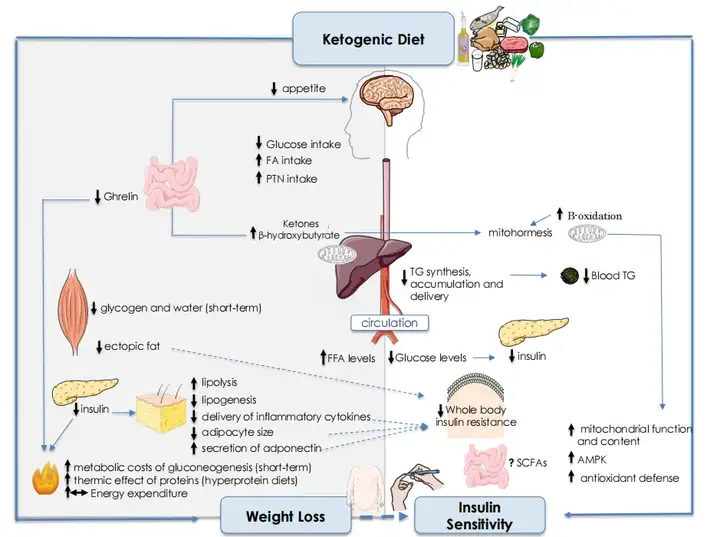
生酮饮食的减肥机制
生酮饮食作为肥胖管理领域的一个热门选择,这种饮食模式被证实能够在短期内显著减少体重和降低血糖水平。生酮饮食减肥的原理包括以下几点:(1)酮体有抑制食欲的作用,高脂饮食会导致饱腹感增加,从而减少进食。(2)极低碳水化合物的摄入导致胰岛素和饥饿素分泌减少,从而减少主动进食并防止把多余的热量储存为脂肪。(3)直接利用脂肪供能和胰岛素分泌减少导致内脏脂肪积累减少。(4)生酮过程会伴有一定的利尿效果,同时糖原消耗也会减少身体中的水分储备,所以在生酮饮食早期会导致体重明显减轻。
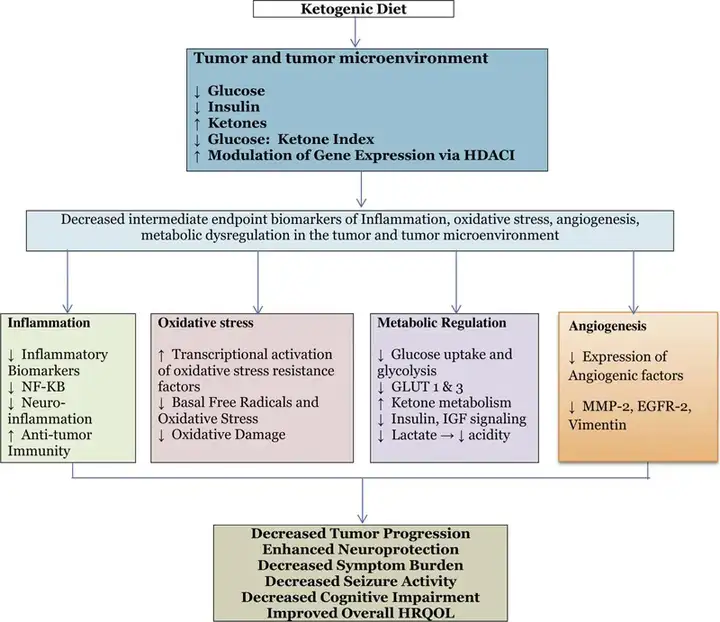
生酮饮食的抗肿瘤机制
生酮饮食在脑肿瘤、乳腺癌、肺癌、消化系统肿瘤等不同类型肿瘤治疗中发挥着重要作用,其发挥作用的机制可能是多方面的,通常包括以下几点:(1)肿瘤细胞的代谢特点包括葡萄糖摄取增加、胆固醇合成增加、磷酸戊糖途径活跃、支链氨基酸摄取和代谢增加等(Seyfried et al., 2022)。著名的Warburg效应指出肿瘤细胞比正常细胞需要消耗更多的葡萄糖。而生酮饮食几乎没有碳水,蛋白质摄入量也低到仅够维持正常的生理机能,让肿瘤细胞失去了合适的增殖条件。(2)生酮饮食导致血液中胰岛素、IGF-1和其它的一些促进肿瘤生长因子(如HIF-1α、NF-κB和VEGFR-2等)的表达水平降低,从而通过降低PI3K/AKT/mTOR通路的活性来抑制肿瘤生长(Branco et al., 2016)。(3)生酮饮食可抑制CTLA4和PD1两种蛋白的表达,改善肿瘤免疫应答的抑制。(4)生酮饮食通过抑制NLRP3炎症小体、肿瘤组织缺氧标志物CA9、白细胞介素等发挥抗炎、抗肿瘤作用。(5)生酮饮食可以降低肿瘤细胞产生NADPH的能力,增加肿瘤细胞的氧化应激,促进肿瘤细胞死亡(曲等., 2016)。
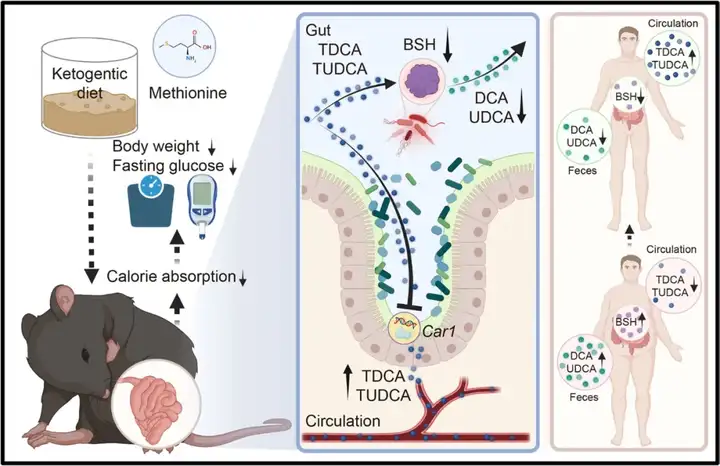
案例一:生酮饮食通过调控胆汁酸代谢的减肥机制

2024年6月27日,复旦大学生命科学学院洪尚宇研究员团队和郑琰研究员团队联合在Nature Metabolism(IF:18.9)上发表了题为“Ketogenic diet-induced bile acids protect against obesity through reduced calorie absorption”的研究性论文,该研究揭示了生酮饮食通过调控肠道微生物-胆汁酸代谢抗肥胖的分子机制。
研究背景
生酮饮食作为一种低碳水化合物的饮食方式,能够在短期内降低体重和血糖水平,长期以来被应用于减肥,但其潜在的分子机制不清楚。以往研究表明,肠道菌群及其次级代谢产物可能在调节生酮饮食诱导的代谢变化中发挥着重要作用,但所涉及的特定肠道菌群或代谢物不是很清楚。
研究结果
首先用生酮饮食或普通饮食喂养小鼠,对这些小鼠的空腹血清进行靶向代谢组学分析,发现生酮饮食提高血清牛磺脱氧胆酸(TDCA)和牛磺熊去氧胆酸(TUDCA)的水平,降低体重和空腹的血糖水平。接着通过抗生素干预、微生物移植、鸟枪法宏基因组测序、代谢物回补、转录组测序、BODIPY荧光探针标记等实验,验证肠道微生物依赖性的TDCA和TUDCA是生酮饮食发挥抗肥胖作用的关键代谢物。在分子机制上,生酮饮食通过降低了肠道微生物肠道菌株Lactobacillus murinus ASF361(编码BSH)的丰度,导致TDCA和TUDCA的解偶联减少和循环水平上调。TDCA和TUDCA进一步通过下调肠道Car1的表达,减少肠道脂质吸收来抵抗肥胖。最后利用多种肥胖/糖尿病小鼠模型发现口服TDCA和TUDCA能够显著降低肥胖和糖尿病小鼠的体重和空腹血糖水平,且无明显副作用。对自然人群队列数据进行分析发现人体中较高的TDCA和TUDCA水平与较低的BMI或空腹血糖水平相关。总之,本研究揭示了生酮饮食通过改变肠道微生物的结构和胆汁酸的组成,诱导TDCA和TUDCA的循环水平上调,抑制肠道Car1的表达,进而通过减少肠道能量吸收水平来减轻体重。该研究为肥胖的预防和治疗提供了潜在的新靶点和新药物。
案例二:生酮饮食能够饿死胰腺癌细胞

2024年8月14日,加州大学旧金山分校Davide Ruggero团队在Nature(IF:50.5)上发表了题为“Remodelling of the translatome controls diet and its impact on tumorigenesis”的研究性论文,该研究发现生酮饮食能够饿死癌细胞,助力抗癌药物清除肿瘤。
研究背景
从希腊哲学家希波克拉底和柏拉图开始,几千年来禁食就被认为对健康有益。间歇性禁食和生酮饮食可以带来减肥、减少炎症、增强大脑功能和预防癌症等广泛的益处。由禁食、生酮饮食或运动诱导的生酮已被证明可以激活多种细胞信号通路。但禁食信号如何在蛋白质组水平上引起基因表达的变化,从而建立酮体产生的代谢程序,仍然不是很清楚。
研究结果
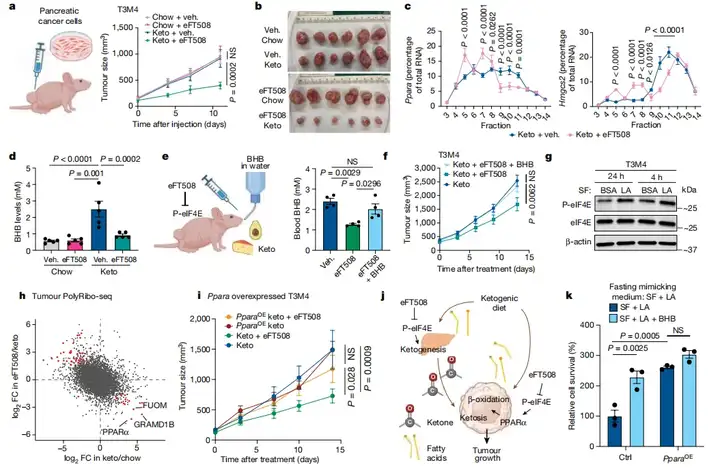
首先通过对不同饮食情况小鼠进行WB、PolyRibo-seq、代谢组分析,发现禁食诱导eIF4E磷酸化,促进脂质代谢和酮体产生。体内荧光素酶报告基因测定,发现P-eIF4E通过5’非翻译区(5’UTRs)中的富含嘧啶的翻译元件(PRTE)介导禁食诱导的翻译。接着结合体外活性测定、凝胶迁移等实验,发现脂肪酸增强AMPK活性以诱导MNK-P-eIF4E信号轴,AMPK-MNK-eIF4E信号轴控制酮体生成,揭示了一条新的脂质介导的激酶信号通路,将酮体生成与翻译控制联系起来。最后用eFT508的抗癌药物治疗胰腺癌,发现该药物可使eIF4E失活,从而阻止胰腺肿瘤生长。总之,本研究揭示了禁食或生酮饮食通过脂肪酸激活MNK-P-eIF4E轴,促进特定mRNA的选择性翻译,从而调节酮体生成和肿瘤生长的新机制,为胰腺癌的治疗提供了新的临床策略。
案例三:生酮饮食通过赖氨酸β-羟基丁酸化重塑癌症代谢

2024年8月12日,华中科技大学薛宇团队和四川大学贾大团队联合在Nature Metabolism(IF:18.9)上发表了题为“Ketogenic diet reshapes cancer metabolism through lysine β-hydroxybutyrylation”的研究性论文,该研究表明生酮饮食通过赖氨酸β-羟基丁基化(Kbhb)重塑癌症代谢。
研究背景
生酮饮食已在癫痫、内分泌和代谢紊乱、神经系统疾病、COVID-19和癌症等许多人类疾病中显示出治疗效果。生酮饮食可以增强了多种能量密集型过程。此外,生酮饮食使用乙酰乙酸和β-羟基丁酸作为信号调节因子来协调细胞稳态。除此之外,生酮饮食增加赖氨酸β-羟基丁基化的水平。但生酮饮食如何通过Kbhb调节细胞过程仍不清楚。
研究结果
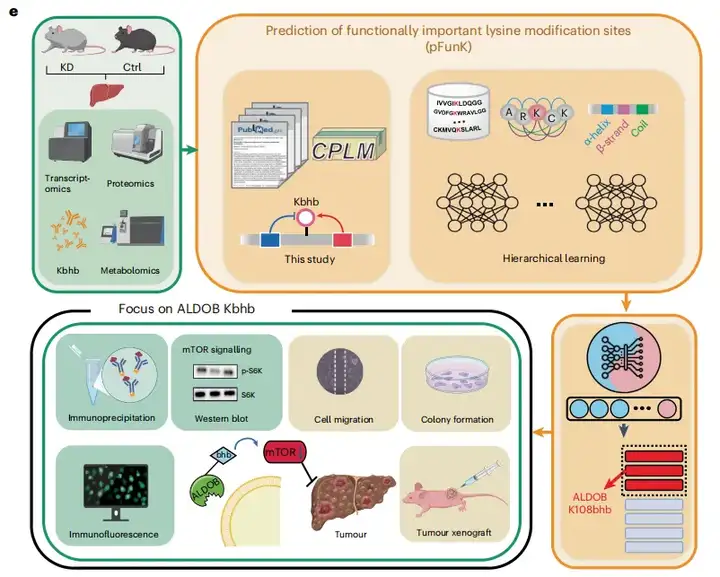
首先通过对生酮饮食小鼠肝脏进行了转录组学、蛋白质组学、赖氨酸β-羟基丁酰化修饰组学和代谢组学的多组学定量分析,发现生酮饮食通过赖氨酸β-羟基丁酰化修饰调控糖酵解和三羧酸循环(TCA)等细胞过程。接着结合前沿人工智能技术,开发了一个赖氨酸功能性位点预测框架pFunK,预测了潜在具有重要功能的赖氨酸β-羟基丁酰化位点。最后通过算法预测、细胞实验、动物实验等发现生酮饮食或添加β-羟基丁酸可增加缩醛酶B(ALDOB)的K108位赖氨酸β-羟基丁酰化修饰水平,抑制哺乳动物mTOR信号通路和糖酵解过程,从而抑制癌细胞增殖。总之,本研究不仅揭示了ALDOB Lys108bhb在重塑生酮饮食触发的癌症代谢中的关键作用,而且还为预测功能重要的赖氨酸修饰位点提供了普遍适用的语言模型。
参考文献
1.Seyfried TN, Sanderson TM, El-Abbadi MM, et al. Role of glucose and ketone bodies in the metabolic control of experimental brain cancer[J]. British Journal of Cancer, 2003, 89(7):1375-1382.
2.Branco A F, Ferreira A, Simǒes R F, et al. Ketogenic diets:from cancer to mitochondrial diseases and beyond[J]. European Journal of Clinical Investigation, 2016, 46(3):285-298.
3.Xiao L, Jie Y, Xiaofeng Z, Chen D,et al. Ketogenic diet-induced bile acids protect against obesity through reduced calorie absorption[J]. Nature Metabolism, 2024, 6:1397–1414.
4.Haojun Y, Vincenzo A Z, James L, et al. Remodelling of the translatome controls diet and its impact on tumorigenesis[J]. Nature, 2024.
5.Junhong Q, Xinhe H, Shengsong G, et al. Ketogenic diet reshapes cancer metabolism through lysine β-hydroxybutyrylation[J]. Nature Metabolism, 2024.
6.Angela P, Andrew P K, Kathleen M E, et al. Targeting the Warburg effect for cancer treatment: Ketogenic diets for management of glioma[J]. Seminars in Cancer Biology, 2019, 56:135-148.
7.Antonio P, Antonino B, Tatiana M, et al.The Effects of Ketogenic Diet on Insulin Sensitivity and Weight Loss, Which Came First: The Chicken or the Egg[J]? Nutrients, 2023, 15(14):3120.
8.曲芊诺,饶本强,石汉平.生酮饮食的抗肿瘤机制[J].肿瘤代谢与营养电子杂志, 2016,第3期.
9.贾胜,王新月,高键.生酮饮食抗肿瘤效应的临床研究进展[J].肿瘤代谢与营养电子杂志, 2021,第6期.

