细胞是生物体结构和功能的基本单位,在漫长的进化过程中,为实现胞内各组分有序执行相应的功能,在漫长的进化过程中,演变出了一系列无膜和有膜(又分为单膜、双膜)细胞器。其中,有膜细胞器可保证胞内蛋白及核酸等物质在特定时间/空间内发挥特定功能,那么无膜细胞器又是如何形成的呢?其理化性质又是怎样的呢?这一系列的问题一直是困扰科学界多年的问题。
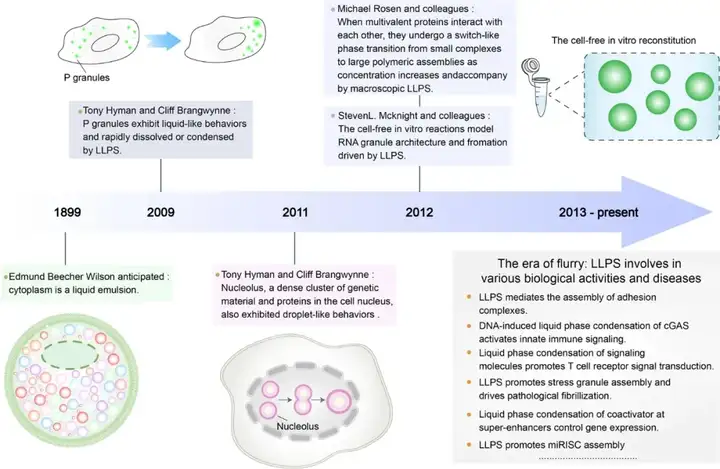
2009年,德国Clifford P Brangwynne以第一作者在Science(IF:44.7)上发表了题为“Germline P granules are liquid droplets that localize by controlled dissolution/condensation”的研究性文章。首次将相分离(Phase separation)概念引入生物系统中,认为液液相分离(liquid-liquid phase separation, LLPS)可能是无膜细胞器形成的物理化学基础,为解决上述问题提供了全新思路。下面就和伯小医一起来学习下吧!
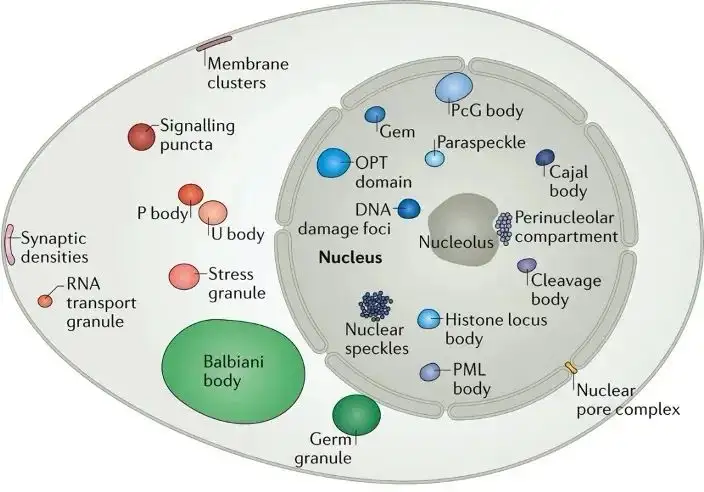
一、相分离简介
相分离是一个物理化学概念,指的是在一个体系中,不同物质组分之间由于相互作用差异而形成的具有不同物理化学性质的不同相(物质形态的科学称谓,如:气态、液态、固态等),这些相在空间上可明显区分开来。例如生活中随处可见的油滴在水中漂浮就是一个典型的LLPS。2009年,相分离被引入到生物学研究中,特指生物大分子在胞内凝聚的特殊状态,描述的是胞内不同成分间相互碰撞、融合形成液滴,从而使一些成分被包裹在液滴内,一些成分被阻隔在液滴外的现象,用以解释胞内通过分子相分离,组织调控内部环境,形成无膜细胞器(如:核仁、miRISC、中心体、PML小体、应激颗粒、P颗粒、异染色质及突触的细胞骨架等等)。相分离发展史详见图1。目前,LLPS已成为生命科学领域研究的热点,相关的文章近年来呈现井喷似的增长。LLPS在细胞中普遍存在,与基因组组装、转录调控、RNA干扰、免疫应答等多种过程密切相关,在众多疾病的发生发展过程中发挥重要作用,科学家们已通过LLPS视角重新审视相关疾病,通过干扰异常“相分离”,探寻新的药物靶点,以期达到治疗相关疾病的目的。
生物大分子的相分离一般包含以下特点:(1)分子由自由态转为聚合态,此过程动态可逆;(2)相关蛋白具有高度保守的无规卷曲结构;(3)存在精密的调控机制。蛋白质与核酸之间微弱的多价互作对于胞内触发LLPS是必不可少的,蛋白质通过串联结合模块以及重复基序实现多价性,例如:在神经细胞中,细胞间信号传递离不开蛋白质在连接处的聚集与相分离,这是保证细胞间信号传递正常进行的关键;在肌萎缩性脊髓侧索硬化症中,分离成液滴的蛋白质会逐渐凝固、硬化,形成有害的固体物质。
二、研究相分离的常用技术
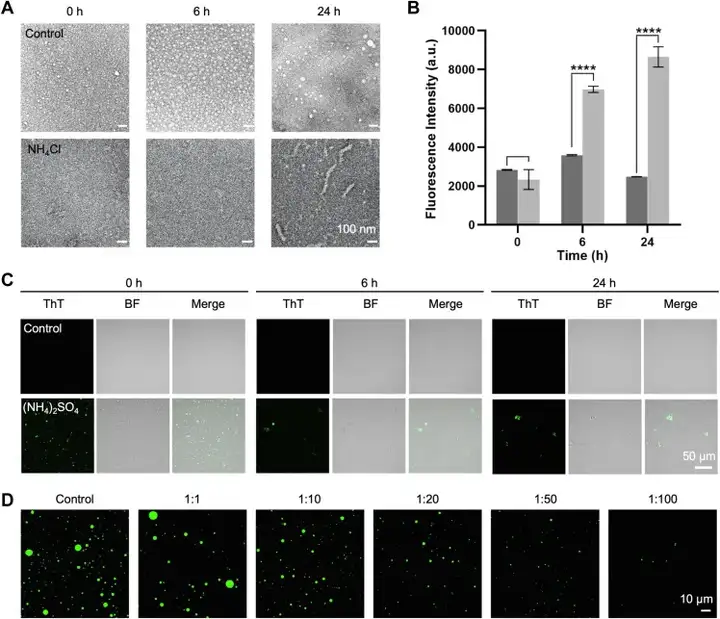
目前,研究相分离时通常采用体外重构相分离过程,验证其机制的存在,显微成像技术是观察相分离的主要手段,镜下采集图像如图2所示,采用的显微镜类型包括如下几种:
01普通光学显微镜:可用于观察无标记的相分离溶液,获取液滴形成过程、大小以及固态样结构等。
02荧光显微镜:荧光标记特定的蛋白质或RNA分子后,观察其在细胞内的分布和聚集情,与普通光学显微镜相比,荧光显微镜具有信噪比高、利于体内观察、可进行性定量分析等优点。如今随着科学技术的发展,荧光显微技术也在不断更新升级,例如:激光共聚焦显微技术、超分辨显微成像技术、宽场荧光显微技术等,进一步提高了显微成像的分辨率和精确度。
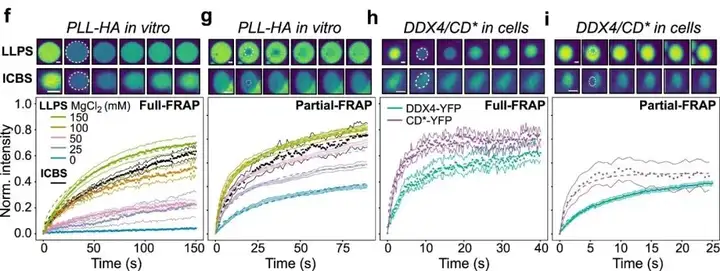
相分离研究的关键在于证明目标蛋白存在动态可逆的聚集-解聚状态变化,且这一变化与蛋白功能相关。基于这一特性,目前研究相分离时常用到的就是光漂白-恢复实验(Fluorescence redistribution after photobleaching,FRAP),其原理为利用脉冲高强度激光漂白目标区域后,观测该区域随时间推移过程中的荧光恢复动力学情况,以评估区域内分子的流动性和交换性。FRAP仅能测量特定条件下液滴的动力学变化过程,其检测结果如图3所示。
三、相分离在人类疾病中的应用
01肿瘤中的相分离
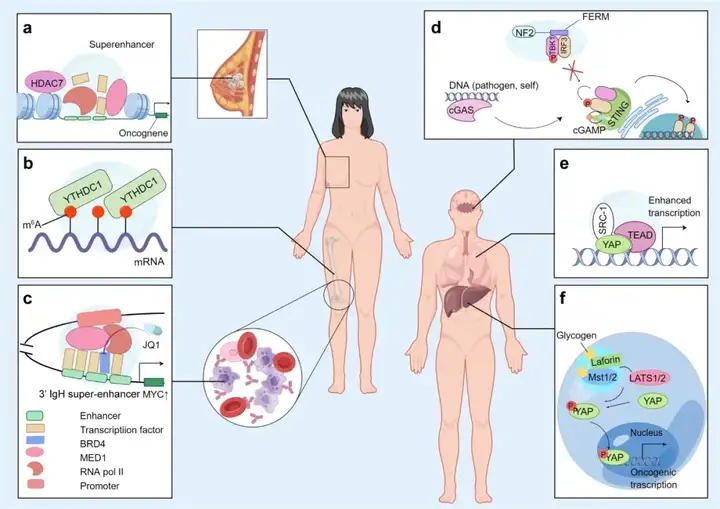
研究显示,LLPS参与细胞中的多种生物学过程,如染色质结构、DNA损伤修复、转录调控、细胞内信号传导和蛋白质降解等,任意一过程的异常都是肿瘤生物学研究中的核心事件(图4)。目前,已在多种肿瘤中发现了调节染色质组织的相分离液滴成分的遗传改变。Gibson等人发现,重组的染色质在体外和细胞中都会经历LLPS。越来越多的研究证实了LLPS与染色质压缩之间的因果关系,例如,异染色质中的DNA去甲基化与不同类型癌症(如乳腺癌、淋巴癌和内皮癌)的染色体易位有关,并且异染色质高甲基化的减少与人类癌症的进展和转移高度相关。
众所周知,Wnt/β-catenin信号通路过度激活是多种肿瘤致癌的早期事件之一,而由APC突变引起的Wnt/β-catenin信号通路过度激活在大部分结直肠癌(CRC)中普遍存在。有研究表明,AXIN和APC发生LLPS对其抑制Wnt/β-catenin通路的功能至关重要。
当正常的LLPS被遗传或表观遗传突变破坏时,异常的生物分子凝聚物可能参与肿瘤发生,Ming等人证明,癌细胞可能对LLPS更敏感,更容易上瘾,这表明LLPS在癌症中的治疗潜力。
02神经退行性疾病中的相分离
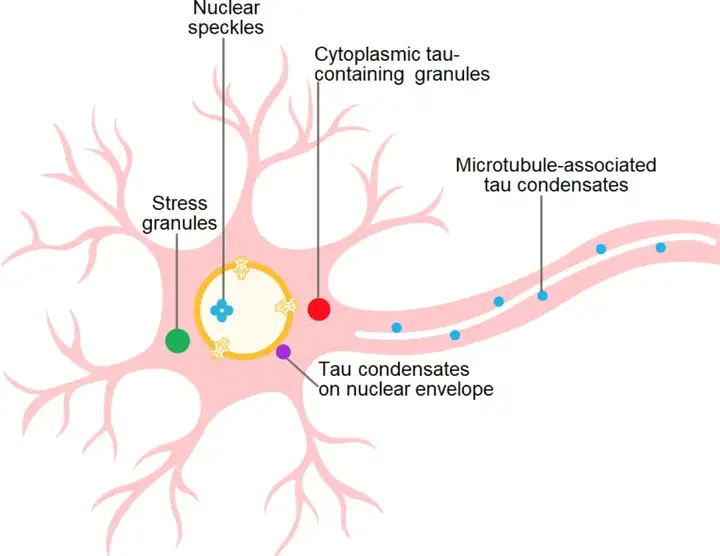
许多神经退行性疾病的共同特征是一种或几种关键蛋白质的错误折叠聚集体,错误折叠的蛋白质形成称为淀粉样蛋白的内含物。最常见的神经退行性疾病是阿尔茨海默病(AD),约占老年性痴呆病例的60%,预计到2050年将影响约1.5亿人。自从近四十年前对与AD NFT相关的tau蛋白进行免疫组织化学检测,并确认tau是组成成对螺旋丝(PHFs)的主要成分以来,tau包涵体已在数十种神经退行性疾病中得到进一步鉴定,比任何其他淀粉样蛋白都多。
近年来,人们越来越有兴趣了解tau聚集是否也与LLPS相关。对LLPS和淀粉样蛋白原纤维之间关系的见解最初来自对FUS和TDP-43的研究,这两种RNA结合蛋白在FTD和ALS中形成包涵体。目前对神经元中tau蛋白的LLPS研究仍处于早期阶段,但这些研究已经清楚地表明了tau在不同细胞区室中发生凝结的能力(图5)。多种tau构建体和细胞类型已被用于证明细胞环境中的tau蛋白LLPS;结合体外tau凝聚的充分证据,LLPS可能是tau蛋白的进化特征,其生理作用可能与微管调节有关(Zheng et al., 2024)。
03罕见遗传病中的相分离
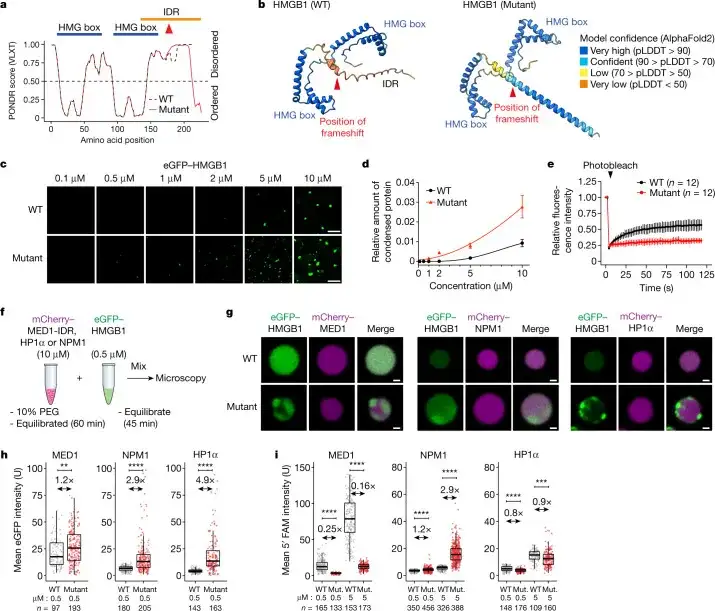
2023年2月8日,德国马克斯·普朗克分子遗传学研究所和柏林夏里特医学院的研究人员在Nature发表的题为“Aberrant phase separation and nucleolar dysfunction in rare genetic diseases”研究性论文,引发了罕见病研究领域的讨论热潮。在全球已知的10名短指、多指和胫骨发育不育/发育不全综合征(BPTA)患者中,该研究收集了5名患者信息,研究发现,患者的HMGB1基因几乎存在着相同的基因突变,这是一种移码突变,导致了HMGB1蛋白中原本的无序区酸性尾被富含精氨酸的碱性尾所取代。从而影响了HMGB1蛋白的相分离,增强了其错误进入细胞核核仁的能力,导致核仁功能障碍,最终导致机体发育紊乱,揭示了一种罕见遗传病的发病机制。
小医叨叨
在过去的十年中,尽管LLPS的研究取得了一些突破,但对LLPS的理解仍处于起步阶段。越来越多的问题也出现了。例如,细胞内不同凝聚物特性调节的机制是什么?疾病相关突变或PTM如何调节凝聚物的物理性质?如何调节体内LLPS以达到预期疗效?虽然FRAP被广泛用于证明LLPS的发生过程。然而,必须指出的是,在不同的研究中,同一分子的FRAP回收时间率可以从不到一分钟到几分钟不等,这表明FRAP并不是确认LLPS的金标准;并且,由于分子相分离的条件与生理条件有很大差异,体外实验的结论与细胞中的真实相分离条件或功能存在差异,因此,目前也仍需开发更多的定量工具或方法并将其应用于LLPS研究。
参考文献
Banani S F, Lee H O, Hyman A A, et al. Biomolecular condensates: organizers of cellular biochemistry[J].Nature reviews Molecular cell biology, 2017, 18(5): 285-298.
Brangwynne C P, Eckmann C R, Courson D S, et al. Germline P granules are liquid droplets that localize by controlled dissolution/condensation[J].Science, 2009, 324(5935): 1729-1732.
Boyko S, Surewicz WK. Tau liquid-liquid phase separation in neurodegenerative diseases.Trends in cell biology,2022;32(7):611-623.
Gui X, Feng S, Li Z, et al. Liquid-liquid phase separation of amyloid-β oligomers modulates amyloid fibrils formation[J].The Journal of biological chemistry, 2023;299(3):102926.
Mensah MA, Niskanen H, Magalhaes AP, et al. Aberrant phase separation and nucleolar dysfunction in rare genetic diseases[J].Nature, 2023;614(7948):564-571.
Muzzopappa F, Hummert J, Anfossi M, et al. Detecting and quantifying liquid–liquid phase separation in living cells by model-free calibrated half-bleaching[J].Nature Communications, 2022, 13(1): 7787.
Tong X, Tang R, Xu J, et al. Liquid–liquid phase separation in tumor biology[J].Signal Transduction and Targeted Therapy, 2022;7(1):221.
Wang B, Zhang L, Dai T, et al. Liquid–liquid phase separation in human health and diseases[J].Signal Transduction and Targeted Therapy, 2021, 6(1): 290.
Zheng H, Sun H, Cai Q, et al. The Enigma of Tau Protein Aggregation: Mechanistic Insights and Future Challenges[J].International journal of molecular sciences, 2024;25(9):4969.

