背景介绍
流式细胞术(Flow Cytometry,FCM)是一种高效的用于单细胞分析/分选的生物学技术,其集细胞生物化学技术、单克隆抗体技术、激光技术、流体力学、电子技术、计算机技术、分子生物学、临床医学等理论于一体。FCM能够对大量的细胞或非细胞颗粒的物理、生理、生化、免疫、遗传、分子生物学性状及功能状态等进行定性或定量检测。现代流式细胞仪自问世以来,已历经了40多年的发展,其被广泛用于从基础研究到临床实践的各个方面,如:分子生物学、细胞生物学、遗传学、免疫学、肿瘤学、血液学、药理学、植物学及临床医学等众多领域,在生物学研究领域中发挥不可或缺的作用。FCM具有高通量、多参数、速度快,采集数据量大、操作灵活等优点。下面就和小医一起来了解下流式细胞术的详细实验应用及操作方法吧!
细胞凋亡检测
细胞凋亡(Apoptosis)是细胞的一种程序性死亡,是生物体中普遍存在的现象。细胞凋亡过程中细胞核染色质的形态学改变可分为:凋亡Ⅰ期(pro-apoptosis nuclei),细胞核内染色质高度盘绕,出现许多称为气穴现象(cavitations)的空泡结构;凋亡Ⅱ期,细胞核内染色质高度凝聚、边缘化;凋亡Ⅲ期,细胞核裂解为碎块,产生凋亡小体。凋亡细胞体积变小,细胞质浓缩(图1)。
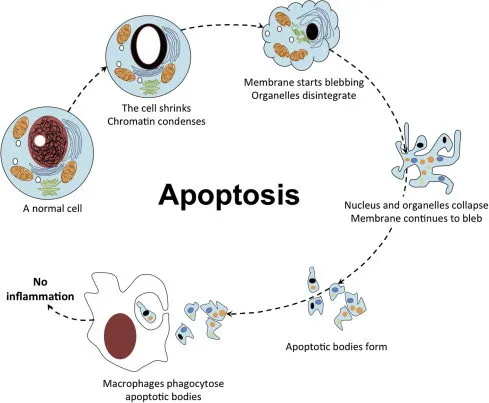
图1 细胞凋亡过程示意图(Abou-Ghali M, Stiban J., 2015)。
在正常细胞中,磷脂酰丝氨酸(Phosphatidylserine,PS)分布于细胞膜脂质双层的内侧,但在细胞发生凋亡早期,膜PS由脂膜内侧翻向外侧,暴露在细胞外环境中。Annexin V是一种分子量为35~36KDa的Ca2+依赖性磷脂结合蛋白,可与PS高度亲和并特异性结合,被作为检测细胞早期凋亡的灵敏指标之一。但Annexin V无法区分坏死细胞(中晚期凋亡细胞)和早期凋亡细胞。碘化丙啶(Propidium Iodide,PI)是一种核酸染料,不能透过完整细胞膜,但由于凋亡中晚期细胞和死细胞的细胞膜通透性增加,PI能够透过细胞膜而使细胞核染红。早期凋亡细胞和活细胞的细胞膜仍然完整,PI无法进入凋亡细胞。
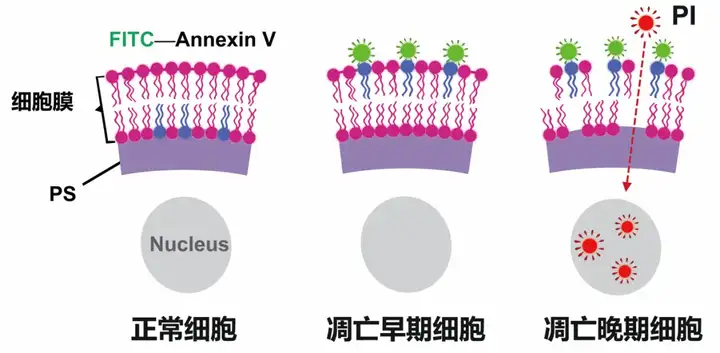
图2 Annexin V/PI检测原理
将Annexin V与PI联合使用,即可将处于不同凋亡时期的细胞区分开来:活细胞(Annexin V-/PI-)、早期凋亡细胞(Annexin V+/PI-)、晚期凋亡细胞和坏死细胞同时被Annexin V和PI结合染色呈现双阳性(Annexin V+/PI+),坏死细胞或机械性损伤细胞(Annexin V-/PI+),详见图3。
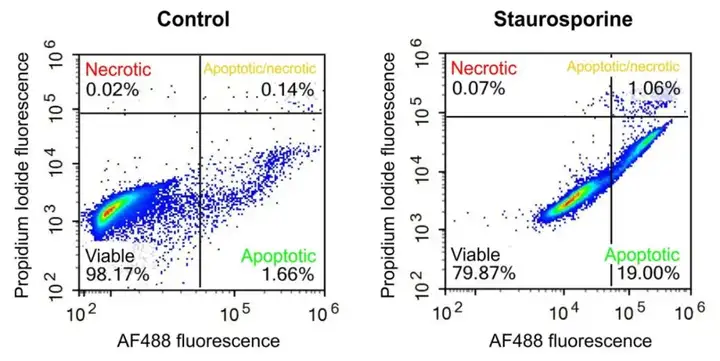
图3 流式细胞术检测细胞凋亡结果解读(源自:Lumiprobe)。
更多细胞凋亡检测方法及操作要点详见“常用细胞凋亡检测方法详细内容大公开”及“细胞凋亡检测竟然有这么多种方法?建议点赞收藏!”文章。
细胞周期检测
细胞周期是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,在真核生物中,细胞周期分为处于阻留状态的G0期、分裂间期、分裂期(M期),其中,分裂间期又分为DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期)。PI染色法是较常见的一种周期检测方法,PI可嵌合到双链DNA和RNA碱基对中并与之结合,当其与双链DNA结合后可产生荧光,其荧光强度与DNA含量成正比。由于细胞周期各时期DNA含量不同,因此,通过流式细胞仪结合PI染色法对细胞内DNA含量进行检测,可将细胞周期各时期区分为G1/G0期、S期和G2/M期,同时获得流式直方图对应各细胞周期(图4)。
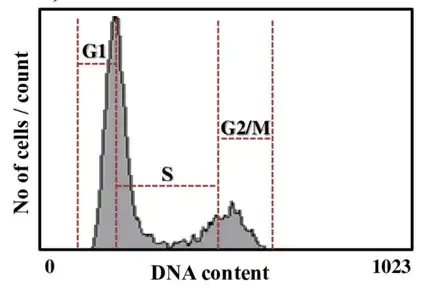
图4 流式细胞术分析细胞周期示意图(Kamal K Y., 2014)。
ROS与线粒体膜电位检测
关于细胞活性氧(Reactive Oxygen Species,ROS)检测详细介绍可参见“活性氧ROS检测攻略大全”一文。流式细胞仪检测ROS是通过荧光染料或荧光探针标记细胞后,直接观察细胞荧光信号变化的一种方法,其中,使用最广泛的荧光探针是2,7-二氯荧光素二乙酸酯(DCFH-DA),我司使用的也是此种方法。该方法的检测原理是:DCFH-DA本身没有荧光,可自由穿过细胞膜,进入细胞内后,可被细胞内的酯酶水解生成DCFH,DCFH不会穿过细胞膜,因此积聚在细胞内。细胞内的ROS能够氧化无荧光的DCFH生成有荧光的DCF,其荧光强度与ROS水平成正比(图5)。该荧光可在流式细胞仪相应通道被检测到(常见为FL1通道)(图6)。
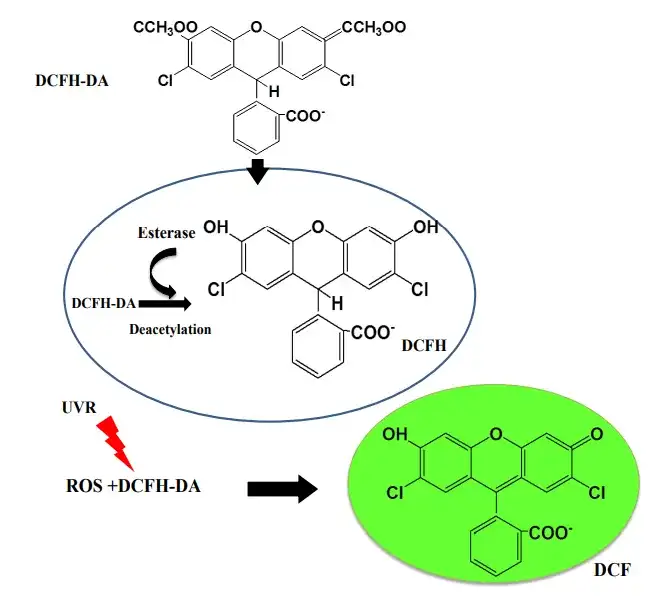
图5 DCFH-DA探针在细胞内的作用机制(Rajneesh et al., 2017)。
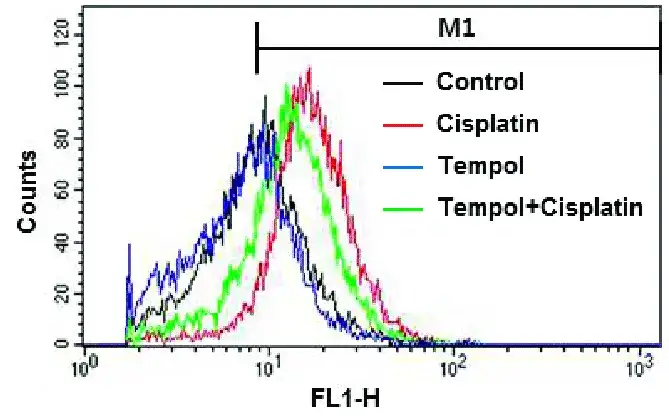
图6 通过流式细胞术测定细胞内ROS水平(Youn et al., 2016)。
线粒体是动植物细胞生成ATP的主要地点,是促进细胞能量转换、参与细胞凋亡的重要细胞器。线粒体在呼吸氧化过程中,将所产生的能量以电化学势能储存于线粒体内膜,在内膜两侧造成质子及其他离子浓度的不对称分布而形成线粒体膜电位(Mitochondrial membrane potential,MMP,ΔΨm)。关于MMP的详细介绍可参见“线粒体膜电位检测”一文。目前评估线粒体功能时,常使用线粒体膜电位荧光探针鉴定。其中,JC-1是一种广泛用于检测线粒体膜电位的理想荧光探针,也是我司经常使用的方法。JC-1在健康细胞中,大多数为红色荧光,可能出现少量绿色荧光,而线粒体去极化的细胞大多仅显示绿色荧光,流式细胞仪可通过收集荧光信号,并将荧光强度进行可视化展示(图7)。
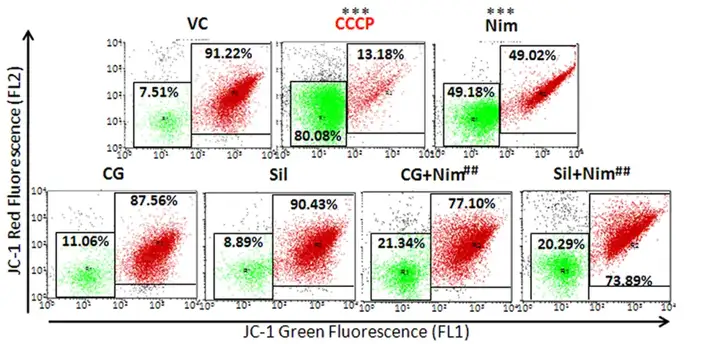
图7 流式细胞仪评估JC-1染色后线粒体膜电位结果差异(Singh et al., 2012)。
细胞表型鉴定与分选
众所周知,由造血干细胞分化而来的免疫细胞复杂而多样,科学家们依据其特点将其分为固有免疫细胞与适应性免疫细胞两大类,其中适应性免疫细胞又包括T细胞、B细胞,而T细胞又包含多种亚型,如辅助性T细胞(常见Th1、Th2、Th17、Treg等亚型)、杀伤性T细胞等;固有免疫细胞同样种类繁多,如固有样淋巴细胞、单核细胞、巨噬细胞、粒细胞、树突状细胞(DC细胞)、自然杀伤细胞(NK细胞)等等(图8)。
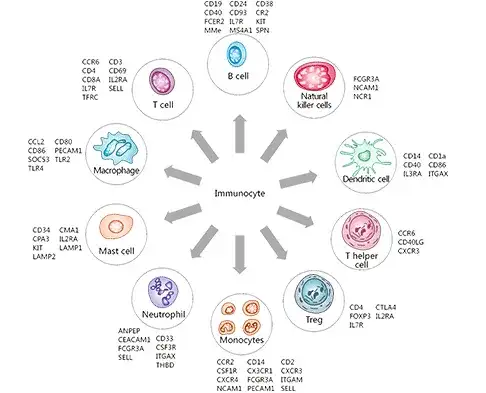
图8 常见免疫细胞类型及其标志物(源自CUSABIO)。
如何区分鉴定并分选出特定亚型的免疫细胞曾一度成为科研工作者亟待解决的问题,随着抗体技术与流式细胞术的发展,研究者发现流式细胞术可通过使用特定的抗体探针标记细胞表面蛋白,对细胞表型进行定量和定性分析,主要应用于研究免疫细胞的分布、表达和功能。如T细胞、B细胞、DC细胞、粒细胞。单核细胞、NK细胞、巨噬细胞等。随着流式细胞仪的不断更新,如今流式细胞仪不仅可完成免疫细胞的谱系标记(大多数免疫细胞具有特定的系列特异性CD标记,即谱系标记物,如T细胞标志物CD3、CD4、CD8,B细胞标志物CD19、CD20等),还可用于表征每个细胞群的功能(如CD69、CD25、CCR5、CCR6、CXCR4等)。流式细胞术不仅适用于上述表面标志物,其亦可适用于胞内标志物(如FoxP3定义Treg细胞,IFN-γ、TNF-α、IL-2定义TH1细胞等)(图9)。部分仪器还可将标记后的细胞进行分选,以便后续培养不同亚型的免疫细胞。
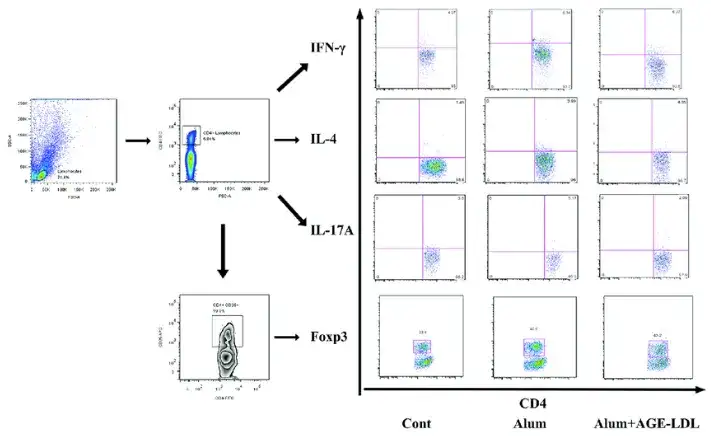
图9 流式细胞检测免疫细胞表型(Lin et al., 2011)。
其他生物学相关检测
除此之外,流式细胞术还可用于细胞增殖/活性鉴定(如:CFDA、CFSE、FDA等荧光标记),离子通道检测(如常见的Ca2+通道检测),氢乙啶或二乙酸二氯荧光素标记后的细胞因子鉴定,蛋白质工程,细菌分选,生物制剂等场景,由于篇幅有限,此篇文章仅以流式细胞术常见的几种应用进行讲解,感兴趣的读者可自行查阅流式细胞术在其他生物学方向的应用及其案例。
对照设定
关于对照的设定,一般流式细胞术的对照可分为5大类:仪器对照、补偿对照、实验对照、设门对照以及特异性染色体对照,其中仪器对照即检测仪器是否正常工作,其余对照需实验者依据自身实验进行设置,设置原则如下:
1、补偿对照:当荧光染料之间的发射光谱重叠时,校正溢漏的过程被称为补偿,调整补偿时,需制备每种荧光染料的单染样品,并遵守基本原则:① 补对照的亮度与实验样品相同或更高;② 补偿荧光染料与实验荧光染料完全匹配;③ 任何对照的阴阳性群体自发荧光相同;④ 细胞收集数量>5000。
2、实验对照:与其他生物学实验一致,流式细胞术实验对照亦包含阴性对照(提供所有待测标志物的表达背景)、阳性对照(证实抗体/染色剂在相关细胞中的阳性染色),此外还需设置纵向对照或参考对照(确保实验过程中的染色一致性)。
3、设门对照:在分析流式细胞术的数据时,最关键的一步就是正确设门。当细胞群体无法清晰界定或比较稀少时,需要荧光减一对照(FluorescenceMinus One,FMO)来解释流式数据并准确设门。设门时检测细胞DNA、RNA、总蛋白等含量时,选择线性放大;检测细胞表面抗原时,选择对数放大。流式的圈门方式多种多样,十字门(凋亡检测常见)、圆形门、矩形门、不规则门等等,因此,通常画门时可“随形而圈”,更多的画门技巧,小医将在后续文章中进行详细介绍哟!
4、特异性染色体对照:抗体与细胞结合有三种基本形式:a.Fab区域与抗原结合(理想情况)b.Fc区域与Fc受体结合(通常不想要)c.非特异性结合(脱靶抗原、“粘”住细胞膜等)在各种流式细胞术分析中,避免非特异性结合的最佳方法有:a.正确滴定所有的试剂b.封闭细胞的Fc受体c.加入一种细胞活性染料以排除死细胞。
参考文献
Abou-Ghali M, Stiban J. Regulation of ceramide channel formation and disassembly: Insights on the initiation of apoptosis[J]. Saudi journal of biological sciences, 2015, 22(6): 760-772.
Kamal K Y. Alterations induced by gravity changes in proliferaing culture cells of Arabidopsis thaliana[D]. PhD Thesis, Universidad Complutense de Madrid, Spain, 2014.
Lin Z, Liang C, Zhiqing H, et al. Vaccination against AGE-LDL significant attenuates atherosclerosis in diabetic apoe mice[J]. Heart, 2011, 97(Suppl 3): A18-A18.
Rajneesh, Pathak J, Chatterjee A, et al. Detection of Reactive Oxygen Species (ROS) in Cyanobacteria Using the Oxidant-sensing Probe 2′,7′-Dichlorodihydrofluorescein Diacetate (DCFH-DA)[J]. Bio-Protocol, 2017, 7:2545.
Singh B K, Tripathi M, Chaudhari B P, et al. Natural terpenes prevent mitochondrial dysfunction, oxidative stress and release of apoptotic proteins during nimesulide-hepatotoxicity in rats[J]. PloS one, 2012, 7(4): e34200.
Youn C K, Kim J, Jo E R, et al. Protective effect of tempol against cisplatin-induced ototoxicity[J]. International journal of molecular sciences, 2016, 17(11): 1931.

