可变剪接(Alternative Splicing)是基因表达调控的一个关键过程,在这一过程中,一个基因的不同剪接形式可以产生多种不同的蛋白质变体。这种机制极大地增加了蛋白质的多样性,使得一个基因能够参与多种细胞功能和生理过程。许多疾病包括癌症、神经退行性疾病、心血管疾病和免疫系统疾病,都与异常的可变剪接模式相关联。特定的剪接变体可以作为某些疾病的生物标志物,用于早期诊断或疾病进展的监测。可变剪接为药物开发提供了新靶点,通过设计药物来调节异常的剪接过程,可以恢复正常的蛋白质功能,从而治疗疾病。因此,研究Pre-mRNA可变剪接具有重要意义。
01真核生物Pre-mRNA剪接过程
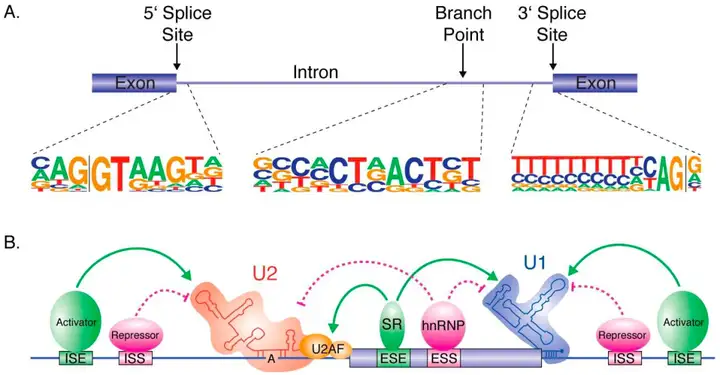
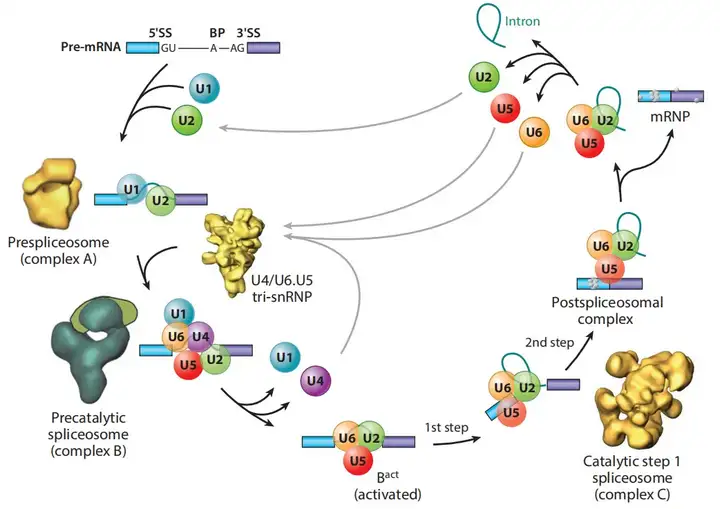
真核生物的基因通常是由多个外显子(编码区)和内含子(非编码区)交替组成。剪接过程是由一种高分子量的剪接体介导完成的。剪接体是由U1、U2、U4、U5和U6五种小核糖核酸蛋白(Small nuclear ribonucleoprotein, snRNPs)和多种非snRNP蛋白质组成的一种复合体。snRNPs和其他复合体蛋白质相互作用,形成功能复杂的结构,确保剪接体能够正确地定位和识别剪接位点,完成剪接过程。
Pre-mRNA剪接的过程如下:
(1)U1 snRNP的识别:U1 snRNP与Pre-mRNA的5’端外显子结合,并以ATP依赖性方式识别5’剪接位点。在这一过程中丝氨酸/精氨酸富集蛋白(Serine/Arginine-rich proteins, SR蛋白)与异质核核糖核蛋白(Heterogeneous nuclear ribonucleoproteins, hnRNPs)相互作用,SR蛋白识别并结合在外显子剪接增强子(Exonic splicing enhancer, ESE)上促进U1 snRNP识别5’剪接位点,而hnRNPs识别并结合在外显子剪接沉默子(Exonic splicing silencer, ESS)上阻碍U1 snRNP识别5’剪接位点。
(2)U2 snRNP的结合:U2 snRNP结合到内含子的分支位点形成剪接体前体。这是剪接的关键步骤,导致内含子的分离。
(3)U4/U5/U6 snRNP的组装:U4/U5/U6 snRNP与剪接体前体复合物相互作用组装成完整的剪接体。
(4)剪接体的催化活化:剪接体的催化活化通过两步酯交换反应完成。U2 snRNP招募十九号复合物(Nineteen Complex, NTC)和十九号复合物相关蛋白(Nineteen-Related Complex, NTR),进而释放U1和U4,然后打破剪接位点处的磷酸二酯键,产生两个相邻的外显子以及一个套索结构的内含子。
(5)剪接体的解除和剪接完成:内含子和snRNPs从剪接体复合物中释放出来,5’方向上的外显子攻击套索结构,去除内含子,并将相邻外显子连接起来完成剪接,最终生成成熟的mRNA。
另外,lncRNA可通过与剪接体相互作用从而影响Pre-mRNA剪接,具体机制介绍详见“非编码RNA与可变剪接的相互作用”。
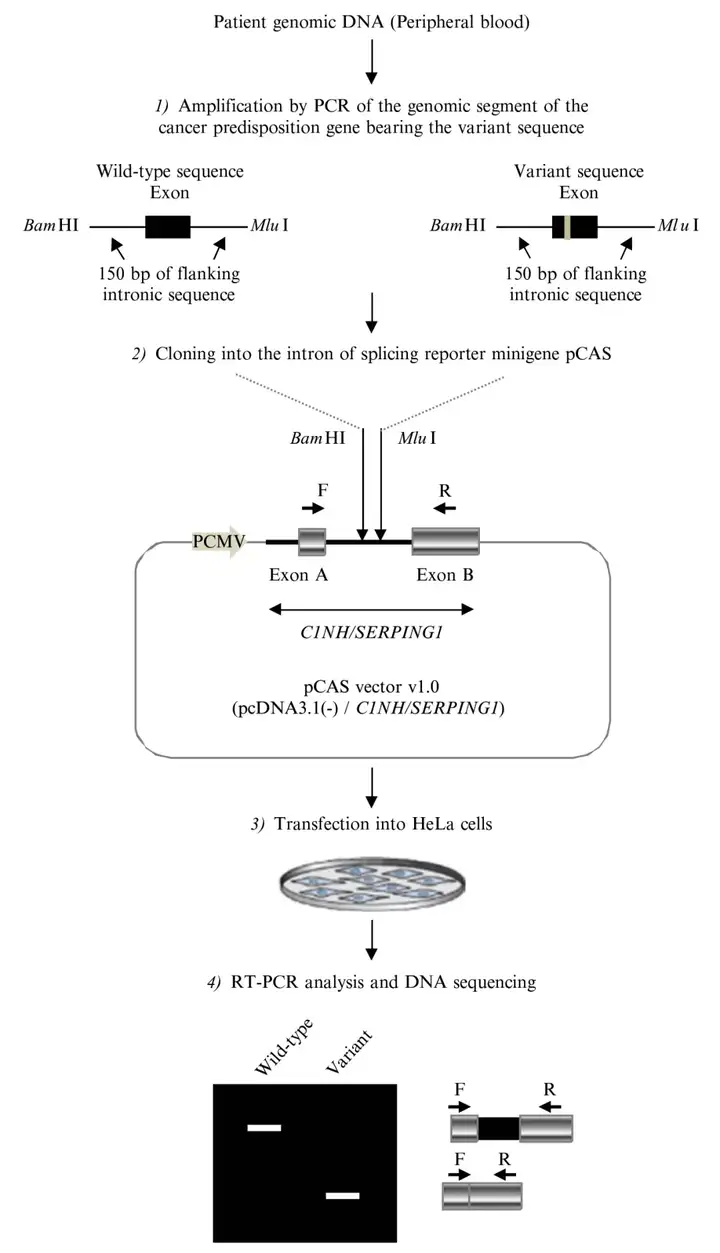
02minigene实验原理及流程
minigene实验是一种用于研究基因Pre-mRNA剪接变异机制的重要工具。这种实验方法是构建一个包含基因特定区域的小型基因(minigene),通常包括外显子、内含子和必要的剪接信号,然后将其插入到一个载体中,并转入细胞中进行表达。通过构建不同的minigene剪接变异体,研究者可以探究特定序列如何影响剪接过程,包括剪接信号的识别、剪接复合物的组装等。minigene的主要实验流程如下:
(1)根据基因的突变位点,生信分析可能引起的发生剪接变化;
(2)在突变位点区域序列(含有连续的几个外显子和内含子)构建minigene-mut质粒和minigene-WT质粒;
(2)minigene载体转染细胞;
(3)RT-PCR检测或测序分析剪接变化情况。
03minigene案例分享
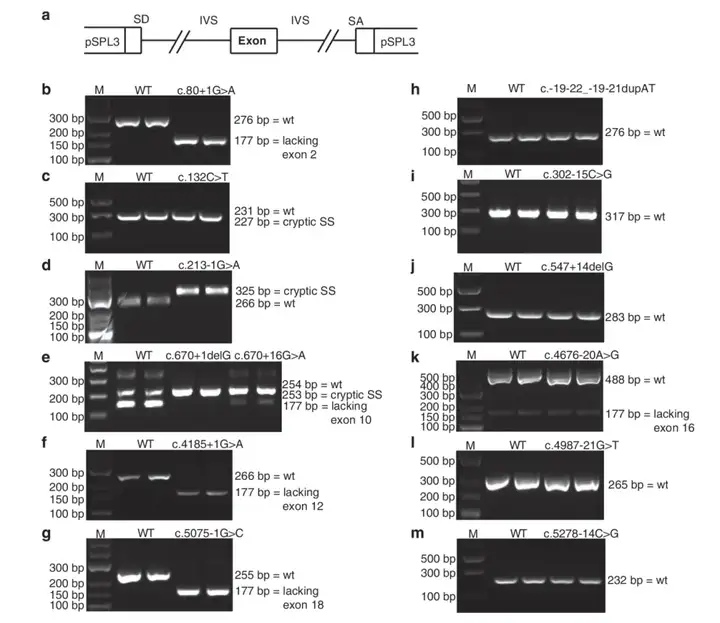
BRCA1基因位点突变导致Pre-mRNA剪接改变,会增加乳腺癌和卵巢癌的得病风险,BRCA1基因的剪接变体也是许多癌症的生物标志物。因此对于BRCA1基因剪接变异研究和筛查十分重要。Steffensen等人用BRCA1基因序列构建了野生型minigene-WT质粒以及13种突变型minigene-mut质粒,13种突变位点为:c.80+1G>A,c.132C>T,c.213-1G>A,c.670+1delG,c.670+16G>A,c.4185+1G>A,c.5075-1G>C,c.-19-22_19-21dupAT,c.302-15C>G,c.547+14delG,c.4676-20A>G,c.4987-21G>T,c.5278-14C>G。野生型WT质粒和突变型mut质粒分别转染COS-7细胞,然后进行RT-PCR及琼脂糖凝胶电泳分析条带。可以看到c.80+1G>A,c.132C>T,c.213-1G>A,c.670+1delG,c.670+16G>A,c.4185+1G>A,c.5075-1G>C,c.4676-20A>G产生了Pre-mRNA剪接的改变(可见凝胶电泳图),而突变型c.-19-22_19-21dupAT,c.302-15C>G,c.547+14delG,c.4987-21G>T,c.5278-14C>G未发生Pre-mRNA剪接变化。
伯远医学拥有一流的技术团队、丰富的项目经验,提供专业minigene技术服务,适用于Pre-mRNA可变剪接的领域研究,欢迎大家前来咨询minigene实验。
参考文献
Blencowe B J. Alternative splicing: new insights from global analyses[J]. Cell, 2006, 126(1): 37-47.
Gaildrat P, Killian A, Martins A, et al. Use of splicing reporter minigene assay to evaluate the effect on splicing of unclassified genetic variants[J]. Cancer susceptibility: methods and protocols, 2010: 249-257.
Lee Y, Rio D C. Mechanisms and regulation of alternative pre-mRNA splicing[J]. Annual review of biochemistry, 2015, 84(1): 291-323.
McManus C J, Graveley B R. RNA structure and the mechanisms of alternative splicing[J]. Current opinion in genetics & development, 2011, 21(4): 373-379.
Steffensen A Y, Dandanell M, Jønson L, et al. Functional characterization of BRCA1 gene variants by mini-gene splicing assay[J]. European Journal of Human Genetics, 2014, 22(12): 1362-1368.

