表观遗传学是近年来的热门项目,是指在核苷酸序列不变的前提下,引起可遗传的基因表达或细胞表型变化的机制。这些变化可以通过细胞分裂而得以保留。表观遗传学的主要作用途径包含染色质重塑、DNA甲基化、组蛋白修饰、RNA甲基化、非编码RNA(ncRNA)调控等,是重要的基因表达调控方式之一。通过特定分子生物学技术和高通量测序结合,对表观遗传修饰的分布及生物学变化等进行研究可以极大地降低筛选下游分子靶标的难度。
组蛋白修饰是基因表达表观调控中最为重要和多样的调控方式,它作用于几乎所有的生物过程,如转录激活/失活、染色体包装和 DNA 损伤/修复等。常用于组学分析的一些核心组蛋白修饰包括:H3K4me1、H3K27ac、H3K27me3等。目前组学技术已经逐渐成为组蛋白修饰主要的研究方式,今天带来一篇利用CUT&Tag发现新的H3K36me3催化酶的文章。

发表期刊:Nature Communications
影响因子:17.694
发表时间:2022
研究背景
组蛋白修饰中研究较多的H3K36三甲基化(H3K36me3)可以参与多种细胞活动的调节,并且与DNA损伤、RNA剪切、RNA m6A修饰等有关。由于H3K36me3在细胞过程中的多种作用,该组蛋白修饰的失调在许多人类疾病中被发现,特别是肾细胞癌(Wagner et al., 2012)。之前的研究表明,H3K36me3主要分布在活跃基因的gene body(基因体)区,并且从基因的5’端向3’端逐渐增加(Bannister et al., 2005)。在哺乳动物细胞中,H3K36me3主要由基因体区域的SETD2进行催化(Hu et al., 2010)。此外,减数分裂特异性组蛋白甲基转移酶PRDM9同样可以催化睾丸中的H3K4me3和H3K36me3(Powers et al., 2016)。本文作者研究发现,除了基因体区域外,H3K36me3同样富集在哺乳动物细胞的启动子处,并且确定SMYD5为启动子处的H3K36me3甲基转移酶,调节基因表达,为H3K36me3的定位和功能提供新的思路(Zhang et al., 2022)。
研究方法
CUT&Tag是基于NGS的在ChIP-seq和CUT&RUN 基础上进一步优化的新方法。它能在全基因组范围内检测与目的蛋白互作的DNA片段,从而研究组蛋白修饰和转录因子在基因组上的结合位置,属于新一代超微量ChIP-seq技术。该技术主要使用 protein-A-Tn5(pA-Tn5)转座体融合蛋白的连接方法,将Protein A/G与Tn5转座酶进行融合,使得与抗体结合的同时,Tn5切割核小体上缠绕的DNA片段,获得目的序列。由于未对细胞核和染色质进行物理性的破坏,整个操作过程相当“温和”,因此CUT&Tag 的背景噪音数据非常少,且可使细胞内染色体尽可能在自然状态下被标记。作者通过该技术分析了H3K36me3在未交联细胞中的分布情况,首次发现H3K36me3组蛋白也在基因启动子处有富集,对于这一新的发现继续利用Native ChIP-seq进行了验证。后续利用多个组蛋白修饰酶的批量筛选敲除实验,鉴定出 SMYD5是启动子处催化H3K36me3的甲基转移酶,它被RNA聚合酶II(Pol II)招募到染色质,并且通过一些体外体内实验对结果进行了验证。
研究思路
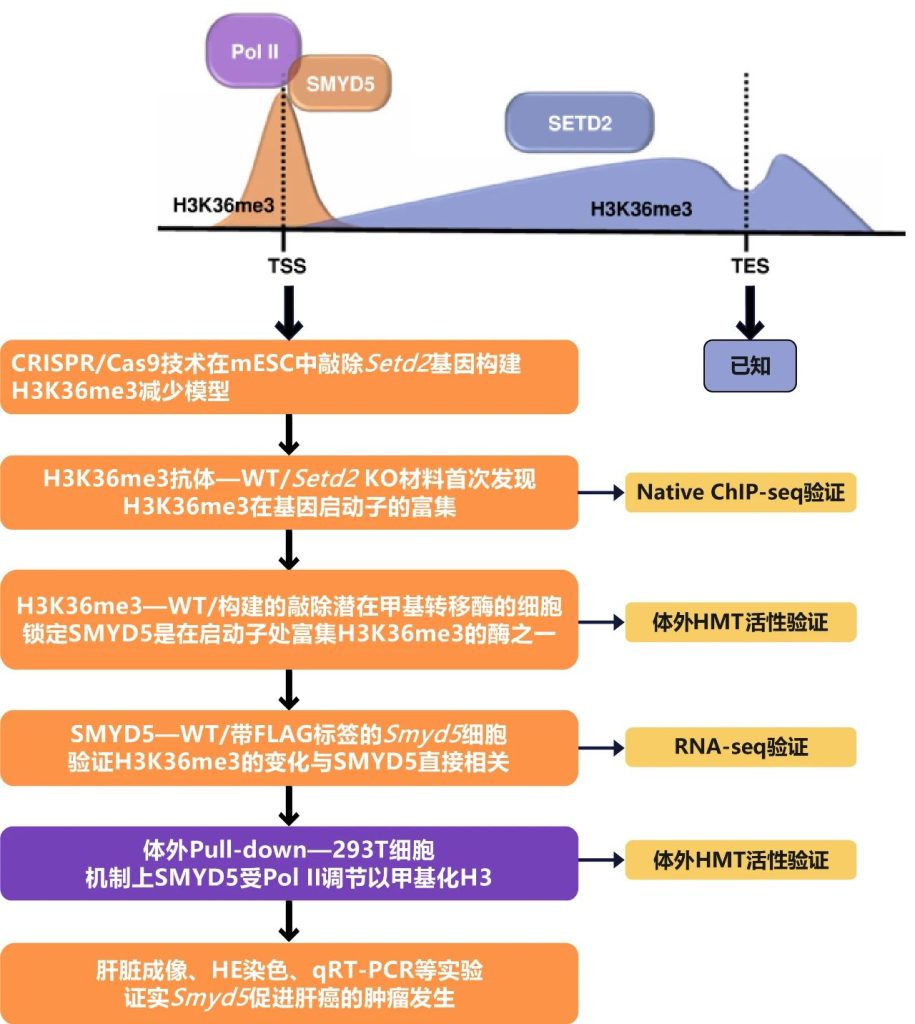
研究结果
01.H3K36me3在启动子处富集
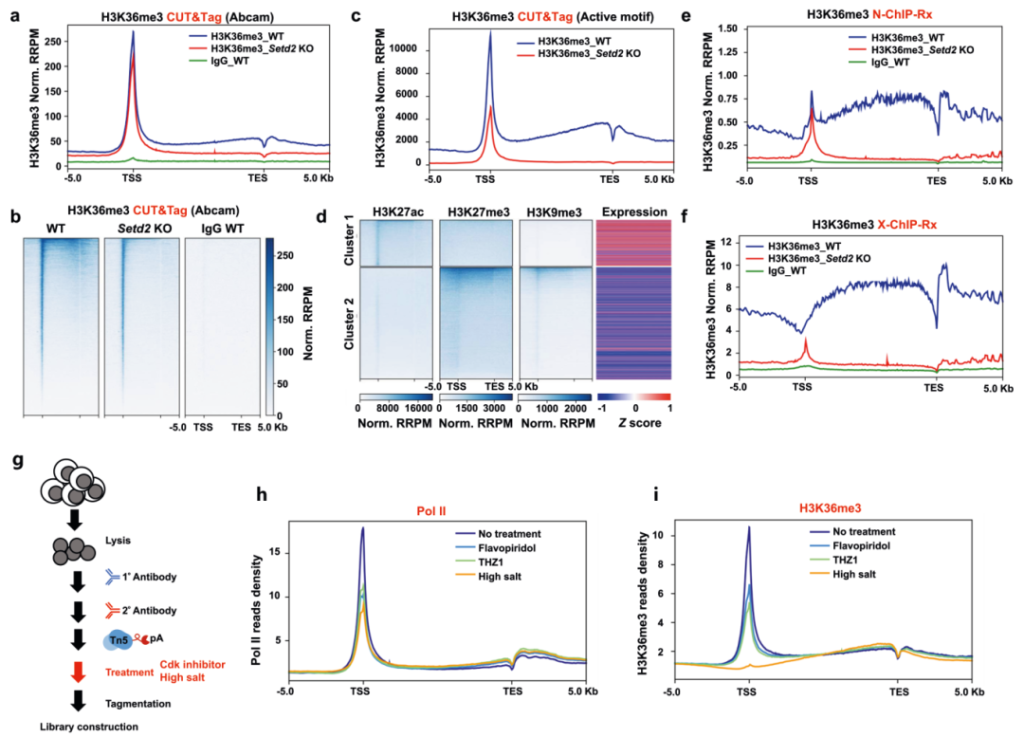
作者首先采用CRISPR/Cas9技术在小鼠胚胎干细胞(mESC)中敲除了Setd2基因,Western blotting检测验证Setd2 KO mESC中H3K36me3组蛋白修饰大部分被消除。然后通过CUT&Tag来分析H3K36me3在野生型(WT)和Setd2 KO细胞中的分布。结果显示正如之前报道的,在WT细胞中通过NCBI RefSeq鉴定的基因中,H3K36me3水平显示从转录起始位点(TSS)到转录终止位点(TES)的连续增加。当Setd2被敲除时,基因体区域的H3K36me3富集基本上被消除。但是作者还发现在WT和Setd2 KO细胞的启动子处存在H3K36me3的强烈富集,Setd2的缺陷导致启动子处的H3K36me3略有减少,并未完全去除(图1a-c)。在排除所用抗体非特异性结合、过度标准化以及Tn5转座体随机靶向开放染色质区域的可能性后作者还通过在WT和Setd2 KO细胞中进行Native ChIP-seq进一步证实了启动子处存在不依赖于SETD2的H3K36me3富集(图1d-f)。但是当细胞交联和超声处理后,这种富集的H3K36me3不稳定,无法从染色质快速释放。CDK抑制剂或高浓度盐处理结果表明H3K36me3在天然细胞的启动子处的富集是受到Pol II的调节(图1g-i)。
02.SMYD5催化H3K36me3
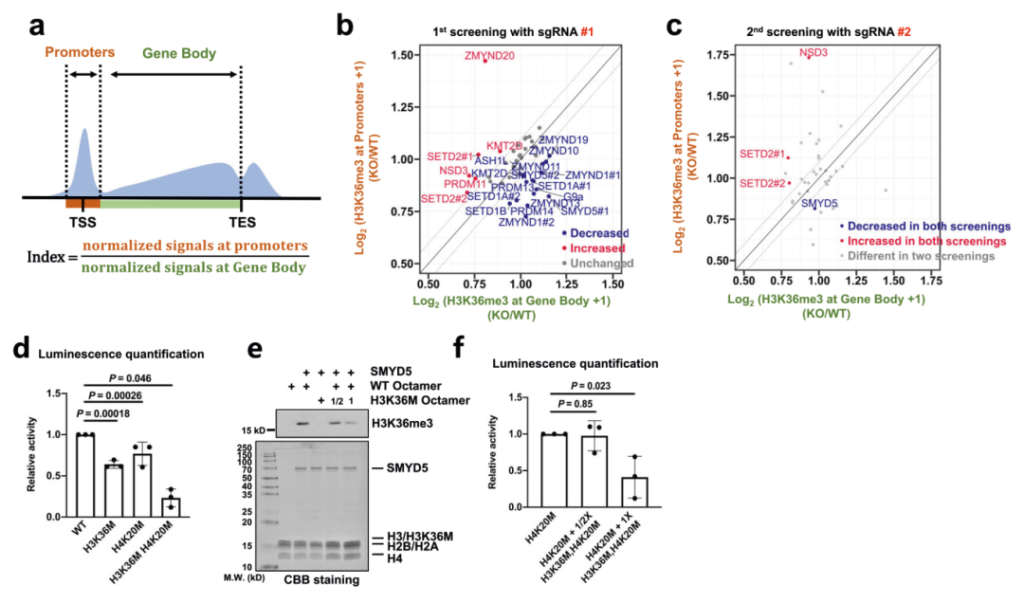
接下来为了确定是哪种甲基转移酶负责启动子处H3K36me3的富集,作者通过对多种候选蛋白的大规模敲除筛选实验,对建立的敲除潜在甲基转移酶的细胞系进行H3K36me3 CUT&Tag以直接分析启动子处H3K36me3的变化,在选择的37个候选基因中最终鉴定到SMYD5是负责在启动子处富集H3K36me3的酶之一(图2a-c)。为了进一步证实SMYD5是否可以甲基化H3K36,作者通过体外组蛋白甲基转移酶(HMT)测定实验测试了SMYD5的酶活性,证实SMYD5对H3K36和H4K20位点表现出酶活性,双突变八聚体会抑制SMYD5的甲基转移酶活性(图2d-f)。
03.SMYD5在启动子处富集,可调节H3K36me3和基因表达
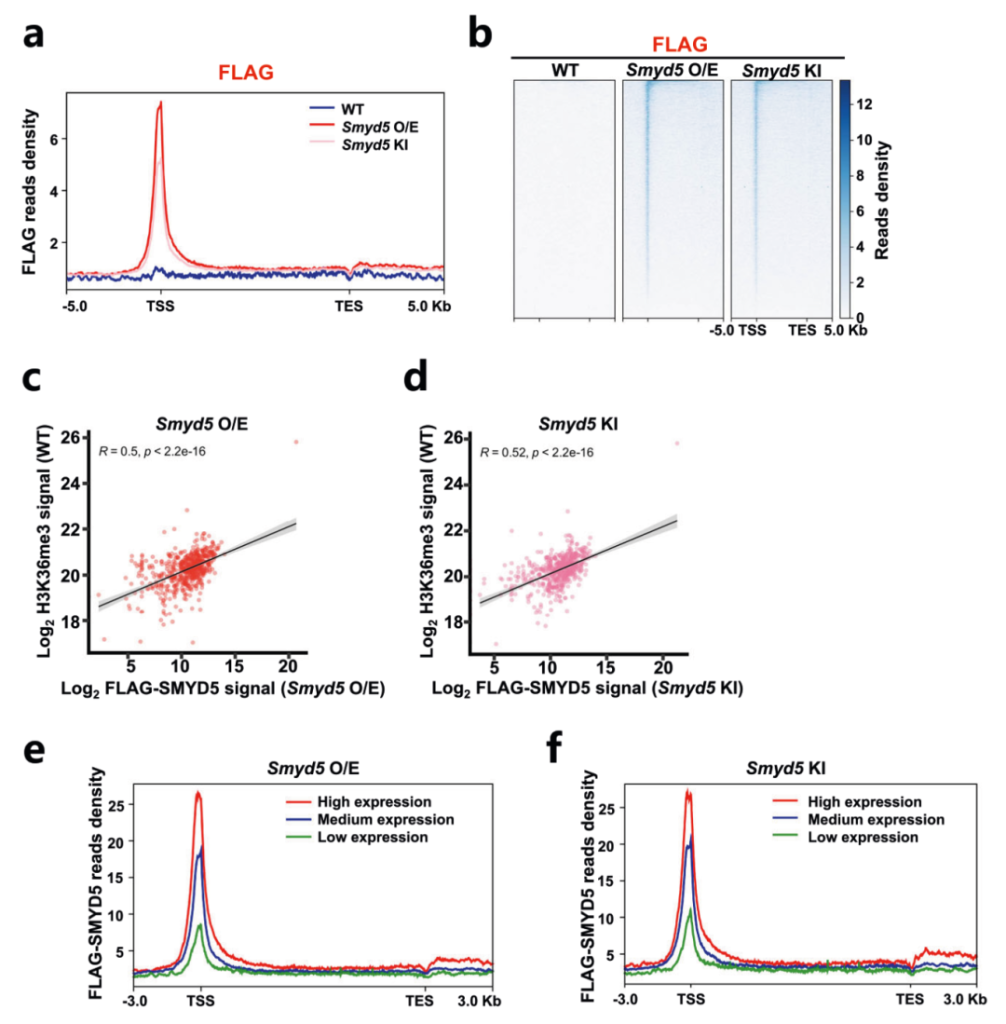
为了具体分析SMYD5如何定位在染色质上,作者过表达了带有FLAG标签的Smyd5,并在内源Smyd5序列的N末端加入FLAG标签,进行FLAG CUT&Tag来分析SMYD5在染色质上的分布。结果显示外源(Smyd5 O/E)和内源(Smyd5 KI)表达的SMYD5在启动子处富集(图3a-b)。并且观察到启动子处的SMYD5和H3K36me3信号之间存在很强的正相关性(R=0.5)(图3c-d),表明H3K36me3的变化与Smyd5直接相关。作者进一步通过RNA-seq比较了三种细胞系的基因表达谱,将基因分为高、中和低表达组,发现在SMYD5过表达细胞和FLAG标签敲入细胞中,检测到的SMYD5信号在活跃转录基因中高度富集(图3e-f)。
04. Pol II与SMYD5相互作用并调节其酶活性
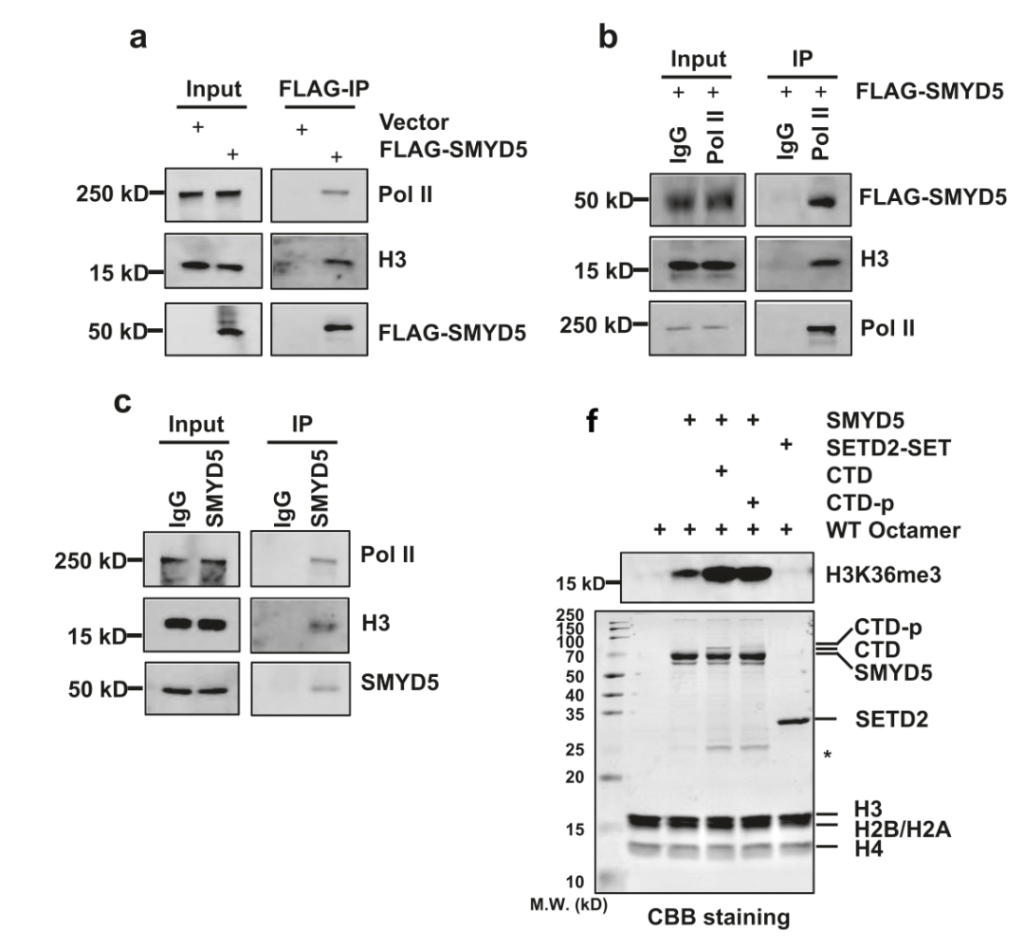
SMYD5介导的H3K36me3在启动子处富集,并且这种富集因Pol II的抑制而减少,表明SMYD5受Pol II调节以甲基化H3。为了检验这一假设,作者在HEK 293T细胞中过表达FLAG标记的SMYD5,分别使用FLAG抗体、Pol II抗体和SMYD5抗体进行免疫沉淀。通过Western blotting检测显示Pol II和H3与SMYD5共纯化(图4a-c)。并且当Pol II C末端结构域(CTD)添加到体外HMT系统中时,SMYD5的H3K36me3甲基转移酶活性增加(图4f)。
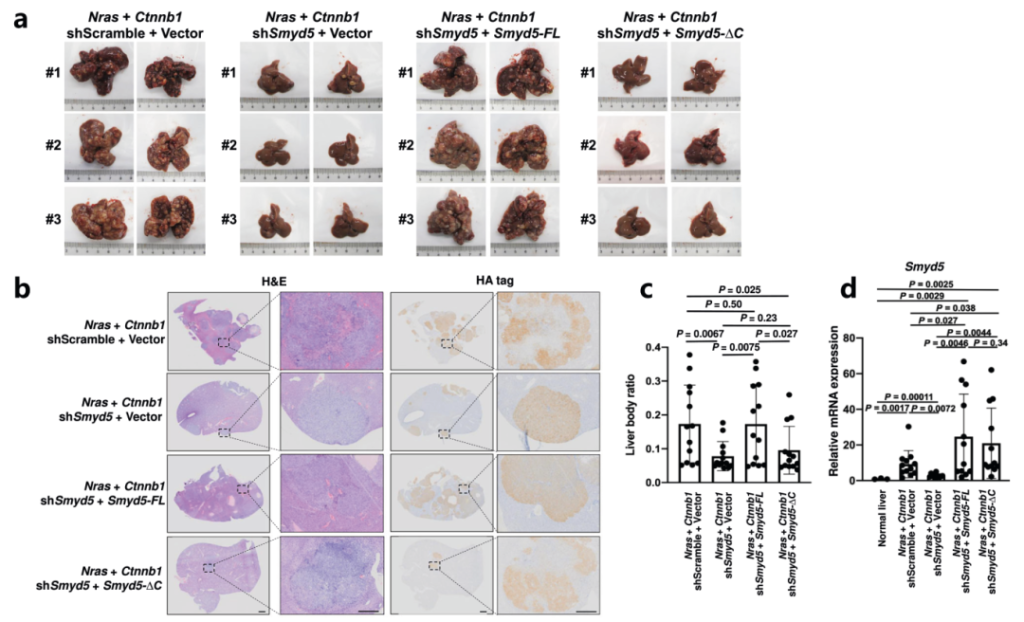
05.SMYD5超表达促进肝癌的肿瘤发生
作者通过分析癌症基因组图谱(TCGA)数据库发现与正常肝组织相比,Smyd5表达在肝细胞癌(LIHC)组织中升高,Smyd5的较高表达水平与LIHC中总生存时间的缩短显着相关。有研究表明Ras和Ctnnb1过表达能够驱动LIHC46中的肿瘤发生,所以作者使用四个质粒共表达Nras和Ctnnb1以及Smyd5 shRNA和Smyd5 mRNA,注射后90-100天小鼠死亡,肝脏成像结果显示虽然Nras和Ctnnb1的过度表达促进了小鼠肝脏中的肿瘤发生。同时Smyd5的敲低则抑制了肿瘤的形成(图5a)。H&E和HA染色的肝脏切片实验及RT-qPCR分析进一步证实了这个结果(图5b-d)。
案例小结
该篇文章主要做了如下工作:
1)通过CUT&Tag的方法分析了H3K36me3在未交联细胞中的分布情况,发现H3K36me3也在基因体区域之外的启动子处富集,并利用Native ChIP-seq对结果进行了验证。
2)通过对多个候选基因的大规模敲除筛选实验,鉴定得到SMYD5蛋白是潜在的H3K36me3的甲基转移酶。
3)调控机制上,SMYD5被Pol II招募到染色质,导致H3K36me3在启动子处富集。SMYD5的C端结构域对于其与组蛋白H3的结合以及H3K36me3的甲基化非常重要。
4)此外,Smyd5表达升高会促进肝癌的发生,在小鼠肝癌模型中敲降Smyd5基因能有效抑制肝癌的发生。
这篇文章中涉及的CUT&Tag、ChIP-seq、RNA-seq和分子类的实验等我们公司都可以提供。伯远生物提供配套的表观遗传学研究工具,为您在表观遗传学方面的研究提供助力。我们可以根据您的不同需求提供技术咨询服务、项目方案设计、实验样品制备、建库测序分析、报告解读、个性化分析以及后续实验验证等一站式服务。欢迎有这方面需求的老师联系我们。
参考文献
Wagner E J, Carpenter P B. Understanding the language of Lys36 methylation at histone H3[J]. Nature reviews Molecular cell biology, 2012, 13(2): 115-126.
Bannister A J, Schneider R, Myers F A, et al. Spatial distribution of di-and tri-methyl lysine 36 of histone H3 at active genes[J]. Journal of Biological Chemistry, 2005, 280(18): 17732-17736.
Hu M, Sun X J, Zhang Y L, et al. Histone H3 lysine 36 methyltransferase Hypb/Setd2 is required for embryonic vascular remodeling[J]. Proceedings of the National Academy of Sciences, 2010, 107(7): 2956-2961.
Powers N R, Parvanov E D, Baker C L, et al. The meiotic recombination activator PRDM9 trimethylates both H3K36 and H3K4 at recombination hotspots in vivo[J]. PLoS genetics, 2016, 12(6): e1006146.
Zhang Y, Fang Y, Tang Y, et al. SMYD5 catalyzes histone H3 lysine 36 trimethylation at promoters[J]. Nature Communications, 2022, 13(1): 3190.