免疫对我们生活甚至生存至关重要,免疫应答的良好平衡是是免疫系统正常运行的基础。对于免疫平衡来说,过度活跃的促炎状态必然导致免疫调节失常,这就包括自身免疫病和炎症性疾病。了解免疫应答的具体机制有助于更好的维护和调节免疫系统功能。
一些研究表明,感染可以激活神经回路,介导发热、不适饮食行为变化等炎症反应,而电刺激迷走神经是减轻炎症反应的治疗策略之一。虽然我们可以借此将大脑与免疫联系起来,但是大脑作为身体各种生理反应的“仲裁者”,在调节免疫方面所起到的具体作用,我们仍然知之甚少。
在近期发表的《自然》杂志上,哥伦比亚大学祖克曼心脑行为研究所的研究人员发现了可以感知免疫信号的神经元,在身体炎症反应中起到调节作用。
研究结果表明,外周免疫损伤可以通过激活体-脑轴来调节免疫反应,促炎和抗炎信号分别与不同的迷走神经元构成体-脑回路,将免疫信号传递给大脑神经元,由大脑来平衡促炎和抗炎反应。研究人员还进一步识别了这条体-脑回路的组成,为多种免疫疾病的调节和治疗提供了新的可能。
大脑,主打一个什么都要管。来自外界的感染也好,内部状态的变化也好,都在大脑的“监控”和调节之下。长期以来,大脑和免疫相互作用的观念一直都是存在的,但是将外周免疫和大脑联系起来的元素是什么呢?
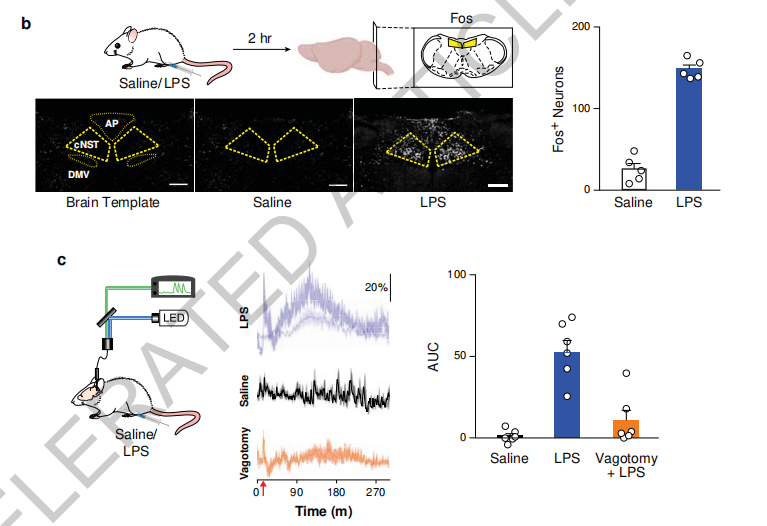
研究人员首先使用向小鼠腹腔注射脂多糖,引发小鼠的先天免疫,通过测量外周血液样本中的细胞因子变化来检查诱导的免疫反应。如预期所想,注射约2h后,促炎和抗炎细胞因子水平显著增加并达到峰值。检测此时对应大脑神经元活动可以发现,脑干中的孤束腹侧核(AP)和孤束核尾部(cNST)表现出强烈激活。
cNST是迷走神经的主要靶标,而在免疫细胞LPS受体缺陷小鼠中,脂多糖注射并不会激活cNST,表明脂多糖是通过免疫细胞激活神经元活动的。切断双侧膈下迷走神经,也可以消除脂多糖对cNST神经元的激活。
这些结果初步证实了迷走神经-cNST免疫轴的存在。在此基础上,如果阻断cNST神经元激活,那么大脑对外周免疫的调节作用也应该受到影响。
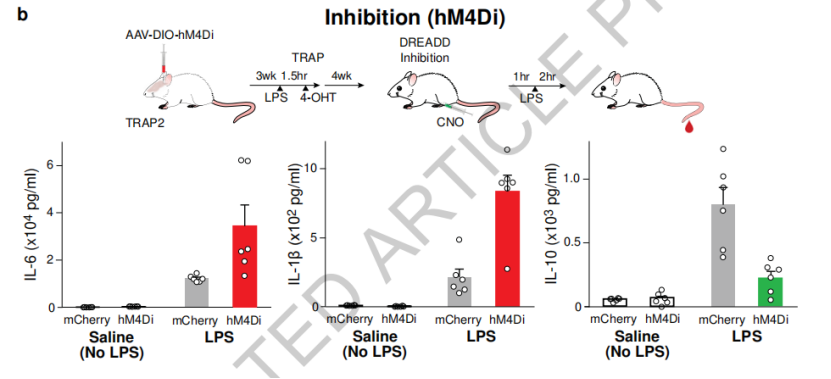
研究人员进一步进行了验证。通过抑制cNST神经元激活,可以发现,脂多糖注射后小鼠的免疫反应失控,与神经元激活未受到抑制的小鼠相比,促炎细胞因子水平上升300%(例如IL-1β从200 pg/ml上升到800 pg/ml),而抗炎反应显著降低(IL-10水平从750 pg/ml降至约250 pg/ml),表现出过度的炎症反应。
如果激活cNST神经元,小鼠的抗炎反应增加(抗炎细胞因子水平增加近10倍),而促炎反应降低(促炎细胞因子水平降低约70%)。而在没有免疫挑战的情况,cNST神经元的激活或沉默对炎症反应并不会产生影响。
综合来看,这些cNST神经元活动对外周炎症有双向调节作用,是大脑中的“变阻器”,确保炎症反应保持在适当的水平。
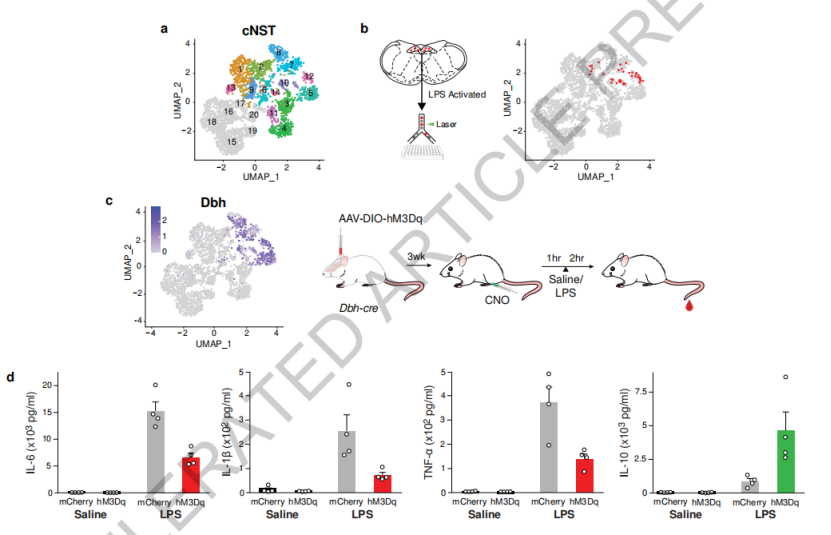
为了找到调节免疫的具体神经元,研究人员对来自cNST的4008个细胞进行了单细胞RNA测序,筛选发现了表达多巴胺β-羟化酶(DBH)的神经元,不仅对脂多糖刺激表现出强烈反应,并且激活cNST中的DBH神经元可以使促炎细胞因子水平显著降低,抗炎细胞因子水平升高,而消除DBH神经元会导致免疫反应失调。
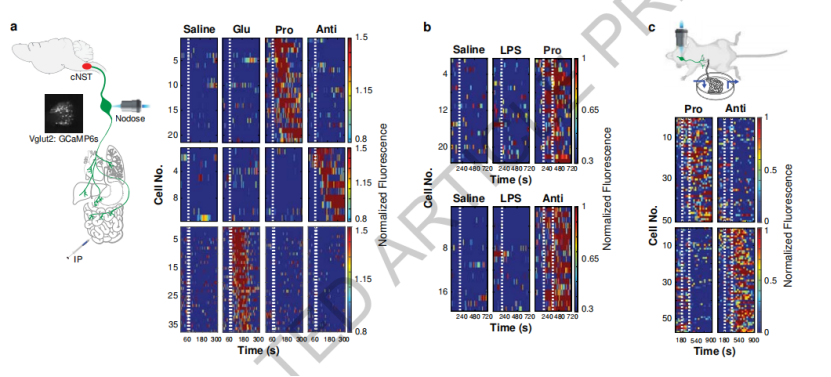
利用体内钙成像平台,研究人员发现,在受到脂多糖刺激时,小鼠抗炎和促炎细胞因子激活了两个不同的迷走神经元群,并且脂多糖并不直接激活迷走神经元,炎症相关迷走神经元与感知脂多糖的迷走神经元也并不重叠。
激活TRPA1迷走神经元使抗炎反应显著增强,截断TRPA1迷走神经元可以阻止抗炎信号传递到大脑,但是对促炎反应没有影响。同理,CALCA迷走神经元选择性地对促炎刺激做出反应。两条迷走神经回路通过单突触连接作用于cNST中的DBH神经元,构成体-脑回路,调节免疫反应。
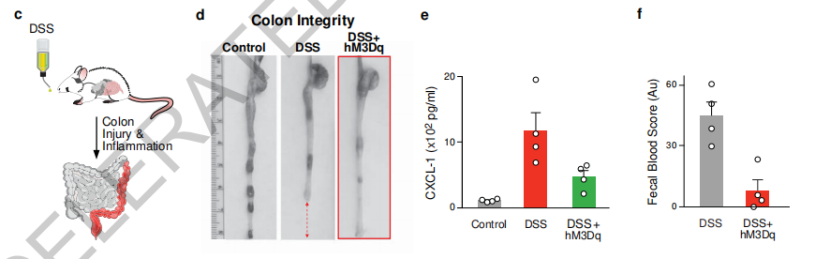
接下来,就该试试这条体-脑回路的调节功能有多强大了。研究人员给小鼠注射致死剂量的脂多糖,激活TRPA1迷走神经元或cNST中的DBH神经元可以显著提高小鼠存活率,约90%的小鼠在免疫挑战后存活。在溃疡性结肠炎小鼠模型中,激活TRPA1迷走神经元可以预防疾病诱导的结肠损伤、促炎细胞因子水平升高和血便,保护结肠完整性。
耶鲁大学的免疫学家Ruslan Medzhitov将这一发现称为“黑天鹅事件”——虽然出乎意料,但一旦揭晓就非常有意义。虽然我们已经知道大脑具有许多功能,但是这项研究“表明存在我们完全没有预料到的新生物学层面”。
作者希望通过激活或抑制携带免疫信号的特定迷走神经元,可以治疗多发性硬化症或类风湿性关节炎等疾病。
参考文献:
Jin H, Li M, Jeong E, et al. A body–brain circuit that regulates body inflammatory responses[J]. Nature, 2024: 1-3.
文章来源:奇点网