生物标志物(Biomarker)是指可以标记系统、器官、组织、细胞及亚细胞结构或功能的改变或可能发生改变的生化指标。人体内存在多种不同的生物标志物,并且随着分子生物学技术的不断进展,生物标志物的种类也越来越多,包括基本身体状况、影像资料(例如乳房X光照片)、特定的分子(例如前列腺特异性抗原PSA)、基因突变(例如BRCA突变)、细胞标记(例如循环肿瘤细胞)以及蛋白质或代谢物等生物分子形式的生物标志物。
其中,蛋白标志物在疾病的早期预测、诊断和治疗中发挥着不可替代的作用。蛋白标志物的变化,通常反映了生理或病理状态的改变。通过研究蛋白标志物,可以用于诊断疾病或指示疾病的严重程度,对患者具有良好的预后价值,还可以作为潜在的药物靶点或者揭示疾病的发病机制,对医学和生命科学领域具有重要的作用和意义。
我司通过引进全新一代Oribtrap Astral质谱平台,使DIA蛋白组学技术具有更高通量、更深覆盖、更高灵敏度、更精准定量、更高稳定性与重现性,并结合生物信息学分析、机器学习、细胞或动物实验等,实现蛋白标志物“筛选-验证-机制”一条龙服务。
一、蛋白标志物的研究思路
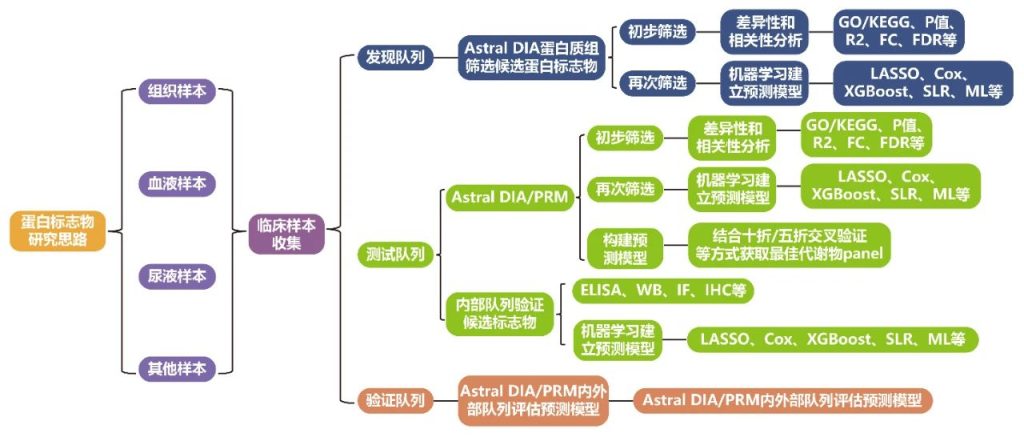
二、案例展示
案例1 蛋白组学发现胰腺癌诊断蛋白标志物

题目:
Prospective observational study on biomarkers of response in pancreatic ductal adenocarcinoma
期刊:Nature Medicine
IF:82.9
发表时间:2024.1
主要方法:
实验:DIA定量蛋白组+Spectronaut质谱解析+PRM靶向验证;
分析:WGCNA+LASSO+Cox比例风险模型
内容简介:
2024年1月29日,上海交通大学医学院附属瑞金医院胰腺中心-上海市胰腺肿瘤转化研究重点实验室沈柏用教授,转化医学国家重大科技基础设施(上海)陈赛娟院士、方海教授、印彤教授的合作团队,在Nature Medicine上发表了题为“Prospective observational study on biomarkers of response in pancreatic ductal adenocarcinoma”的研究论文。在这项前瞻性观察性研究中,招募了1171名接受胰腺切除术的胰腺导管腺癌(PDAC)患者并进行了广泛随访。对191个患者样本的蛋白质组学分析揭示了临床相关的功能蛋白模块。为PDAC建立了一个蛋白质组学水平的预后风险模型,并使用公开的外部队列进一步验证了其效用。更重要的是,通过利用临床和蛋白质组数据集的交互效应回归分析,发现了两种生物标志物(NDUFB8和CEMIP2),表明PDAC患者对辅助化疗的整体敏感性。通过免疫组化对386名患者的内部队列验证了生物标志物。严格的验证扩展到两个外部多中心队列——一个法国多中心队列(230名患者)和一个来自中国两家三甲医院的队列(466名患者)——增强了研究结果的稳健性和普遍性。此外,通过功能测定对PDAC细胞系和患者来源的类器官进行了实验验证。总之,研究者对临床和蛋白质组学数据进行的队列研究揭示了蛋白质标志物对PDAC预后的判别潜力。
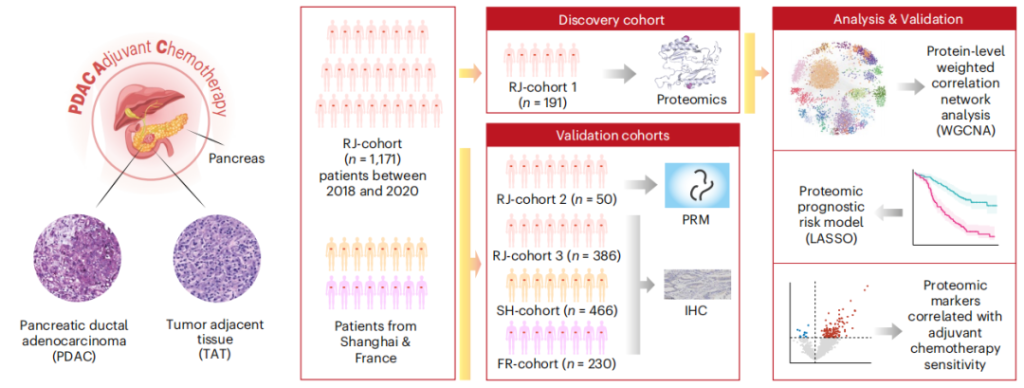
图1 PDCA研究路线图(Jiang L et al., 2024)。
案例2 蛋白组学发现体外循环术后肺损伤血浆蛋白标志物

题目
:Early plasma proteomic biomarkers and prediction model of acute respiratory distress syndrome after cardiopulmonary bypass: a prospective nested cohort study
期刊:International Journal of Surgery
IF:15.3
发表时间:2023.8
主要方法:
实验:血浆DIA蛋白质组学+ELISA+WB+免疫荧光+LIRI大鼠模型;
分析:LASSO+XGBoost模型+Logistic回归拟合(SLR)+CPB-ARDS预测模型
内容简介:
2023年8月,华中科技大学同济医学院附属协和医院麻醉科,麻醉与危重病研究所(麻醉复苏教育部重点实验室)姚尚龙教授、林云教授团队与华中科技大学同济医学院附属协和医院心脏外科董念国教授团队共同合作,在International Journal of Surgery上发表了题为“Early plasma proteomic biomarkers and prediction model of acute respiratory distress syndrome after cardiopulmonary bypass: a prospective nested cohort study”的研究论文。本研究寻找了血浆中与体外循环术后肺损伤(CPB-ARDS)发生有关的蛋白质标志物,通过对队列1进行DIA血浆蛋白质组学分析,筛选蛋白标志物,用队列2对队列1中筛选的候补蛋白进行ELISA测量验证,得到三种蛋白(TXNDC5、CTSL和NPC2),三种蛋白结合临床指标,并基于机器学习建立了组合预测模型,该模型结合了队列2中CPB-ARDS的蛋白质和临床预测因子进行了内部验证,并通过队列3对模型性能进行了外部验证。同时还在大鼠肺缺血/再灌注损伤(LIRI)模型的肺组织中证实了这些蛋白标志物。该项研究为深入理解CPB-ARDS的发生机制提供了宝贵的线索,并为临床实践中采取决策提供了新的视角。
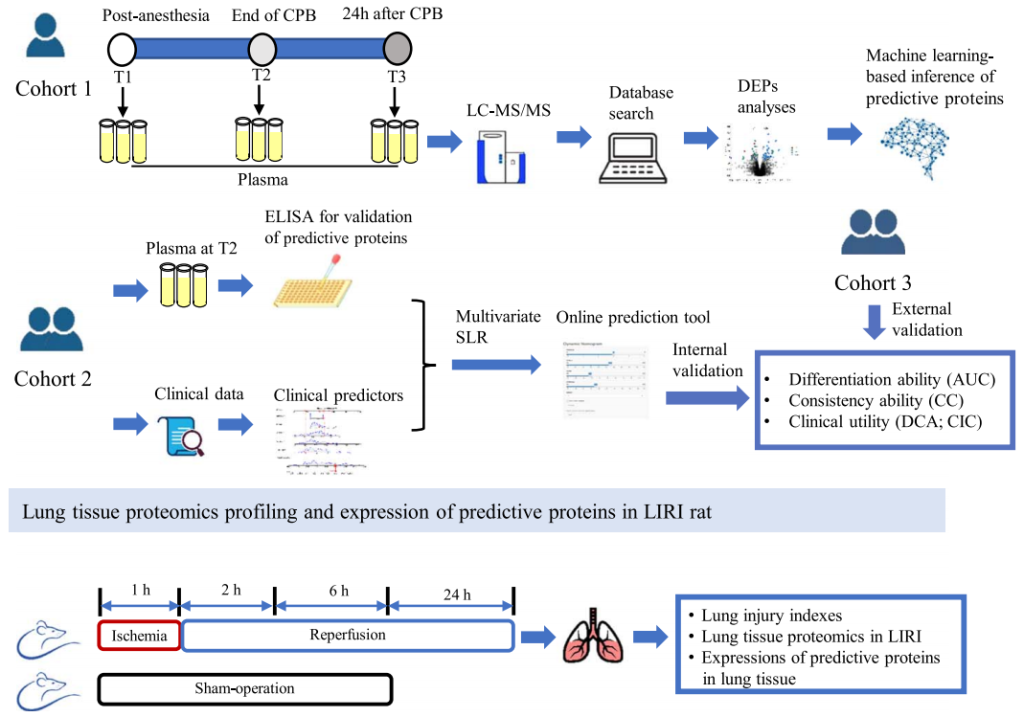
图2 CPB-ARDS研究流程图(S E N et al., 2023)。
案例3 蛋白组学发现1型糖尿病发作前血浆蛋白标志物

题目:
Plasma protein biomarkers predict both the development of persistent autoantibodies and type 1 diabetes 6 months prior to the onset of autoimmunity
期刊:Cell Reports Medicine
IF:14.3
发表时间:2023.6
主要方法:
实验:非靶向和靶向蛋白质组学;
分析:LASSO+QC-ART(实时质量控制分析)+ML模型
内容简介:
2023年6月29日,美国太平洋西北国家实验室研究人员在Cell Reports Medicine上发表了一篇题为“Plasma protein biomarkers predict both the development of persistent autoantibodies and type 1 diabetes 6 months prior to the onset of autoimmunity”的文章。本研究通过盲法、两阶段病例对照血浆蛋白质组学,以确定预测1型糖尿病(T1D)发展的生物标志物。对来自184个个体的2252个样本进行非靶向蛋白质组学初筛,发现了376种受调控的差异蛋白,通路富集显示甚至在自身免疫发生之前就显示出补体、炎症信号传导和代谢蛋白的改变。细胞外基质和抗原呈递蛋白在进展为T1D的个体与仍处于自身免疫状态的个体中受到差异调节。随后对来自990个个体的6426个样本中的167种蛋白质进行靶向蛋白质组学测量,验证了83种生物标志物。并通过机器学习构建对应的诊断模型,分析预测个体在自身抗体出现前6个月是否会保持自身免疫或发展为T1D,受试者工作特征曲线下的区域分别为0.871和0.918。该研究识别并验证了生物标志物,突出了T1D发育过程中受影响的途径。
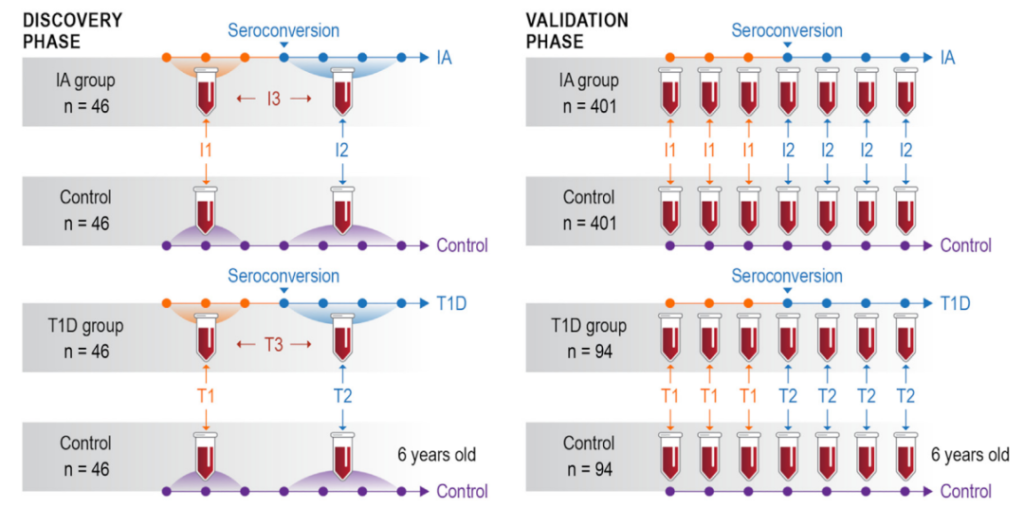
图3 T1D研究设计图(Yu W et al., 2023)。
参考文献
Jiang L ,Qin J ,Dai Y , et al.Prospective observational study on biomarkers of response in pancreatic ductal adenocarcinoma.[J].Nature medicine,2024,
S E N ,M L B ,Charles A , et al.Plasma protein biomarkers predict the development of persistent autoantibodies and type 1 diabetes 6 months prior to the onset of autoimmunity.[J].Cell reports. Medicine,2023,4(7):101093-101093.
Yu W ,Lin C ,Chengye Y , et al.Early plasma proteomic biomarkers and prediction model of acute respiratory distress syndrome after cardiopulmonary bypass: a prospective nested cohort study.[J].International journal of surgery (London, England),2023,109(9):

