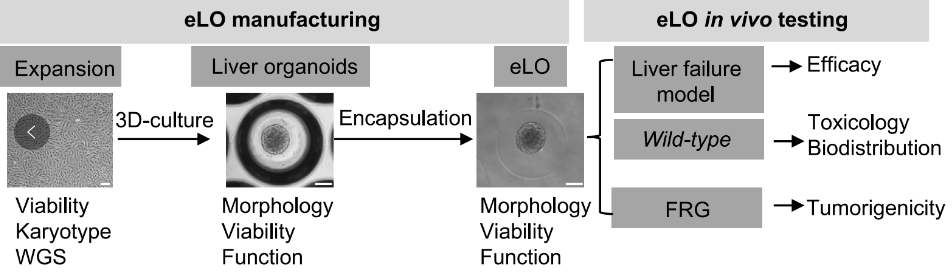
急性肝衰竭是一种死亡率很高的疾病,常见病因包括过量对乙酰氨基酚导致的中毒、肝缺血、病毒性和自身免疫性肝炎,以及处方药、草药和膳食补充剂引起的药物性肝损伤[1]。
目前,肝移植仍然是肝衰竭的唯一有效治疗方法,但由于供体短缺,肝细胞移植也被建议作为肝移植的替代策略。但是,肝细胞移植的临床应用存在一些技术障碍,例如原代人肝细胞短缺和质量控制困难,使用多能干细胞分化和成纤维细胞转分化得到肝细胞存在功能缺陷,并且由于重编程等基因操作可能存在体内移植的安全性问题。
此前,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)惠利健团队在不进行基因操作的情况下将原代人肝细胞去分化为双表型状态,构建出可增殖人肝细胞(ProliHHs),ProliHHs具有肝细胞和祖细胞特征,可以扩增至少10000倍,在3D类器官系统中能够重新分化为接近原代人肝细胞的成熟状态。在ProliHH类器官中,肝脏基因的表达和相应的肝功能均得到显著改善[2,3]。
在最近的《细胞·干细胞》杂志上,惠利健团队再次发表最新研究成果[4],他们实现了批量制备海藻酸钠微胶囊包裹的ProliHH类器官(eLO)。
在80%肝切术后肝衰竭小鼠模型中,eLO显著提高了小鼠存活率,并提供正常的肝功能,从而改善高氨血症和低血糖。此外,eLO治疗还保护了肠道屏障,减少血清内毒素和炎症反应,从而促进了肝脏再生。在过量对乙酰氨基酚诱导的肝衰竭小鼠模型中,eLO也证实了治疗效果。eLO对小鼠没有造成不良影响,并且始终保持非致瘤性。
基于此前开发的去分化培养系统,研究人员得以大规模扩增ProliHH,并经重新培养获得成熟的3D肝脏类器官,再使用海藻酸钠封装,eLO大小均匀,平均直径为435±48μm,可以至少维持一周不出现明显的形态变化。eLO与封装前具有相近的转录组、代谢活性和糖原储存能力,eLO对细胞死亡的抵抗能力更强。
eLO生成和实验设计
为了验证eLO在体内的功能,研究人员首先构建了肝切除手术诱导的肝衰竭小鼠模型,切除了肝脏的左叶、中叶和右前叶,这些小鼠会出现肝功能不足、解毒减少、凝血受损、电解质平衡改变、氨浓度升高,导致炎症水平升高和多器官衰竭,最终死亡。
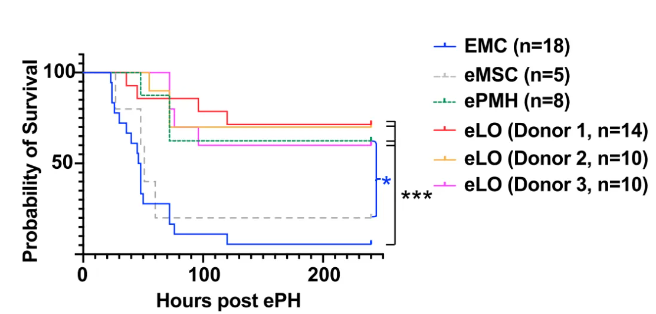
研究显示,1-10%肝质量的肝细胞能够支撑应对急性肝衰竭,研究人员选择了5%,即5×106的eLO,在肝切除手术后6小时腹膜内移植给小鼠。移植了空的微胶囊的对照组小鼠在第4天时的死亡率达到94%,而eLO组未超过40%。减少移植eLO的量后,小鼠的生存率有所下降,表明治疗效果可能是剂量依赖性的。
移植了空的微胶囊(EMC)、间充质干细胞微胶囊(MSC)、小鼠原代肝细胞微胶囊(ePMH)和eLO的小鼠的生存率变化
接受eLO治疗后,小鼠的肝衰竭显著减弱,脂肪变性和微血管异常都显著减少,伴随肝细胞细胞内容物的逐渐积累。肝脏类器官在体内保持稳定,结构完整,直到第7天,eLO的活性都保持在80%以上,第14天时,也有36%。
另一组经对乙酰氨基酚诱导的肝衰竭小鼠也接受了类似的治疗,在治疗前小鼠已经出现肝脏结构受损并呈空泡化,eLO移植同样显著提高了小鼠的生存率,肝脏得到部分修复。
eLO治疗后的高生存率和一致的治疗效果为分析eLO在治疗肝衰竭中的潜在作用提供了独特的机会,这在以前是难以实现的。
手术诱导的肝衰竭与高氨血症和低血糖有关,氨是诱发肝性脑病的神经毒素,而eLO移植使得对氨的内源性解毒能力得到改善,并恢复了糖原储存,这意味着eLO为肝功能提供支持,从而改善肝衰竭相关高氨血症和低血糖。
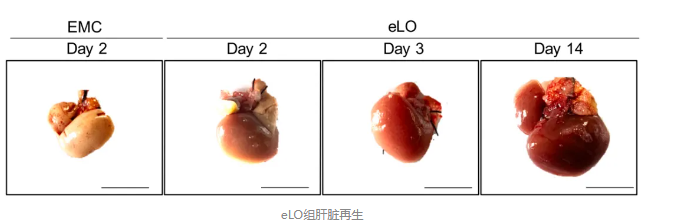
在移植后第2天,eLO组的肝脏已经逐渐恢复粉红色,并且明显增大,第14天时,肝/体重比恢复至4.7%,转录组接近正常肝脏,肝脏再生大大增强,转录组学分析显示,eLO组小鼠参与细胞周期和细胞增殖的基因明显上调。
据报道,高浓度的内毒素会引发强烈的炎症反应,阻止细胞周期进程,是肝脏再生的阻碍,研究人员发现,移植了空的微胶囊的对照组小鼠确实内毒素水平显著升高,而eLO组则保持在低水平,对血清细胞因子阵列的测定也证实了两组的全身炎症水平差异。当人为增加eLO组小鼠的内毒素水平时,eLO的治疗效果显著减弱。
由于肝切除术会导致肠粘膜受损和内毒素泄露,eLO组内毒素水平的减少可能代表着肠粘膜得到修复,这一点也在实验中得到了证实。因此,eLO不仅提供了肝功能支持,还保护了肠屏障。
最后,在eLO的安全性方面,研究人员发现,eLO没有急性毒性,不会造成小鼠行为活动、食物摄入量和粪便特征的显著变化,移植后60天,肝脏、肾脏、睾丸、肠、心脏、脾脏和肺没有形态学或组织学变化,6个月时,肝脏结构完整,肝脏/体重比例正常,谷丙转氨酶和谷草转氨酶水平与60天时相比未发生变化。ProliHHs在基因组水平上高度稳定,未出现肿瘤。
综上所述,这项研究实现了大规模制备eLO,在两种肝衰竭小鼠模型中证明了eLO腹腔移植的有效性和eLO发挥作用的机制,并且证实了eLO的安全性,为正在进行的eLO临床研究奠定了坚实的基础。
参考文献:
[1] Stravitz R T, Lee W M. Acute liver failure[J]. The Lancet, 2019, 394(10201): 869-881.
[2] Zhang K, Zhang L, Liu W, et al. In vitro expansion of primary human hepatocytes with efficient liver repopulation capacity[J]. Cell stem cell, 2018, 23(6): 806-819. e4.
[3] Feng S, Wu J, Qiu W L, et al. Large-scale generation of functional and transplantable hepatocytes and cholangiocytes from human endoderm stem cells[J]. Cell Reports, 2020, 33(10).
[4] Yuan X, Wu J, Sun Z, et al. Preclinical efficacy and safety of encapsulated proliferating human hepatocyte organoids in treating liver failure[J]. Cell Stem Cell, 2024.
文章来源:奇点网