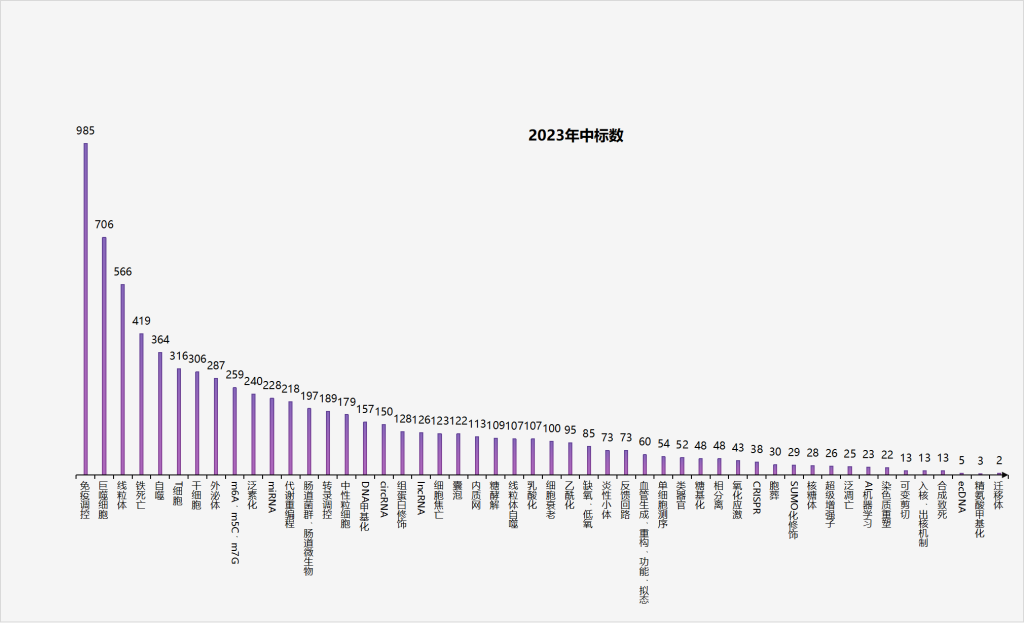
随着国自然基金评选结果的公布,对于自己的研究方向大家是不是也想蹭一蹭国自然热点?经过小医对2023年医学部国自然热点的分析发现,在中标项目中免疫调控依旧稳居第一,为985项,除免疫调控外,最值得重点关注的是巨噬细胞,其中标数激增,为706项,这是由于,巨噬细胞具有强大的吞噬作用,能够调动机体的免疫防御、免疫自稳、免疫监视功能,在肿瘤、心血管、自身免疫性疾病、感染性疾病、炎症性疾病等各类疾病中都能见到其忙碌的身影。其余热点中标数详见图1。本期,小医将重点介绍巨噬细胞这个热点领域的研究套路哟!
图1 2023年国自然热点中标数统计
在讲解研究思路之前,我们先来了解下什么是巨噬细胞,巨噬细胞有哪些作用以及巨噬细胞的分类吧!
巨噬细胞简介
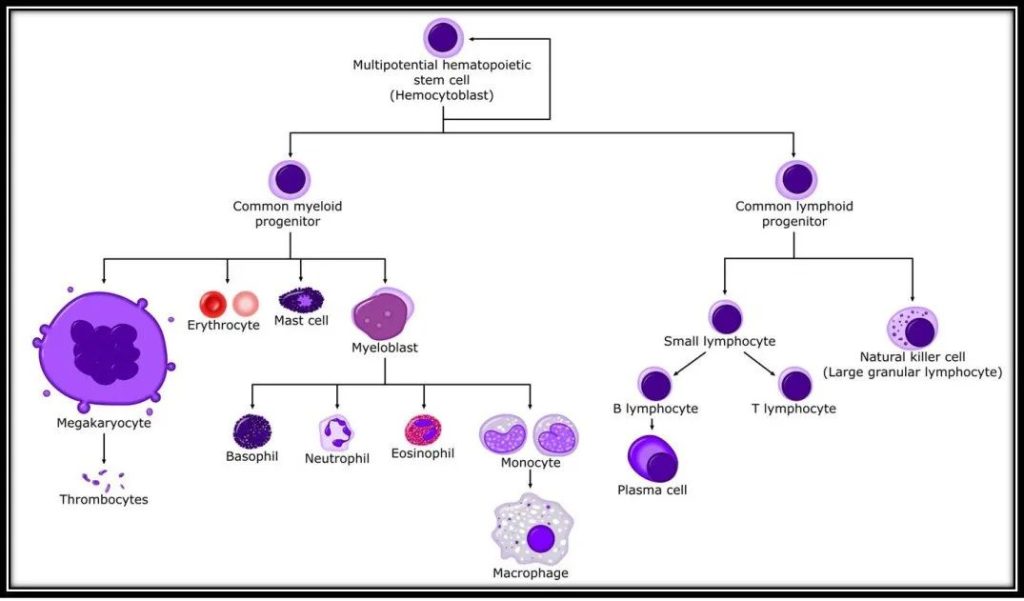
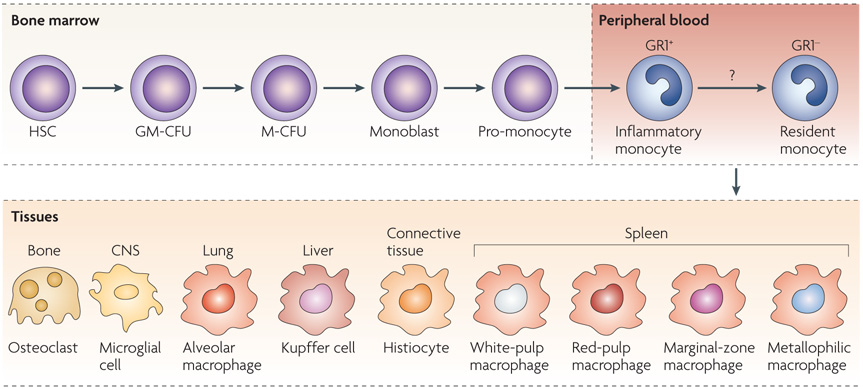
1884年,俄罗斯动物学家Elie Metchnikoff首次提出巨噬细胞(Macrophage)的概念,即一种位于组织内的白细胞,源自单核细胞,单核细胞又源自骨髓中的造血干细胞(图2)。单核细胞作为常驻单核细胞或有炎症时作为炎性单核细胞迁移到常驻组织中,迁移到组织后,分化为组织特异性巨噬细胞(图3)。
图2 巨噬细胞发育示意图(Shaikh A, Bhartiya D., 2012)。
图3 单核细胞异质性示意图(Mosser D M, Edwards J P., 2008)。
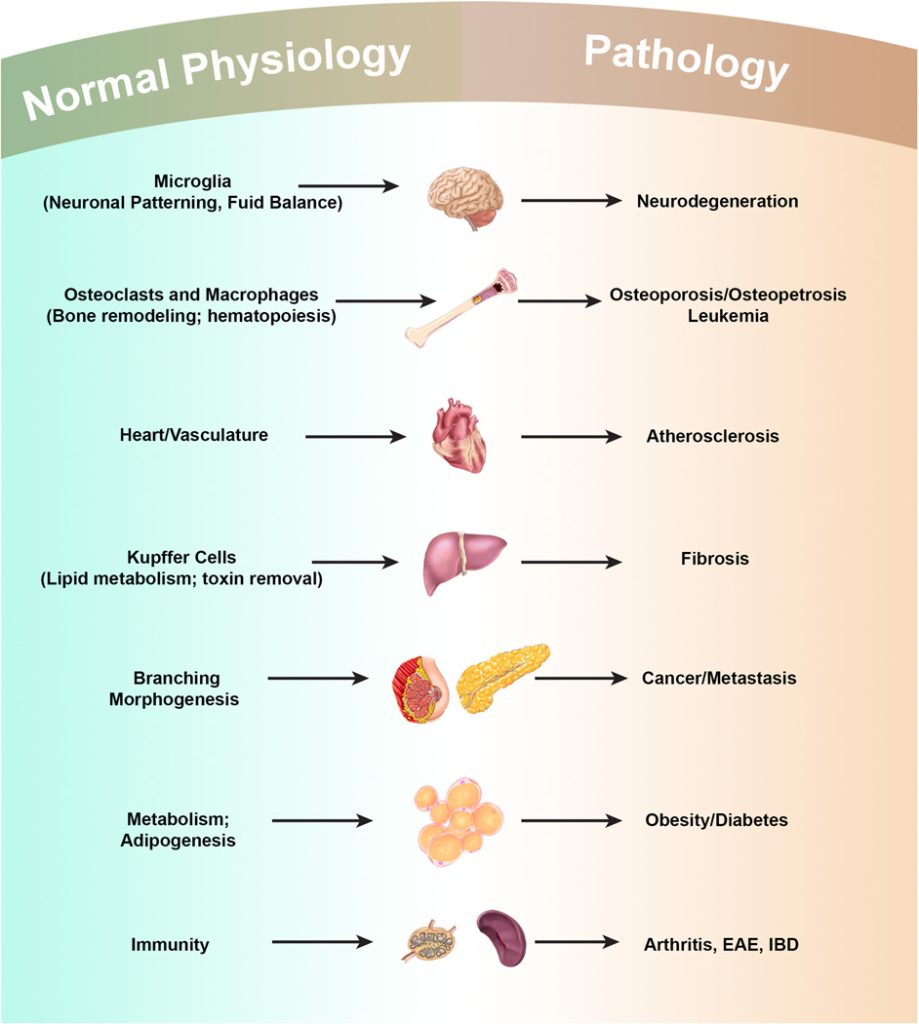
巨噬细胞作为机体免疫系统中的重要组成部分,普遍存在于身体的任何部位,并执行三种基本功能,即吞噬作用、外源抗原呈递以及分泌细胞因子和生长因子以进行免疫调节,在组织发育、体内平衡、清除死细胞和外来病原体以及调节炎症和肿瘤免疫反应等方面发挥着重要作用(图4)。详细而言,巨噬细胞可以对损伤或感染后迅速产生的内源性刺激做出反应,这些早期刺激通常由先天免疫细胞产生,并且可以对巨噬细胞的生理学产生显著但通常是短暂的影响。巨噬细胞还可以对抗原特异性免疫细胞产生的信号做出反应。巨噬细胞本身可以产生多种影响自身生理的因素。此外,巨噬细胞在不同组织中也有不同的名称和功能,例如循环单核细胞来源的巨噬细胞、组织驻留巨噬细胞(TRM)和肿瘤相关巨噬细胞,它们在分类和起源方面具有复杂的相关性。
图4 巨噬细胞在发育、稳态和疾病中的作用(Wynn et al., 2013)。
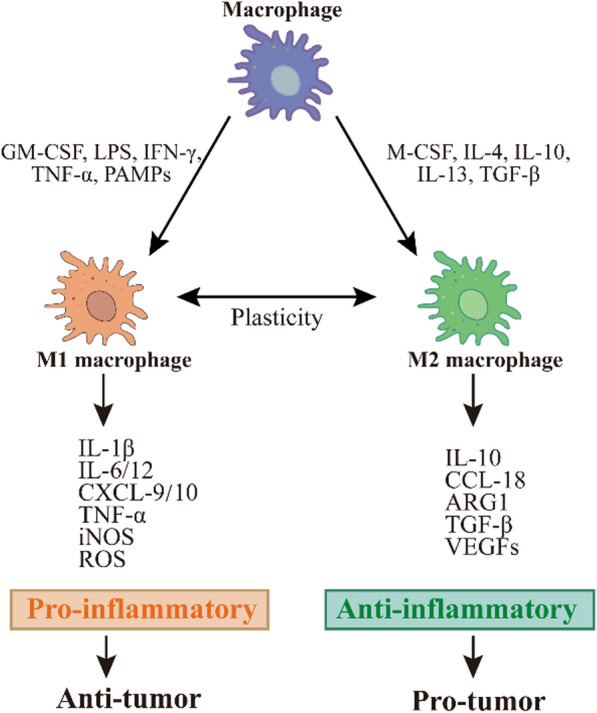
巨噬细胞具有显着的可塑性,其激活状态受多种因素影响,但通常可以根据刺激因子和分泌产物将其简化为两类,即经典激活的M1巨噬细胞和替代激活的M2巨噬细胞(图5)。更多关于巨噬细胞极化的介绍详见“听说你想研究巨噬细胞极化?”一文。
图5 巨噬细胞激活和M1/M2分型(Shen et al., 2023)。
巨噬细胞的研究套路
例子一
今年3月份,Alexander Hooftman等人在Nature(IF:64.8)上发表了题为“Macrophage fumarate hydratase restrains mtRNA-mediated interferon production”的文章。作者采用无偏代谢组学和稳定同位素辅助示踪方法,发现了脂多糖刺激后诱导炎症性天冬氨酸-精氨酸琥珀酸分流的现象,描述了一条从延胡索酸水合酶(FH)抑制到线粒体膜超极化和线粒体RNA(mtRNA)释放的线粒体负反馈调节信号通路,暗示了FH在核酸释放中的作用,有助于炎症驱动的肿瘤发生,并在病毒感染的情况下作为潜在的宿主防御机制,指出了内源性dsRNA的临床相关性(图6)。
图6 FH抑制通过mtRNA驱动的负反馈调节触发IFN-β的释放(Hooftman et al., 2023)。
巨噬细胞代谢的变化已成为炎症的主要调节因子,代谢重编程对巨噬细胞激活至关重要,但其中所涉及的参与者以及它们如何调节细胞因子的产生仍不完全清楚。已知,用TLR4配体脂多糖(LPS)刺激巨噬细胞会导致代谢重新编程,从而促进细胞因子的产生。因此,本文通过无偏代谢组学表征了炎症性骨髓源性巨噬细胞(BMDM)的代谢组。
例子二
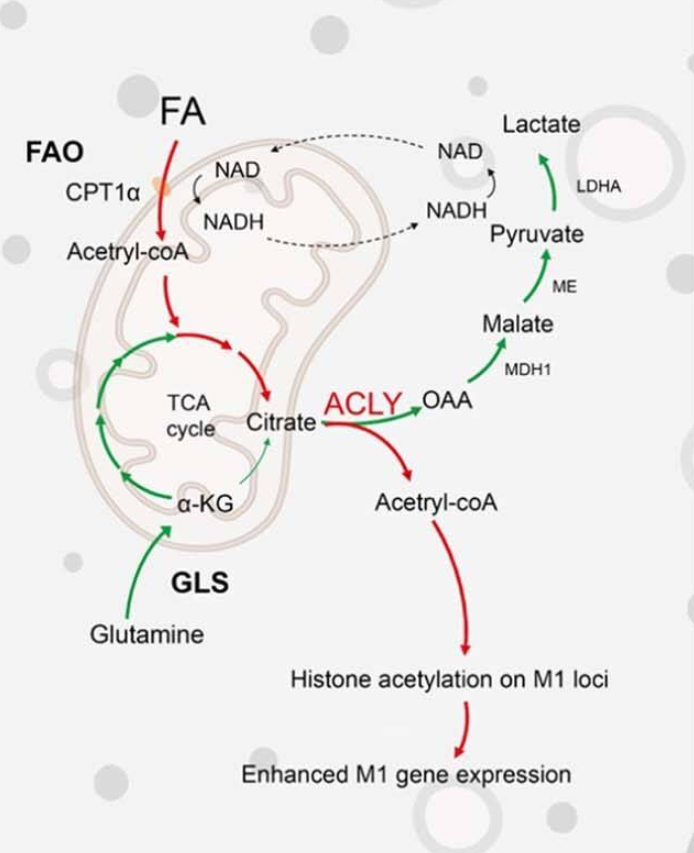
同年2月份,Pu-Ste Liu等人在Nature immunology(IF:30.5)上发表了题为“CD40 signal rewires fatty acid and glutamine metabolism for stimulating macrophage anti-tumorigenic functions”的文章。介于暴露脂多糖会触发巨噬细胞促炎性极化,并伴有代谢重编程,其特征是有氧糖酵解升高和三羧酸循环破坏;CD40在巨噬细胞以及其他抗原呈递细胞(APC)中显著高表达,并作为CD40配体(CD40L)的受体发挥作用,CD40-CD40L相互作用会触发多种分子事件。作者通过ChIP、流式细胞术、同位素标记、代谢组学等方法经体内外鉴定,表明CD40信号传导可促进脂肪酸氧化(FAO)和谷氨酰胺代谢,从而触发促炎/抗肿瘤极化所需的表观遗传重编程。从机制上讲,CD40激活通过使用由FAO产生的乙酰辅酶A来增加促炎标记基因启动子和增强子处的组蛋白乙酰化,CD40信号传导还会触发谷氨酰胺向乳酸的转化;谷氨酰胺产生的乳酸通过微调NAD+/NADH比率来维持FAO。总而言之,FAO和谷氨酰胺代谢通常与M2极化相关,可用于协调促炎和抗肿瘤巨噬细胞极化,并且CD4触发的促炎激活不会中断TCA循环(图7)。
图7 巨噬细胞中CD40信号诱导的代谢重编程图示图(Liu et al., 2023)。
例子三
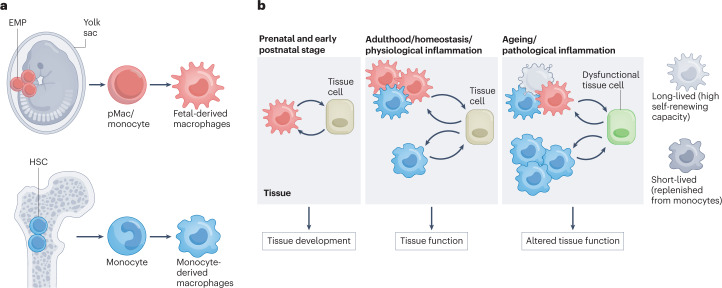
同年5月份,Elvira Mass等人在Nature reviews immunology(IF:100.3)上发表了题为“Tissue-specific macrophages: how they develop and choreograph tissue biolog”的综述性文章。文章总结了近些年驻留巨噬细胞的最新研究进展,探讨描述了巨噬细胞的起源、发育过程、功能和多样性和起源。文章主要描述了巨噬细胞的功能和多样性,包括(1)在稳态条件下的功能:清除病原体、清除死亡细胞、调节炎症反应和促进组织再生;(2)在环境刺激、感染和组织再生中的功能:功能和寿命的变化;(3)巨噬细胞的多样性:不同组织和器官的巨噬细胞功能和结构差异(图8)。
图8 不同巨噬细胞亚群对组织功能的贡献(Mass et al., 2023)。
巨噬细胞在胚胎发生早期出现并定殖于发育中的器官,在每个组织内形成3D网络,这些组织驻留巨噬细胞具有较高的自我更新能力,通常不需要HSC的输入。然而,在出生后组织成熟过程中,HSC衍生的单核细胞在许多组织中形成不同的巨噬细胞群,其中一些组织特异性巨噬细胞需依赖成年期不断补充单核细胞,这就产生了一种复杂的情况,其中胎儿源性巨噬细胞和HSC源性巨噬细胞在某些组织中共存,并在稳定状态以及感染和炎症期间促进组织功能;然而,对于一种组织内不同的巨噬细胞亚群,它们在器官发生和稳态中的作用以及炎症或感染相关反应之外的巨噬细胞核心功能的系统分析上存在很大程度上的缺乏。
在这篇综述中,作者讨论了巨噬细胞如何在屏障和内脏器官中发育的例子,并描述了它们在调节这些器官内稳态功能中的作用,研究了对巨噬细胞生命周期和不同解剖位内异质性的理解的最新进展,并讨论了跨组织巨噬细胞的保守核心功能,这对于维持器官特异性功能和免疫至关重要。也就是说,组织中的巨噬细胞不仅仅是对刺激或感染作出反应的旁观者,它们处于组织稳态和发病机制的界面,如果它们的稳态核心功能受到干扰,则会导致疾病。因此,组织中的巨噬细胞代表跨越器官和生物体的实质性核心壁龛细胞类型,确保组织的功能和完整性。
巨噬细胞的研究方法
经过这几篇文献的解读,相信大家也对巨噬细胞的重要性有了一定的了解,且清楚了为何巨噬细胞会成为国自然的研究热点,接下来,小医就给大家简单总结一下巨噬细胞的研究方法。
首先,可以从全血(PBMC分离、巨噬细胞分析、单核细胞分化成巨噬细胞)或组织或肿瘤(组织或肿瘤样本的单细胞悬液制剂)中分离和分析巨噬细胞。例如,可通过制备组织或肿瘤切片(直接用于后续免疫组化染色和分析)或单细胞悬液(直接用于表面标记物流式细胞术分析),当需要时,还可使用激光捕获显微解剖和流式细胞仪分选法(FACS)或磁珠细胞分选试剂盒分离不同亚型的巨噬细胞(如:CD14、CD11b、CD68等)。
其次,可以进一步培养和刺激分离的巨噬细胞。通常,M1巨噬细胞可通过刺激被重新编程为M2巨噬细胞,反之亦然,详见“听说你想研究巨噬细胞极化?”一文。
值得注意的是,人和小鼠单核细胞系也有商品化产品,包括THP-1细胞(人急性单核细胞白血病)、U937细胞(人组织细胞淋巴瘤)和RAW264.7细胞(小鼠白血病单核巨噬细胞)、J774A.1细胞(小鼠BALB/c单核巨噬细胞)。目前,有多种方法可分离巨噬细胞,包括磁珠细胞分选、密度梯度分离、激光捕获显微解剖和流式细胞仪分选法(FACS)。分离后,可通过基因表达分析、功能研究、细胞因子和趋化因子生成的评估以及使用免疫荧光染色、免疫检定、流式细胞仪、免疫印迹或聚合酶链反应的蛋白质表达和细胞表面标志物来分析和表征巨噬细胞功能和表型。
参考文献
Hooftman A, Peace C G, Ryan D G, et al. Macrophage fumarate hydratase restrains mtRNA-mediated interferon production[J]. Nature, 2023, 615(7952): 490-498.
Liu P S, Chen Y T, Li X, et al. CD40 signal rewires fatty acid and glutamine metabolism for stimulating macrophage anti-tumorigenic functions[J]. Nature immunology, 2023, 24(3): 452-462.
Mass E, Nimmerjahn F, Kierdorf K, et al. Tissue-specific macrophages: how they develop and choreograph tissue biology[J]. Nature Reviews Immunology, 2023: 1-17.
Mosser D M, Edwards J P. Exploring the full spectrum of macrophage activation[J]. Nature reviews immunology, 2008, 8(12): 958-969.
Shaikh A, Bhartiya D. Pluripotent stem cells in bone marrow and cord blood[J]. Blood Cell-An Overview of Studies in Hematology, 2012: 69-88.
Shen Z, Liu X, Fan G, et al. Improving the therapeutic efficacy of oncolytic viruses for cancer: targeting macrophages[J]. Journal of Translational Medicine, 2023, 21(1): 842.
Wynn T A, Chawla A, Pollard J W. Macrophage biology in development, homeostasis and disease[J]. Nature, 2013, 496(7446): 445-455.