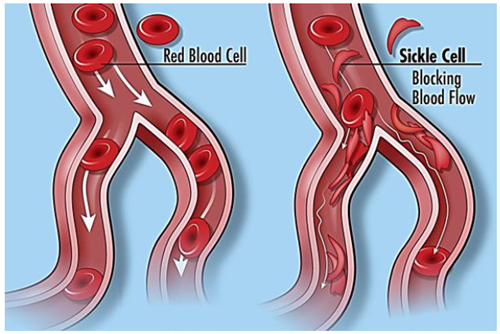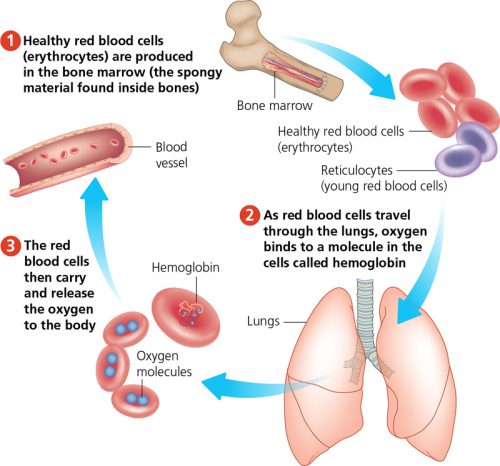
2012年,CRISPR基因编辑技术横空出世,更多基因编辑技术的介绍,详见“CRISPR/Cas9基因编辑技术的应用”一文。当时,所有人都觉得这将会是生物科技领域最强大的工具之一,然而,在疗效与安全性问题的双重困扰下, exa-cel疗法在临床中的运用履步维艰。2015年,Vertex Pharmaceuticals和CRISPR Therapeutics达成合作,致力于共同开发针对血红蛋白病的基因疗法。2017年,两家公司宣布联合开发CTX001(一种自体、体外CRISPR/Cas9基因编辑疗法),旨在通过修饰人体造血干细胞,使红细胞中产生高水平的胎儿血红蛋白(HbF),从而改善患者的病情并减少输血需求,后来CTX001更名为Exa-cel。今年6月,FDA已受理Exa-cel的生物制品许可(BLA)申请,11月份Exa-cel在英国上市成功,并更名为CASGEVY™。CASGEVY™、Exa-cel、CTX001是同一款基因编辑疗法的不同名称。
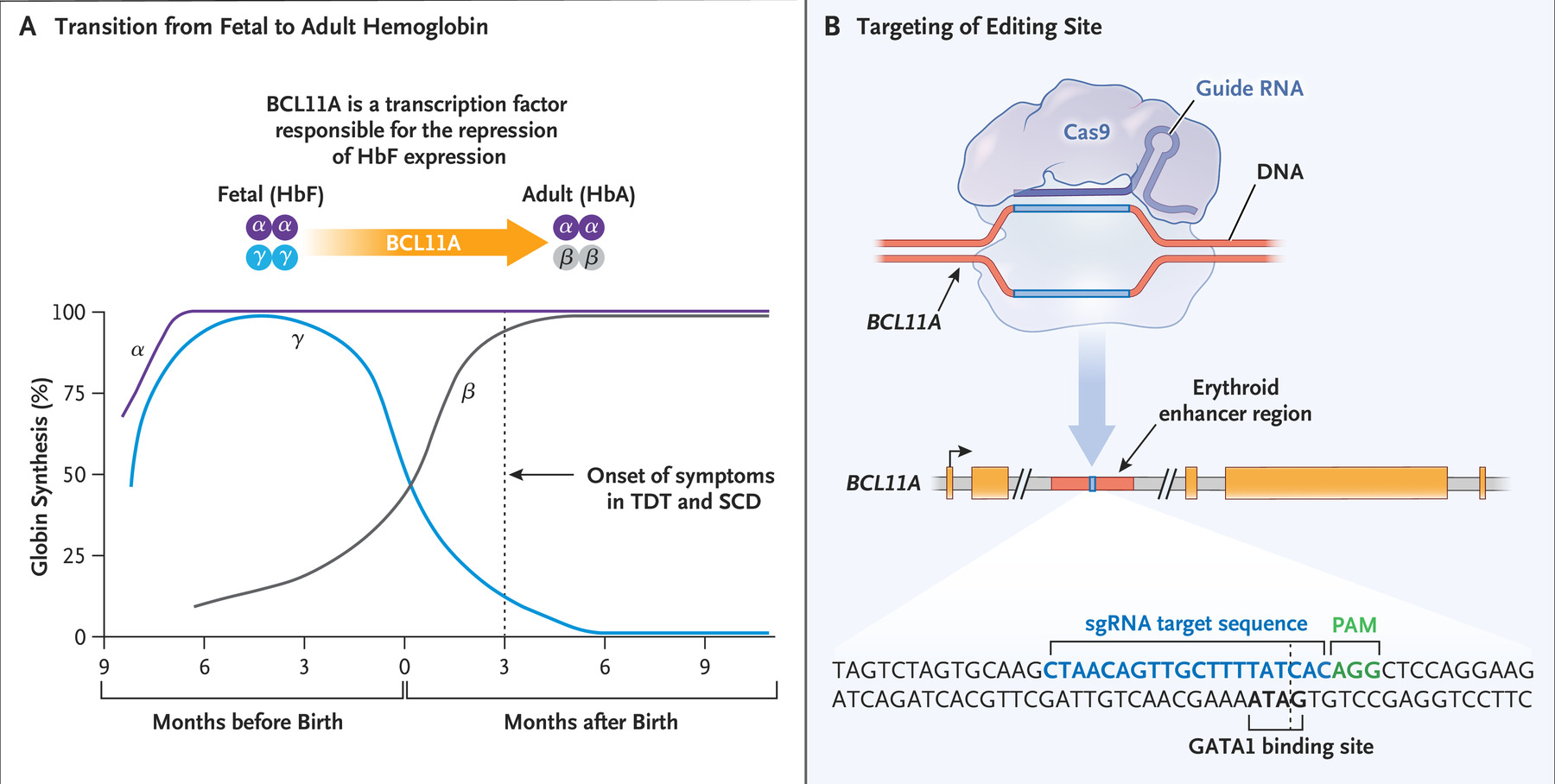
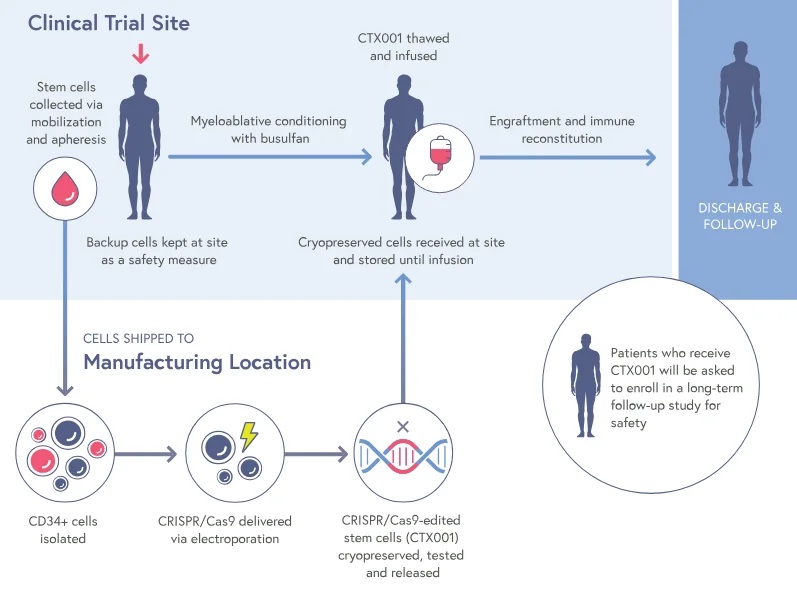
CASGEVY™疗法的治疗步骤如下:1)从健康供体中获取CD34+造血干细胞和hHSPC;2)电穿孔导入红细胞特异性靶向BCL11A增强子的CRISPR/Cas9基因编辑系统;3)清髓后输入患者体内(图4)。
图4 CASGEVY™工作原理(源自CRISPR Therapeutics)。
CASGEVY™疗法的疗效
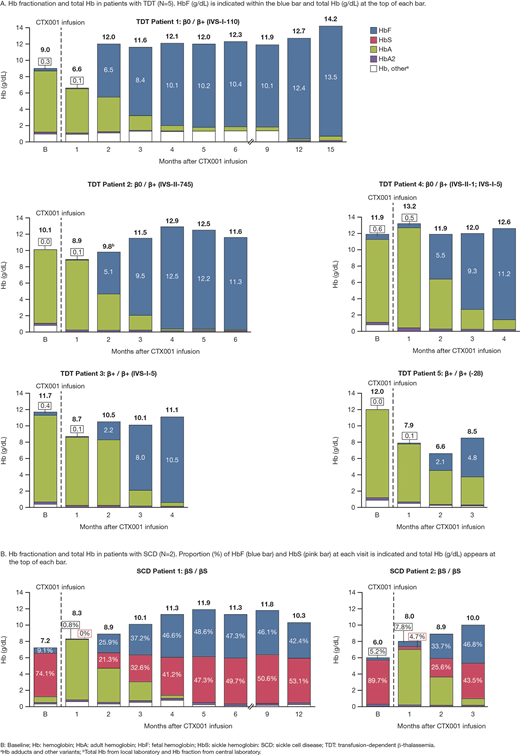
针对CD34+HSPC基因组的编辑过程仅在离体状态中短暂进行,因此当CASGEVY™细胞回输给患者时,细胞中不存在残留的基因编辑活性。据悉,临床试验数据显示,在接受CASGEVY™治疗SCD和TDT的两项全球临床试验中,试验均达到了各自的主要重点:至少连续12个月摆脱严重VOC或独立于输血(图5)。试验详情如下,有45名SCD患者接受了CASGEVY™试验,但只有29名患者参与试验的时间足够长,即受试的29名SCD患者中有28名(97%)在治疗后12个月内没有出现其疾病特有的严重疼痛;有54名TDT患者接受了CASGEVY™试验,但只有42名患者参与试验的时间足够长,即受试的42名TDT患者中有39名(93%)在给药后至少12个月内不需要输血,其余3人的红细胞输注需求减少了70%以上。综上,迄今为止,受试的97名SCD和TDT患者安全性总体上与白消安(Busulfan)和造血干细胞移植的清髓性调节一致。
Meisel R. CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia. N Engl J Med. 2021;384(23):e91.
Wong C. UK first to approve CRISPR treatment for diseases: what you need to know. Nature. 2023;10.1038/d41586-023-03590-6.