基因突变是癌症发生机制中非常重要的一环。不过,即使基因本身不发生改变,仍旧有方法可以改变基因功能从而影响癌症发生。
那就是表观遗传。
染色质解旋的时空动力学和后续转录机制的结合在癌症的致病转化(起始、进展和转移)中有重要作用,甚至参与调节肿瘤耐药性。如今,也有很多针对表观遗传的抗肿瘤药物出现。
毫无疑问,搞清楚癌症中的表观遗传改变能够为我们提供许多新的认知。
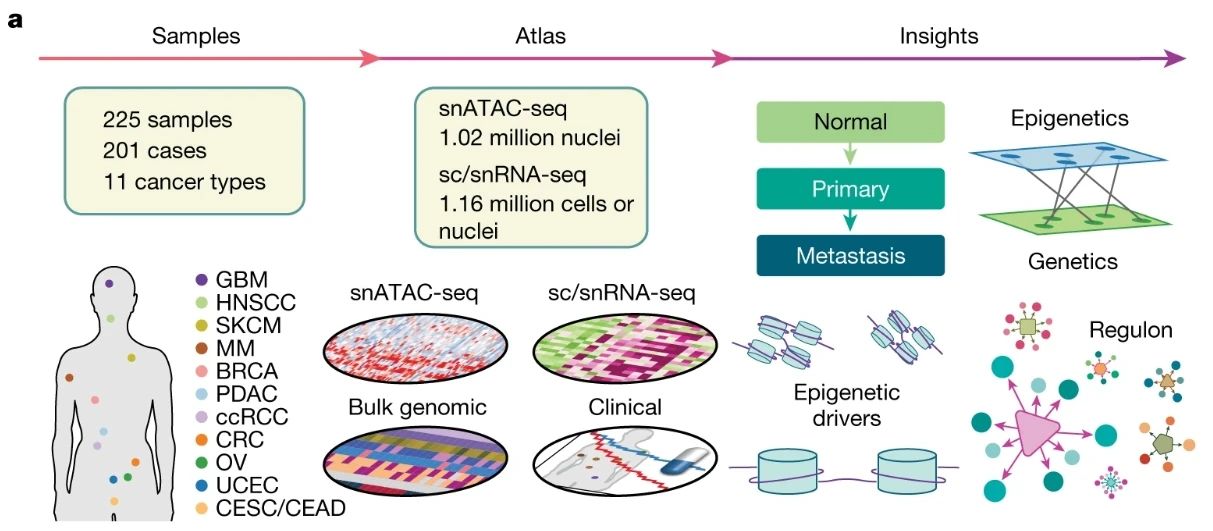
今日,《自然》杂志刊登了圣路易斯华盛顿大学和普林斯顿大学科研团队的新成果。研究者们分析了11个癌种的200余个组织样本的表观遗传改变,从超过百万个细胞中发现了大量有用数据,包括部分癌种特异性的表观遗传驱动机制。
本研究结合了单核转座酶可及染色质分析测序(snATAC-seq)和单核RNA测序(snRNA-seq),能够同时分析单个细胞中的表观基因组和转录组,从而直接比对染色质可及性和基因转录之间的关联。
研究使用了NCI人类肿瘤图谱网络(HTAN)数据库,纳入了包括11种癌症类型的201名患者的158个原发瘤组织样本、52个转移性肿瘤样本和15个正常邻近组织样本。癌种包括结直肠癌(CRC)、胰腺导管腺癌(PDAC)、皮肤黑色素瘤(SKCM)、子宫内膜癌(UCEC)、卵巢癌(OV)、乳腺癌(BRCA)、多发性骨髓瘤(MM)、胶质母细胞瘤(GBM)、透明细胞肾细胞癌(ccRCC)等。
跨癌种比较确定了56001个组织和癌细胞特异性的差异可及染色质区域(DACR),许多DACR包括组织特异性的基因启动子,例如鳞癌中的角蛋白基因、OV和UCEC中的PAX8、非基底样BRCA中的GATA3、GBM中的PTRZ1等。
同一原发组织的癌种之间存在相似性,如头颈部鳞状细胞癌(HNSCC)和宫颈鳞状细胞癌(CESC)共聚类,非鳞状宫颈癌与上皮癌类型聚类。
对比癌细胞和正常细胞,研究者们分别发现了22187个和29074个在癌细胞中可及性增加和降低的区域,75%的DACR与肿瘤的基因表达变化方向匹配。癌症类型特异性DACR包括GBM中的HOXA4、这是一个已知的不良预后因素,还有BRCA中的FGF19和ccRCC中的EGLN3,都是相应癌种的已知病理标志物。
研究者还进一步分析了原发癌和转移癌中的表观遗传改变,如原发癌中具有组织特异性的调节子,BRCA非基底癌中的FOXA1和GATA3、CESC和 HNSCC中的KLF4和FOSL1、ccRCC中的HNF1A和KLF9,以及CRC和PDAC中的HNF4G和GATA6。
对转移癌的分析对比了原代细胞和转移细胞之间的变化的转录因子基因和其可及性评分,观察到数个在转移细胞中可及性更高的基因,例如上皮间充质转化助调节因子TWIST1和PBX3,它们促进CRC转移。
最后,研究者筛选了具有潜在临床相关性的表观基因组。在TCGA-PDAC队列中,KLF6调节子活性增加与无进展生存期和总生存期差有关;类似的,GBM患者中,PITX3活性增加与无进展生存期差有关。
研究者还确定了可作为药物靶点的癌症特异性DEG和DACR,如已经广为人知的BRCA和UCEC中的ESR1表达和可及性,以及ccRCC和CRC中的VEGFA可及性;此外也发现了目前尚未应用于临床的潜在靶点,包括ccRCC中EGFR的可及性,UCEC、MM和ccRCC中的TOP1表达,以及GBM、ccRCC和基底样BRCA中FGFR2的表达。
了解整个肿瘤的染色质结构、癌症转化时染色质可及性的变化,以及染色质可及性、遗传改变和转录模式之间的相互作用,对于推进癌症生物学和临床实践至关重要。尽管转录因子本身很难用传统疗法靶向,但通过对转录程序的分析可以找到间接调控的方法。
参考资料:
[1]Terekhanova, N.V., Karpova, A., Liang, WW. et al. Epigenetic regulation during cancer transitions across 11 tumour types. Nature (2023). https://doi.org/10.1038/s41586-023-06682-5
文章来源:奇点网