俗话说,老而不死是为贼。
人体中的衰老细胞,就可以说是这个“贼”。毕竟它们已经老到不干任何正事儿了,但仍旧保持着旺盛的代谢活动,尤其是分泌许多促炎细胞因子和趋化因子,这种表型被称为衰老相关分泌表型(SASP)。
其实衰老细胞不仅来自于光阴,除了细胞不断增殖传代导致的复制性衰老(RS),癌基因激活会诱导细胞衰老(OIS),治疗性损伤也会引起细胞衰老(TIS)。
不过,无论衰老来自何处,SASP带来的影响大多都是有害的,会增加疾病的发生并带来死亡。
那么有没有办法暂停细胞衰老的脚步,让它们重回“青春”呢?
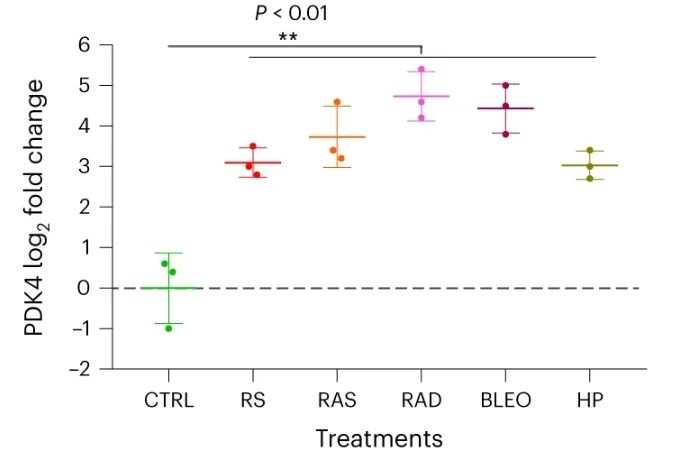
今日,中国科学院上海营养与健康研究所孙宇、华东理工大学药学院赵玉政课题组在《自然·代谢》杂志上发表论文,研究者们找到了衰老细胞代谢重编程的关键酶,丙酮酸脱氢酶激酶4(PDK4)。衰老细胞会表现出PDK4依赖的有氧糖酵解和乳酸生成增加,并促进癌细胞的生长;抑制PDK4则能够导致肿瘤消退。
同时,抑制PDK4可以降低DNA损伤的严重程度并抑制SASP。在小鼠中,抑制PDK4可以缓解衰老导致的身体功能障碍并预防生命晚年的虚弱。
研究者们注意到,人类前列腺来源的基质细胞系PSC27,会在暴露于细胞毒性损伤时产生大量SASP因子,与此同时PDK4的表达也上升。使用其他的方法诱导细胞衰老,也能观察到伴随着SASP表型的出现,PDK4表达增加了。
这个观察在另一个人类乳腺癌(BCa)队列中得到了验证。研究者认为,与之前普遍在癌细胞中进行的研究不同,肿瘤微环境中的PDK4表达可能是一种SASP相关的临床预后独立预测因子,可以用于预测疾病复发和死亡的风险。
考虑到PDK4潜在的作用机制,它或许也能够成为药物的靶点。
对衰老细胞的代谢分析显示,衰老细胞表现出独特的葡萄糖代谢谱,葡萄糖转运蛋白和糖酵解酶表达增加,糖酵解、TCA循环和氧化磷化活性增强,产生的乳酸量增加,总体表现为一种过度代谢状态。
在这个代谢转变中,PDK4占据了核心地位。
将表达PDK4的基质细胞与癌细胞共培养,研究者发现,PC3前列腺癌细胞转录谱显著变化,信号转导、细胞通讯、细胞内运输、能量通路和代谢调节等通路受到显著影响。
接触到PDK4基质细胞之后,癌细胞的增殖、迁移和侵袭能力显著增强,并获得了对MIT的耐药性。
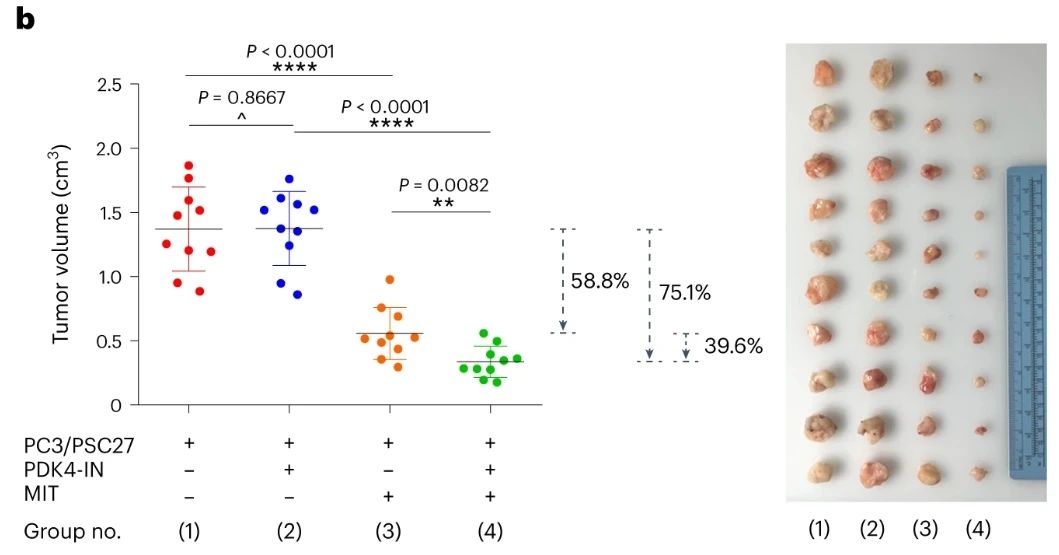
给小鼠皮下移植PDK4基质细胞和PC3癌细胞的混合物,联合使用PDK4抑制剂(PDK4-IN)和MIT治疗,能够显著抑制肿瘤的生长,且相较MIT单药治疗肿瘤体积缩小了39.6%。
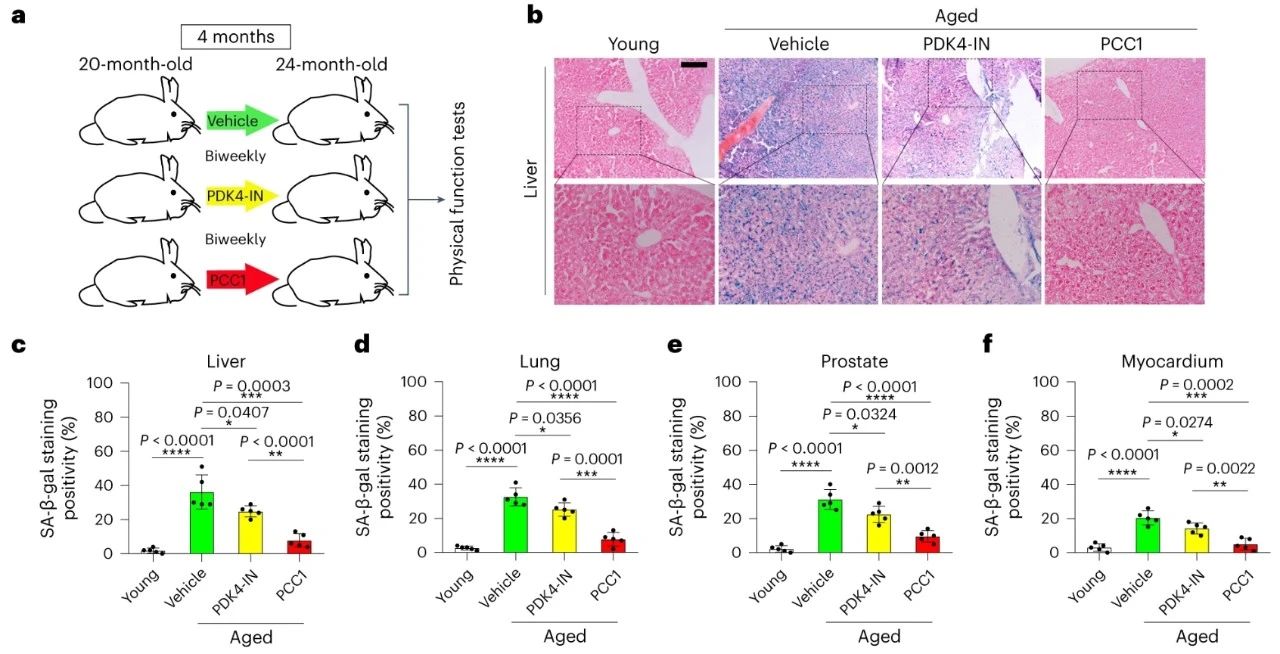
研究者给衰老小鼠腹膜内注射PDK4-IN(10mg/kg),每双周一次,持续4个月,随后分析组织中的新生衰老细胞,发现肝脏、肺、前列腺、心肌组织中的衰老细胞减少,效果比清除衰老细胞的PCC1略弱。
从小鼠25-26月龄开始PDK4-IN治疗,可将小鼠治疗后中位寿命延长29.6%,总寿命延长4.2%。而且这些多活的岁月里小鼠也比较健康,生命最后2个月的身体机能不明显低于对照组。
总而言之,靶向PDK4有明显的改善衰老和相关疾病的潜力,特别是针对衰老细胞过度产生乳酸导致的组织稳态和器官功能障碍。即使在生命晚期开始治疗,仍然能够观察到显著的延寿效果。
参考资料:
[1]Dou, X., Fu, Q., Long, Q. et al. PDK4-dependent hypercatabolism and lactate production of senescent cells promotes cancer malignancy. Nat Metab (2023). https://doi.org/10.1038/s42255-023-00912-w
文章来源:奇点网