一说起饿死癌细胞,大家脑子里可能都有个被饿得气息奄奄的癌细胞形象。
然而,实际上,对于癌细胞如何感知到葡萄糖水平降低,然后死亡,目前仍知之甚少。
今天,由厦门大学生命科学学院林圣彩领衔的研究团队,在著名期刊《细胞研究》发表了一项重要研究成果,首次揭示了细胞感知葡萄糖变化,进而影响细胞命运的分子机制[1]。
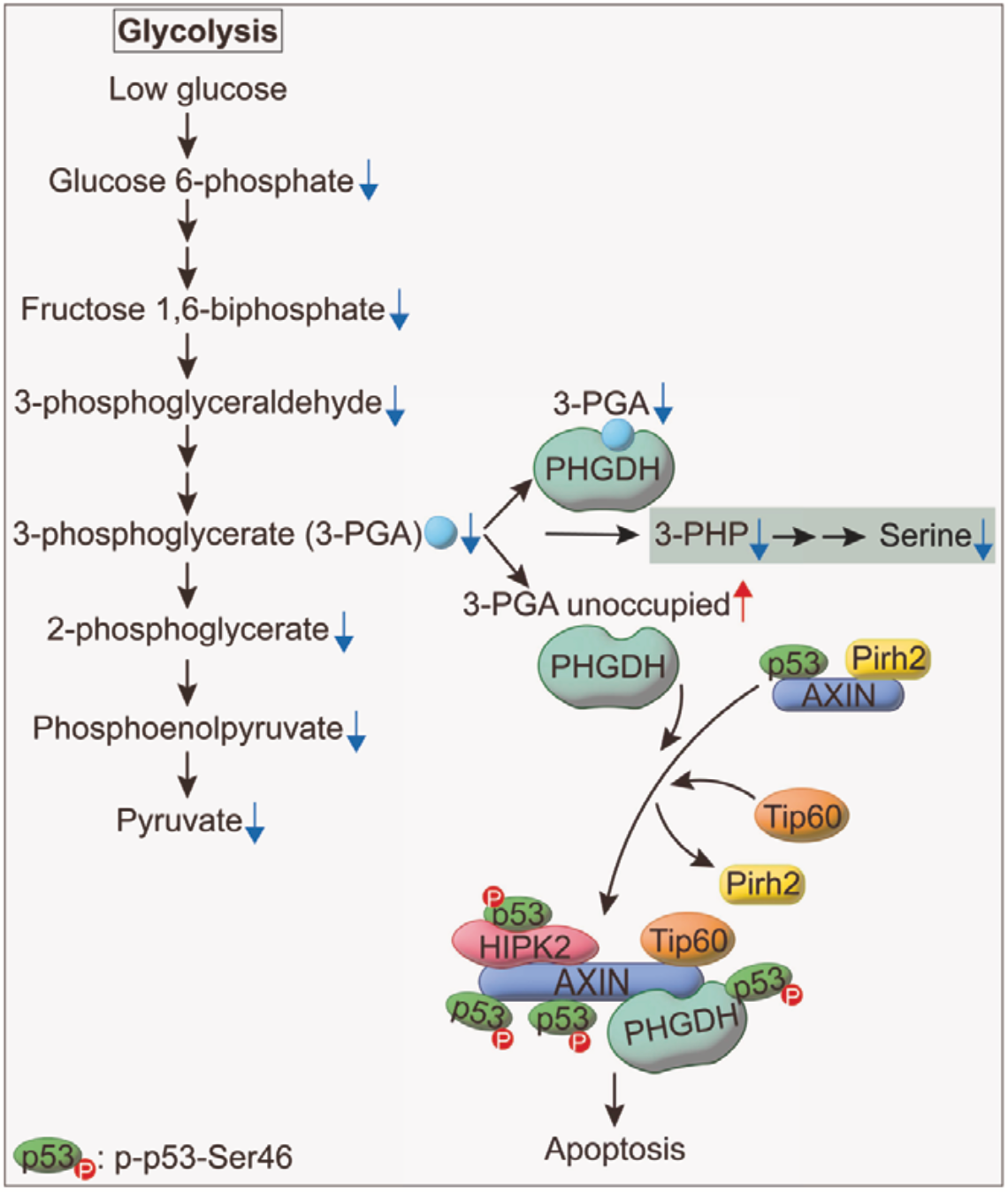
他们的研究发现,低水平的葡萄糖会导致糖酵解产生的3-磷酸甘油酸(3-PGA)减少,进而促进三磷酸甘油酸脱氢酶(PHGDH)与p53蛋白等分子结合,导致p53蛋白的第46位氨基酸被磷酸化,使p53获得促进细胞凋亡的功能,最终导致癌细胞的凋亡。
简单来说,PHGDH通过识别3-PGA水平的变化,感知到了葡萄糖水平的变化,进而将信号传递给p53蛋白,决定癌细胞的生死。他们还认为,这个研究发现的新机制,可能在癌症发生的早期等时间段,发挥清除癌细胞的功能。
这一新发现的机制可能也是热量限制能防癌的原因。所以啊,保持饥饿感也是一件好事儿。
论文首页截图
有大量的基础研究发现热量限制可以抑制肿瘤的生长。
还有一些研究将葡萄糖水平的变化,与肿瘤细胞中p53蛋白的水平和活性联系了起来。例如,葡萄糖限制会导致p53的水平升高和激活[2,3]。
从p53激活的角度来说,第15和20位丝氨酸被磷酸化之后,会维持p53的稳定性,进而导致细胞周期停滞,肿瘤生长停止[4]。这也是热量限制抑制肿瘤生长的原因之一。
不过,p53还有一个更强劲的抗癌功能,那就是诱导细胞凋亡。激活这一功能,需要磷酸化p53的第46位丝氨酸。然而,目前还不清楚葡萄糖及其糖酵解代谢产物,是否可以激活p53的这一功能。
林圣彩团队首先证实,5mM以下浓度的葡萄糖确实会导致p53第46位丝氨酸的磷酸化特异性增加。
既然如此,那究竟是葡萄糖自身,还是其代谢产物影响了p53第46位丝氨酸的磷酸化呢?
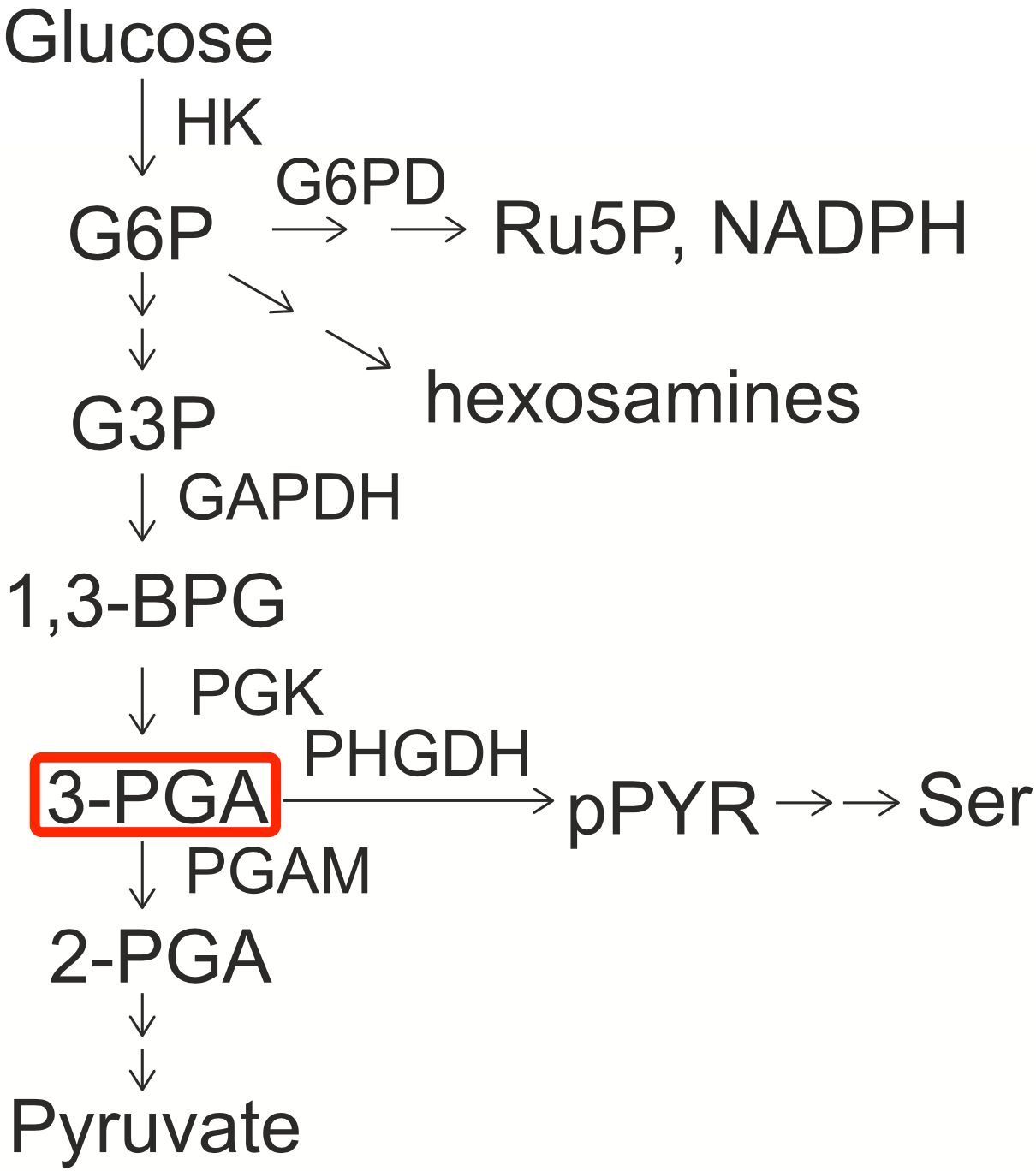
他们围绕糖酵解通路展开了地毯式排查,最后确定不是葡萄糖,而是其代谢产物3-磷酸甘油酸(3-PGA)在调节p53第46位丝氨酸的磷酸化。
糖酵解路径
接下来的问题是:究竟是谁通过3-PGA感知到了血糖的变化,最终调节了p53第46位丝氨酸的磷酸化。
三磷酸甘油酸脱氢酶(PHGDH)从免疫共沉淀实验中脱颖而出。后续实验证实,PHGDH不仅能与3-PGA结合,而且还能与p53蛋白发生直接的相互作用。
更重要的是,低葡萄糖水平会增强PHGDH与p53的相互作用,而加入3-PGA后,PHGDH与p53的相互作用就会被抑制。
不过,需要注意的是,PHGDH作为一种酶,具有催化活性,是催化3-PGA合成丝氨酸的关键酶。因此,要搞清楚究竟是PHGDH的结合能力,还是它的催化能力在影响p53的磷酸化。
于是,林圣彩团队构建了PHGDH的多种突变体,有的只具有结合能力而失去催化能力,有的则完全失去结合能力。实验结果显示,作为3-PGA的直接感受器,PHGDH将低葡萄糖信号传递给p53只需要其结合能力,而与催化活性无关。
这一发现与之前的认知相反。之前有研究认为,PHGDH通过其催化作用,促进丝氨酸的合成,进而促进肿瘤的生长[5,6]。而这个研究发现,PHGDH的结合功能可以通过p53调节肿瘤的生长。
随着认知被刷新而来的,是PHGDH与3-PGA的结合究竟如何影响了p53第46位丝氨酸的磷酸化。
就在此时,林圣彩团队的注意力落在了20年前的一个研究上。
2004年,他们发现,紫外线诱导的DNA损伤,会导致乙酰转移酶TIP60和激酶HIPK2结合到支架蛋白AXIN上,它们仨再与p53结合,形成一个复合物(AXIN-TIP60-HIPK2-p53),由HIPK2完成对p53第46位丝氨酸的磷酸化[7]。
那么,由PHGDH感知葡萄糖变化引起的p53磷酸化,会在此处与紫外损伤引起的p53磷酸化汇合么?
实验数据表明,二者确实汇合了。
在低葡萄糖水平下,细胞中的TIP60、HIPK2和AXIN水平都上升了。无论是破坏AXIN还是HIPK2,低葡萄糖水平都不能提高p53第46位丝氨酸的磷酸化水平。
在后续的研究中,林圣彩团队很快就发现,PHGDH与3-PGA的结合会阻止PHGDH与AXIN的结合,进而抑制了AXIN-TIP60-HIPK2-p53的形成,阻止p53第46位丝氨酸被磷酸化;而在葡萄糖水平较低的情况下,则相反。
至此,葡萄糖水平调节p53第46位丝氨酸的磷酸化水平,进而影响其调节细胞凋亡的机制就搞清楚了。
机制示意图
在研究的最后,林圣彩团队在肝癌小鼠模型中验证了上述机制的存在。值得一提的是,在肝癌患者的肿瘤组织中,也可以观察到3-PGA与p53第46位丝氨酸磷酸化水平之间的负相关性。
总的来说,林圣彩团队的这个研究表明,生理性低血糖可自主启动PHGDH-AXIN-TIP60-HIPK2-p53复合体的形成,导致p53第46位丝氨酸磷酸化水平增加,进而诱发细胞凋亡。
值得注意的是,已经有研究发现高血糖与肝癌发生有关[8],而热量限制饮食可以降低肝癌的发生风险[9]。这个发现在一定程度上也解释了这些现象。
参考文献:
[1].Wu YQ, Zhang CS, Xiong J, et al. Low glucose metabolite 3-phosphoglycerate switches PHGDH from serine synthesis to p53 activation to control cell fate. Cell Res. 2023. doi:10.1038/s41422-023-00874-4
[2].Shim HS, Wei M, Brandhorst S, Longo VD. Starvation promotes REV1 SUMOylation and p53-dependent sensitization of melanoma and breast cancer cells. Cancer Res. 2015;75(6):1056-1067. doi:10.1158/0008-5472.CAN-14-2249
[3].Krstic J, Reinisch I, Schindlmaier K, et al. Fasting improves therapeutic response in hepatocellular carcinoma through p53-dependent metabolic synergism. Sci Adv. 2022;8(3):eabh2635. doi:10.1126/sciadv.abh2635
[4].He G, Zhang YW, Lee JH, et al. AMP-activated protein kinase induces p53 by phosphorylating MDMX and inhibiting its activity. Mol Cell Biol. 2014;34(2):148-157. doi:10.1128/MCB.00670-13
[5].Zhao JY, Feng KR, Wang F, et al. A retrospective overview of PHGDH and its inhibitors for regulating cancer metabolism. Eur J Med Chem. 2021;217:113379. doi:10.1016/j.ejmech.2021.113379
[6].Shunxi W, Xiaoxue Y, Guanbin S, Li Y, Junyu J, Wanqian L. Serine Metabolic Reprogramming in Tumorigenesis, Tumor Immunity, and Clinical Treatment. Adv Nutr. 2023;14(5):1050-1066. doi:10.1016/j.advnut.2023.05.007
[7].Rui Y, Xu Z, Lin S, et al. Axin stimulates p53 functions by activation of HIPK2 kinase through multimeric complex formation. EMBO J. 2004;23(23):4583-4594. doi:10.1038/sj.emboj.7600475
[8].Han H, Zhang T, Jin Z, et al. Blood glucose concentration and risk of liver cancer: systematic review and meta-analysis of prospective studies. Oncotarget. 2017;8(30):50164-50173. doi:10.18632/oncotarget.16816
[9].Li WQ, Park Y, McGlynn KA, et al. Index-based dietary patterns and risk of incident hepatocellular carcinoma and mortality from chronic liver disease in a prospective study. Hepatology. 2014;60(2):588-597. doi:10.1002/hep.27160
文章来源:奇点网