许多免疫细胞平时兢兢业业,但却会在癌症发生发展的进程中被“带坏”,成为导致肿瘤微环境呈免疫抑制状态,让T细胞等抗癌主力难以起效的帮凶。估计像奇点糕一样,很多人都对此痛心疾首吧。
人体抗击感染的主力——中性粒细胞,就常常会沦为癌症的帮凶,此时它们又被称为“病理性激活的中性粒细胞”,或按照细胞形态和来源被命名为多核髓系来源的免疫抑制细胞(PMN-MDSCs),且占全部MDSCs的90%以上[1]。
近些年来,MDSCs抑制T细胞抗癌能力、限制免疫检查点抑制剂疗效的作用日益明确,让它们成了科学家、医生和患者的眼中钉、肉中刺,如果能精准高效地打击PMN-MDSCs,无疑将是癌症免疫治疗的强心针。
今天,复旦大学生物医学研究院罗敏/卢智刚/高海团队和中国科学院分子细胞科学卓越创新中心赵允团队合作,在《自然》发表的最新研究成果,就揭示了PMN-MDSCs表面调控免疫抑制功能的关键受体——CD300ld,针对它进行干预能有效逆转微环境免疫抑制,并与免疫治疗实现协同增效、广谱抗癌[2]!
论文首页截图
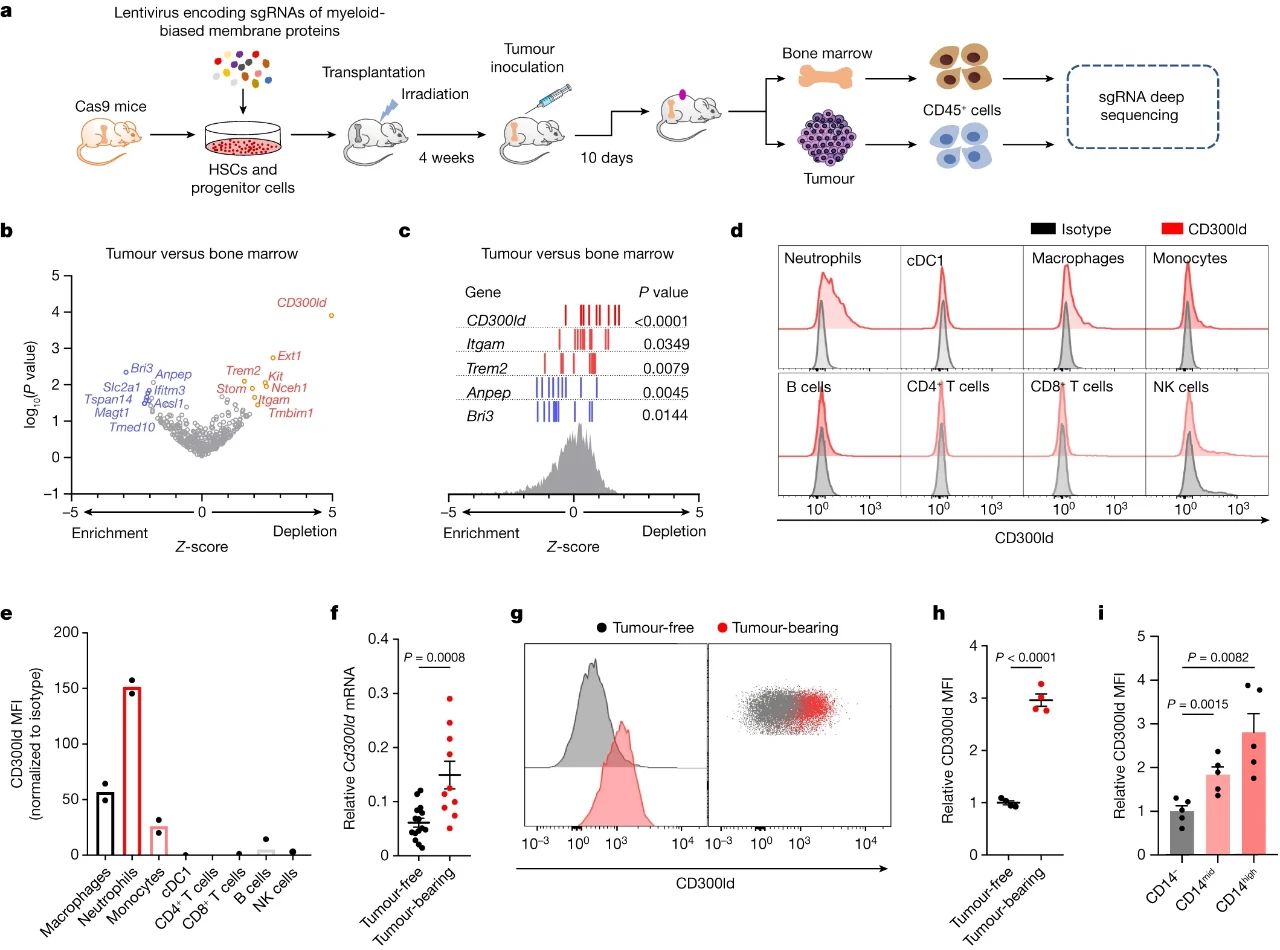
为找到识别PMN-MDSCs的标志物,研究者们首先对比了MDSCs和常规淋巴细胞的转录组图谱,筛选出MDSCs更偏向表达的蛋白,再使用CRISPR-Cas9技术在小鼠体内进行筛选,以此寻找影响MDSCs向肿瘤部位迁移和功能的关键位点。
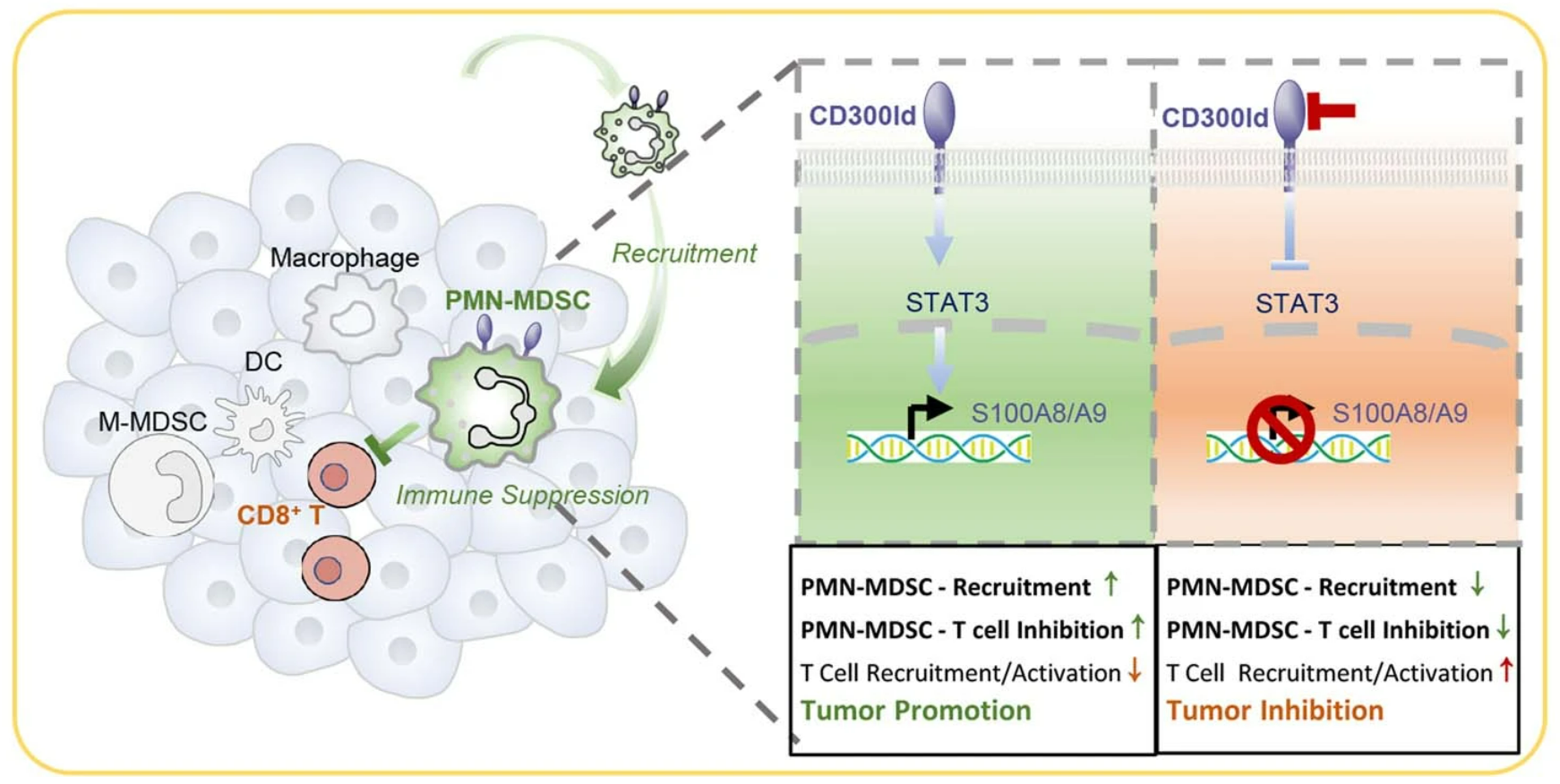
筛选结果表明,CD300ld是MDSCs最偏向表达的蛋白,且缺少CD300ld的髓系和淋巴细胞,在肿瘤微环境中的相对缺失(对比骨髓)最显著,这说明表达CD300ld的细胞会被特异性招募到肿瘤部位,它们很可能就参与了免疫抑制。
借助CRISPR-Cas9技术筛选出CD300ld的过程,及CD300ld的作用
进一步分析显示,表达CD300ld的基本仅限髓系细胞,尤其是中性粒细胞表面存在高表达,且这部分中性粒细胞也确实是PMN-MDSCs(特征为表达CD14);而敲除掉CD300ld并不会影响小鼠的正常发育。
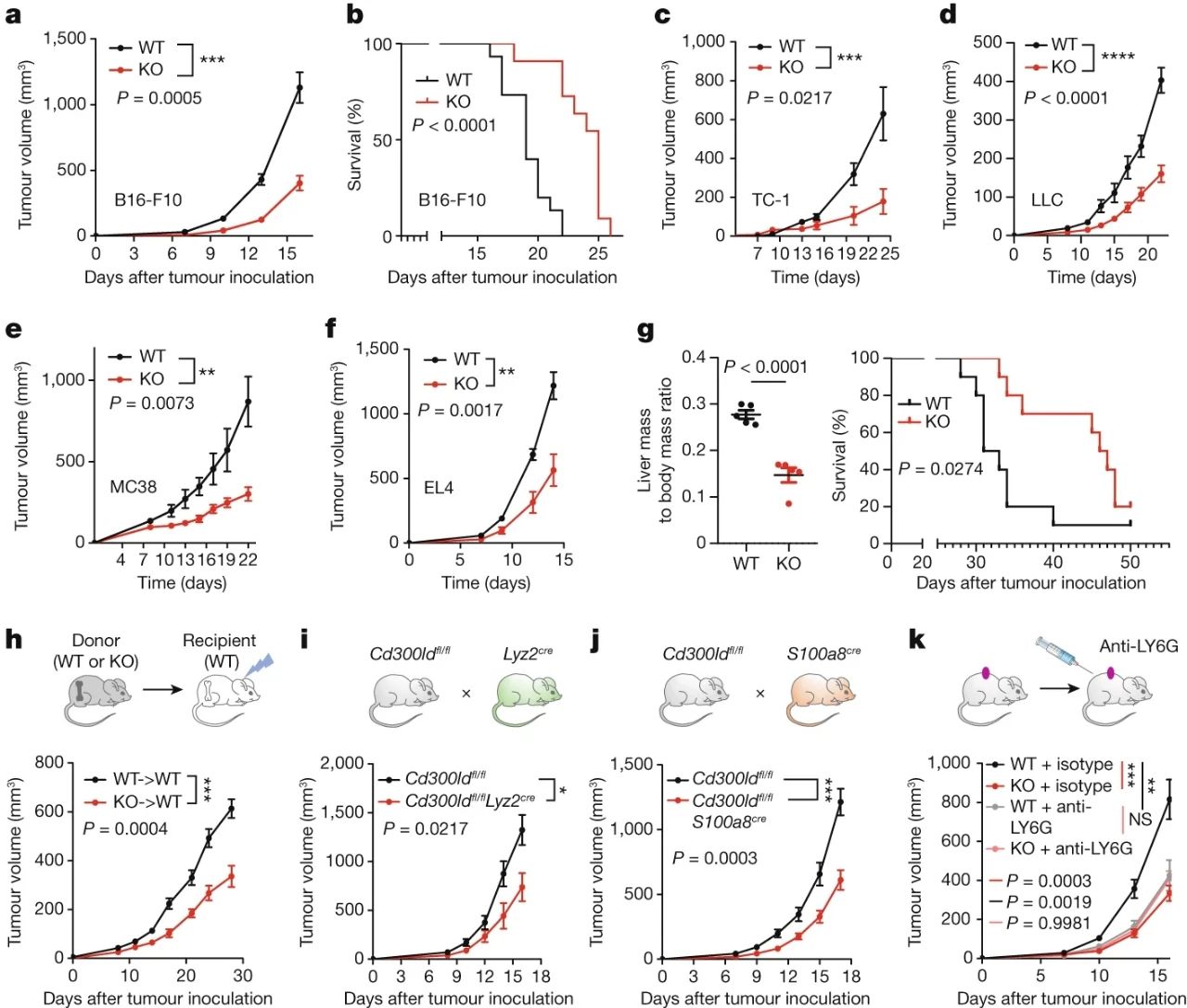
将肿瘤移植到CD300ld敲除小鼠的体内后,肿瘤体积相比未敲除CD300ld小鼠体内的肿瘤减小了65%,意味着敲除CD300ld就可有效抑癌,且与专门定向清除PMN-MDSCs的效果基本相当,那CD300ld和PMN-MDSCs的关系就很明确了。
敲除CD300ld的抑癌作用
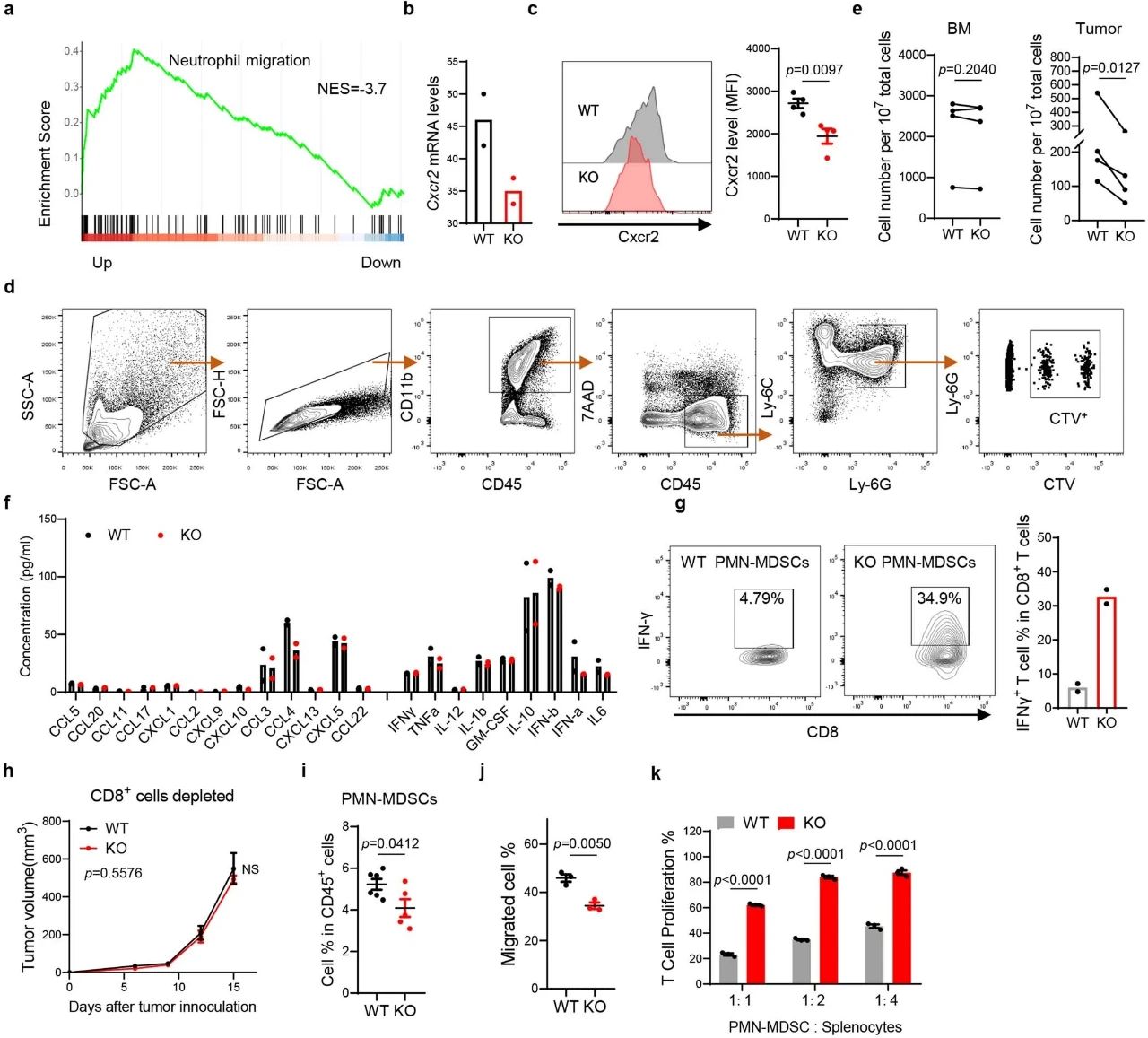
那么敲除CD300ld是怎么起效的呢?前面奇点糕提到,表达CD300ld的PMN-MDSCs会被特异性招募到肿瘤部位,这是因为CD300ld对PMN-MDSCs的迁移和募集至关重要,敲除掉CD300ld就使微环境内的PMN-MDSCs大幅减少,STAT3和钙结合蛋白S100A8/A9是这一过程的关键下游效应因子。
在PMN-MDSCs减少的同时,肿瘤微环境中调节性T细胞(Treg Cells)等免疫抑制性细胞也减少了。而此消彼长,CD8+/CD4+T细胞和NK细胞等免疫效应细胞就增多了,它们身上的枷锁也少了很多,例如CD8+T细胞的激活和迁移能力就显著增强,这些抗癌主力既有数量又有质量,就使肿瘤微环境更有利于免疫治疗。
此外,敲除CD300ld也会直接削弱PMN-MDSCs本身的免疫抑制功能,例如PMN-MDSCs抑制T细胞功能的关键分子ARG1,就在敲除CD300ld后表达显著下调,而将CD8+T细胞与PMN-MDSCs共培养时,敲除CD300ld会使表达IFN-γ的T细胞数量足足增加6倍。
敲除CD300ld可直接削弱PMN-MDSCs的免疫抑制功能
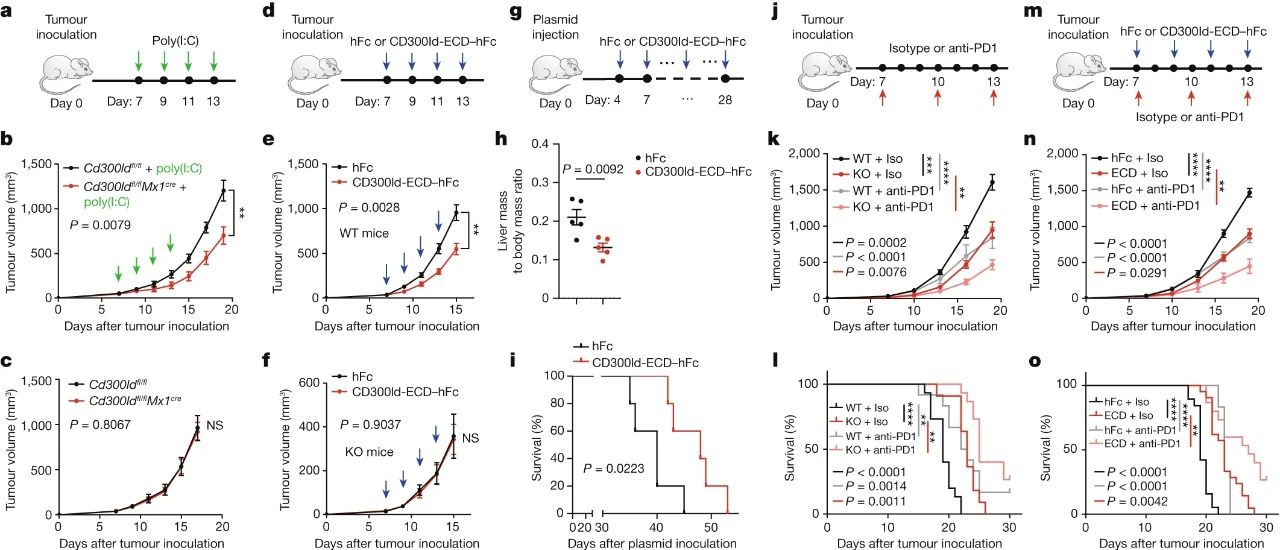
即使在肿瘤形成之后,再用药物阻断CD300ld表达,也仍然能显著抑制肿瘤生长。而从药物研发角度考虑,鉴于CD300ld是一种单链跨膜蛋白,研究者们尝试利用其胞外结构域(ECD)进行竞争性抑制,也取得了显著的抑癌效果,而且敲除CD300ld或针对ECD竞争性抑制,还能与PD-1抑制剂成功协同增效。
敲除CD300ld或针对ECD竞争性抑制,可与PD-1抑制剂协同增效
最后,研究者们借助癌症基因组图谱计划(TCGA)等数据库资料和患者/健康人样本,确定CD300ld在人体PMN-MDSCs也存在特异性高表达,且与中性粒细胞浸润及多种癌症患者的生存预后显著相关,实锤了CD300ld作为治疗靶点的价值。希望针对CD300ld的药物研发能尽快启动,早日降伏作恶多端的PMN-MDSCs!
参考文献:
[1]商文聪,杨荣存. 髓系免疫抑制细胞的研究进展[J]. 中国免疫学杂志, 2016, 32(6): 922-929.
[2]Wang C, Zheng X, Zhang J, et al. CD300ld on neutrophils is required for tumour-driven immune suppression[J]. Nature, 2023.
文章来源:奇点网