1967年Wolf教授在血浆中第一次发现细胞外囊泡(Extracellular vesicles,EVs),而外泌体(Exosomes)就属于EV的一种。50余年来,随着分子生物学检测技术尤其是高通量二代测序技术的发展,外泌体作为新型液体活检标志物的研究也飞速崛起,其携带的标志物与许多疾病的发生发展密切相关,具有作为疾病早期诊断、治疗监测、预后判断、用药指导等潜在的临床价值,与传统病理诊断相比具有许多优势。并且,利用外泌体进行靶向治疗和作为药物载体与传统治疗手段相比也具有许多优势。美国抗衰老医学研究会主席Klatz博士称:“外泌体是干细胞技术的下一个发展方向”。
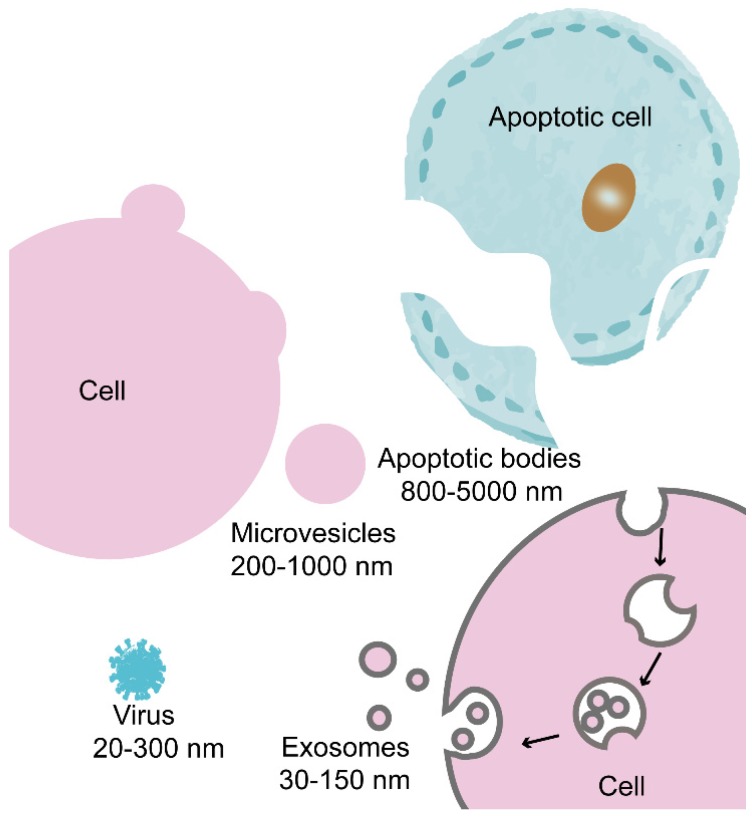
图2 凋亡小体、微泡和外泌体的生物发生示意图(He et al., 2018)。
值得注意的是,三种EVs中,外泌体的平均粒径最小、均一度最高[粒径分布范围最窄]、组成最为复杂、功能最为多样。因而,理论和应用价值最高。目前还没有精确的方法来区分和分离外泌体与其他EVs,在学术论文和日常交流中研究人员往往将外泌体与EVs混用。
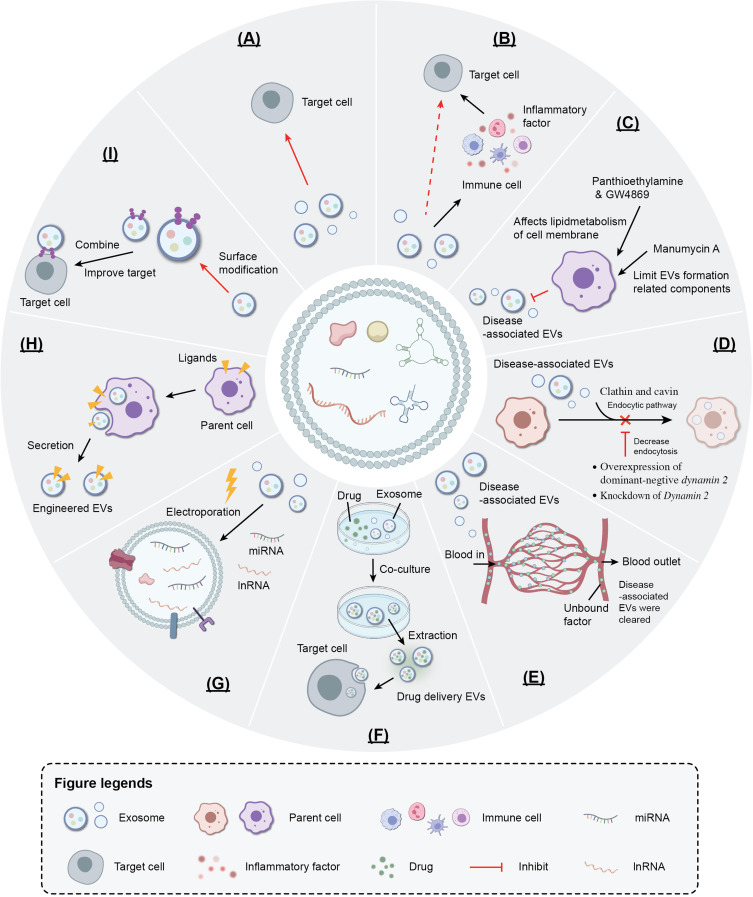
一般来说,外泌体和靶细胞之间的相互作用涉及两种机制。在某些情况下,外泌体可通过微胞饮作用或内吞作用进入靶细胞,或者它们与细胞膜融合并释放其货物以激活各种信号通路。或者,外泌体通过表面上的配体-受体结合与受体细胞相互作用,以刺激级联反应。无论涉及哪种机制,外泌体的特异性结合或积累都赋予了其递送广泛分子的潜在靶向能力。
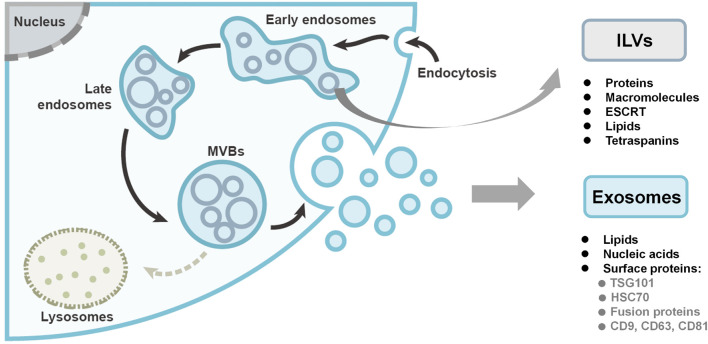
根据高通量外泌体研究,外泌体含有大量分子,包括蛋白质、脂质、代谢物、mRNA、线粒体DNA、miRNA和许多其他非编码RNA。此外,还有三个外泌体数据库提供了有关外泌体内部分子的详细信息:ExoCarta、EVpedia和Vesiclepedia(He et al., 2018)。外泌体的大小和货物是异质的,即使它们来自同一细胞;然而,在不同来源的外泌体中发现了一些部分常见的货物,即蛋白质与核酸。
由于外泌体在体液中广泛存在和易获得性等特点,除了上述在诊断液体活检中有优秀表现,外泌体在疾病治疗方面也具有潜在的应用价值。一些研究表明,外泌体可以促进细胞再生和修复,可以用于肝、肾等器官的再生治疗。此外,外泌体还可以用于治疗呼吸系统、神经系统和免疫系统疾病等。2022年Chu等人发表的文章,就证明了雾化吸入间充质干细胞来源的外泌体是治疗新冠肺炎的一种新方法。因为研究发现雾化吸入间充质干细胞来源的外泌体不会引起急性过敏或继发性过敏反应,不仅促进了肺部病变的吸收,并且缩短了轻度新冠肺炎患者的住院时间。
比如Chang等人发表的文章,证明肺腺癌(Lung Adenocarcinoma,LUAD)细胞来源的外泌体miR-197-3p通过靶向LUAD转移中的TIMP2/3赋予血管生成。因此,外泌体miR-197-3p可能是LUAD抗血管生成治疗的有希望的预后生物标志物和治疗靶点。再比如Wang等人的研究发现从肿瘤细胞中分离的细胞核引入活化的M1样巨噬细胞以产生嵌合外泌体(aMT-exos),在多种动物模型上显著抑制了肿瘤进展,为肿瘤免疫治疗带来了新思路。
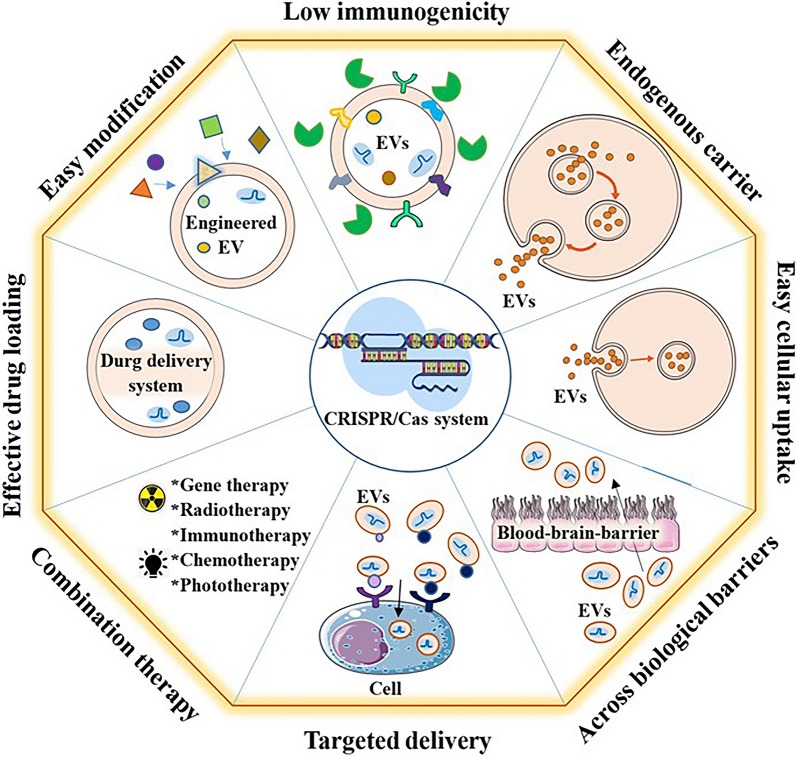
在之前的“CRISPR/Cas9基因编辑技术的应用”一文中,小医向大家介绍了CRISPR/Cas9基因编辑技术在肿瘤治疗方面的优势与发展。然而,作为体内传递CRISPR/Cas的主要工具,病毒载体存在包装限制、免疫原性、致癌性、规模化生产和Cas表达寿命等方面的局限性。非病毒载体还面临各种挑战,包括快速清除、有问题的生物相容性、毒性/免疫原性以及治疗性货物释放的潜在问题。而EV代表一种有前途的CRISPR/Cas9组件替代递送载体,可规避其他载体的局限性。基于EVs的CRISPR/Cas系统递送系统的优点如图4所示。因此,天然EV载体可能是递送CRISPR/Cas9组件的有效工具。然而,由于许多外源和内源障碍,EVs介导的CRISPR/Cas组分的转运效率仍然不足。尽管EV介导的基因编辑仍面临多重技术障碍,但在解决这些基本问题后,基于EV的CRISPR/Cas传递系统将会显示出安全、高效的巨大前景,在众多领域充分发挥其潜力。
Chen H, Wang L, Zeng X, et al. Exosomes, a New Star for Targeted Delivery. Front Cell Dev Biol. 2021;9:751079.
Chu M, Wang H, Bian L, et al. Nebulization Therapy with Umbilical Cord Mesenchymal Stem Cell-Derived Exosomes for COVID-19 Pneumonia. Stem Cell Rev Rep. 2022 Aug;18(6):2152-2163.
He C, Zheng S, Luo Y, Wang B. Exosome Theranostics: Biology and Translational Medicine. Theranostics. 2018;8(1):237-255.
He J, Ren W, Wang W, et al. Exosomal targeting and its potential clinical application. Drug Deliv Transl Res. 2022;12(10):2385-2402.
Huang X, Li A, Xu P, et al. Current and prospective strategies for advancing the targeted delivery of CRISPR/Cas system via extracellular vesicles. J Nanobiotechnology. 2023;21(1):184.
Kumari M, Mohan A, Ecelbarger CM, et al. miR-451 Loaded Exosomes Are Released by the Renal Cells in Response to Injury and Associated With Reduced Kidney Function in Human. Front Physiol. 2020 Apr 8;11:234.
Wang S, Li F, Ye T, et al. Macrophage-tumor chimeric exosomes accumulate in lymph node and tumor to activate the immune response and the tumor microenvironment. Sci Transl Med. 2021 Oct 13;13(615):eabb6981.
Zhang Y, Dou Y, Liu Y, et al. Advances in Therapeutic Applications of Extracellular Vesicles. Int J Nanomedicine. 2023;18:3285-3307.