基因编辑(Gene editing),是一种新兴的比较精确的能对生物体基因组特定目标基因进行修饰的一种基因工程技术。基因编辑能够高效率地进行定点基因组编辑,故而在基因研究、基因治疗和基因育种等方面展示出了巨大的应用前景。
迄今为止,CRISPR/Cas9作为一种高效的基因编辑工具,广泛应用于科学界。基因编辑是一种对基因组序列进行精确修饰,以诱导基因组中的插入、缺失或碱基替换的技术。许多疾病都伴随着体内基因表达的改变,特别是一些由单个基因突变引起的遗传性疾病,基因编辑技术有望在基因水平上控制疾病的发生。
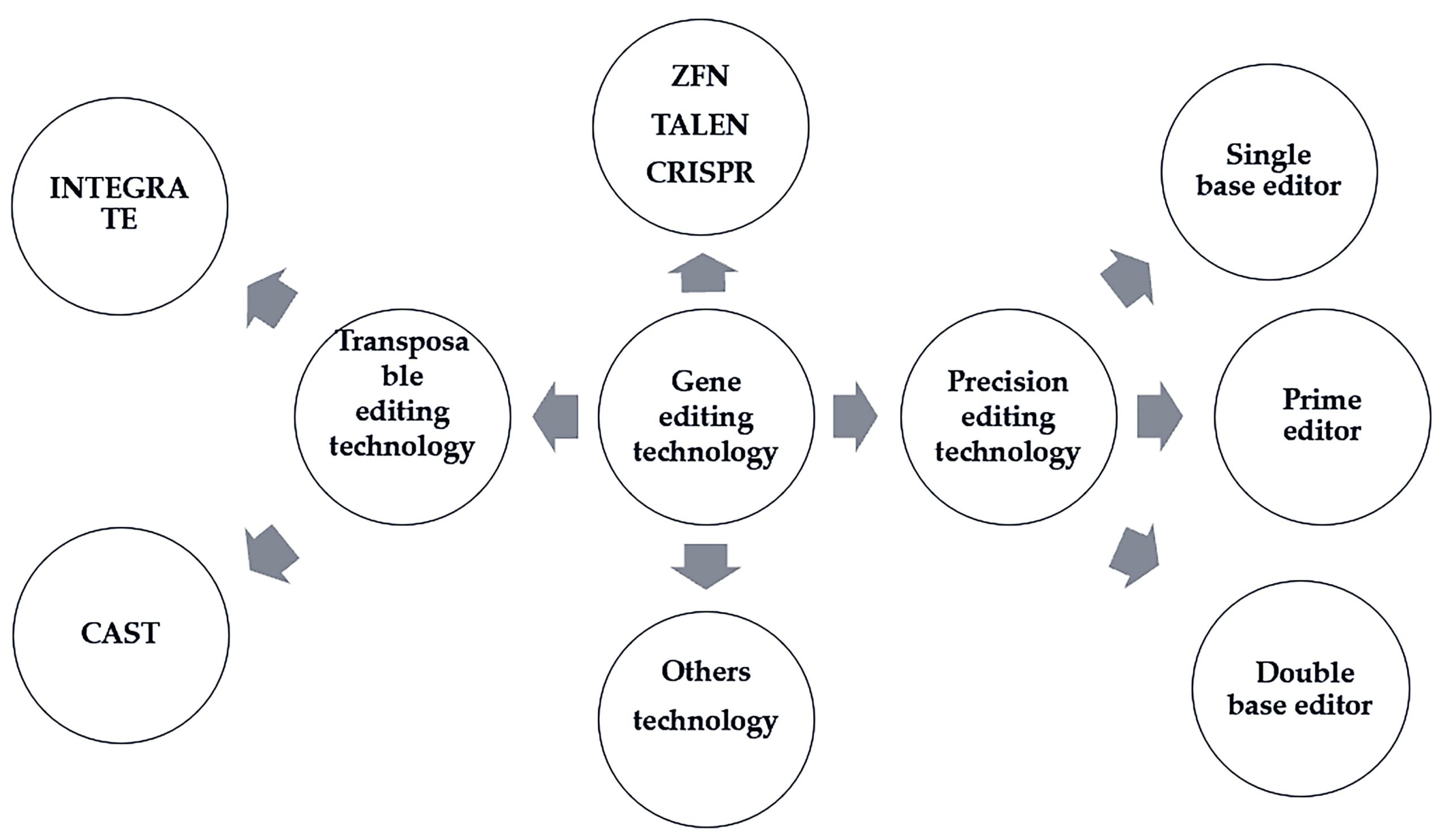
传统的基因编辑工具主要包括一代ZFN、二代TALEN和三代CRISPR技术,ZFN与TALEN技术都是使用包含DNA识别结合域和DNA切割域的核酸酶,但存在靶标识别率低、成本高、脱靶概率高和结构复杂等问题,因此,推动了三代CRISPR技术的发展。
▲基因编辑技术的发展(Huang et al., 2021)。
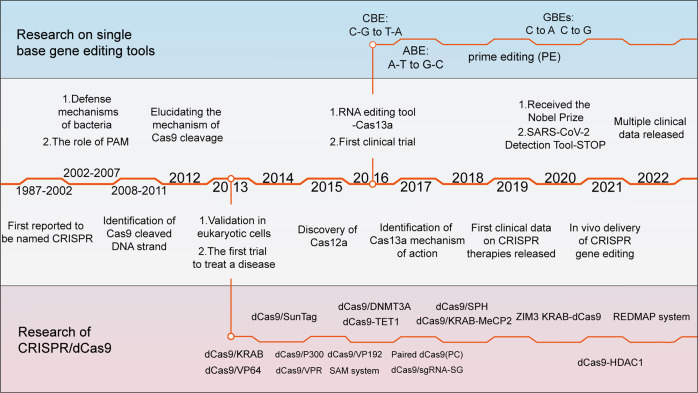
CRISPR相关的基因编辑技术是目前最热门的生物学工具之一。2013年以来,CRISPR技术研究呈爆发式增长,CRISPR相关文章发表数万篇,其发展史如图1所示。
今天我们要谈的便是目前具有成本低廉、操作方便、效率高等优点的基因组编辑技术之CRISPR/Cas9。我们将简单阐述CRISPR/Cas9技术的理论背景和主要应用,希望能对大家的研究有所启发。
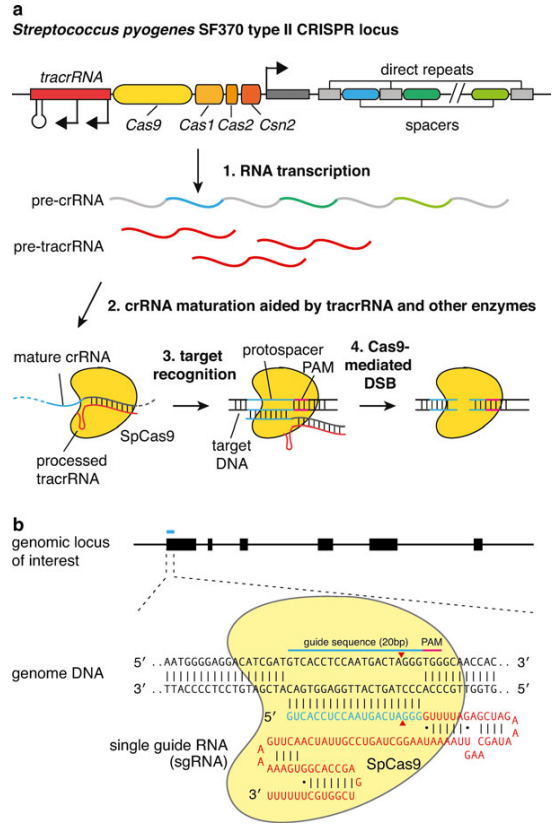
CRISPR/Cas9系统由两个主要成分组成:Cas9蛋白和向导RNA(guide RNA,gRNA)。Cas9蛋白含有RuvC1和HNH样核酸酶结构域,具有切割双链DNA的功能,使得双链DNA断裂。PAM基序是Cas9的识别位点,Cas9的PAM基序为5′-NGG。Cas9在PAM基序上游第3个碱基处切割双链DNA。crRNA和tracrRNA通过局部碱基配对组成gRNA,gRNA是一种小RNA分子,旨在与目标DNA中的特定靶序列结合。Jennifer Doudna和Emmanuelle Charpentier将crRNA和tracrRNA融合成一条RNA,并将其称为sgRNA。一旦sgRNA与其靶标结合,它就会招募Cas9蛋白,Cas9蛋白充当分子剪刀,在靶位点切割DNA。
CRISPR/Cas9的技术原理即利用一段与靶序列互补的gRNA引导Cas9蛋白对特异靶向DNA进行识别和切割,使DNA双链断裂,产生特异性DNA双链断裂(Double Strand Break,DSB)。DSB形成之后,会经细胞自身的非同源末端连接(NHEJ)或同源重组修复(HDR)对双链断裂进行修复,最终实现目标基因敲除、敲入和碱基编辑等基因组遗传修饰。但NHEJ很容易出错,因此,可在DSB形成后,向细胞内导入靶位点的同源序列作为修复模板,然后进行HDR,实现基因的精准编辑。
CRISPR/Cas9技术的第一个临床试验为将CRISPR/Cas9基因编辑的T细胞注射回患者体内,这是世界上首次向人类注射基因编辑的细胞,该研究表明了基因编辑技术临床应用的可行性和安全性,对于推动基因编辑技术的临床应用具有重要意义(Lu et al., 2020)。
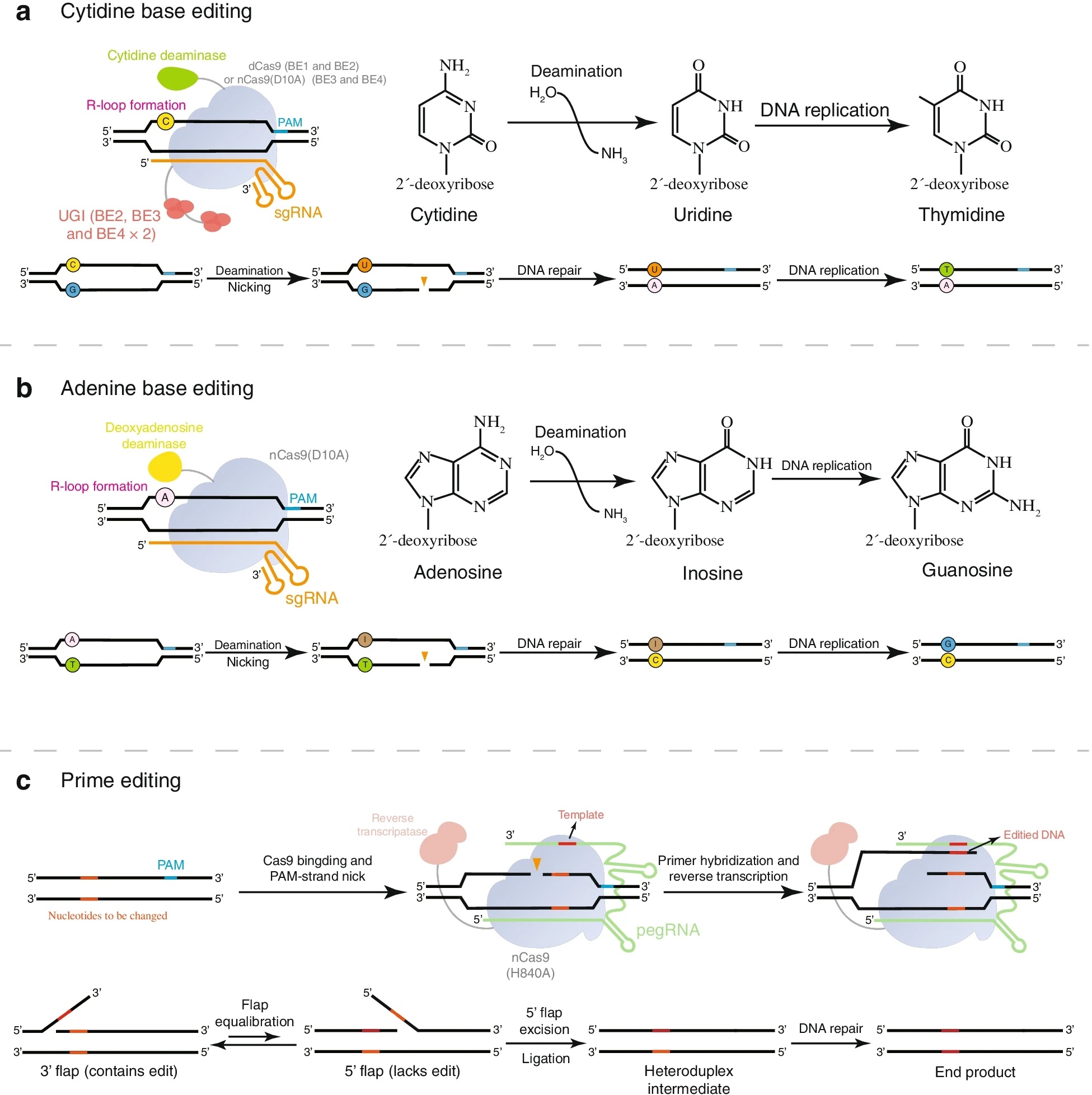
尽管CRISPR/Cas9通过切割双链进行重新修复,成功治愈了一些由点突变引起的疾病,但这种方法的低效性和不确定性限制了其应用。研究者认为遗传疾病的治疗应该纠正突变的碱基而不是切除它以允许随机重组,为单碱基基因编辑技术(CBE、ABE)以及PE的发明奠定了基础,其编辑原理如图2所示。
过继细胞疗法(ACT)是一种利用免疫细胞,尤其是T细胞来对抗肿瘤细胞的免疫治疗方法。肿瘤浸润淋巴细胞(TIL)疗法是最早的ACT之一。然而,ACT受到许多实际限制,包括难以从晚期癌症患者和婴儿中分离出足够的合格T细胞。目前正在研究的ACT方法主要有两种:嵌合抗原受体(CAR)-T细胞疗法和转基因T细胞受体(TCR)-T细胞疗法(图3)。
图3 ACT的三种主要方法以及CRISPR在肿瘤中的应用(Wang et al., 2022)。
1、CAR-T细胞疗法
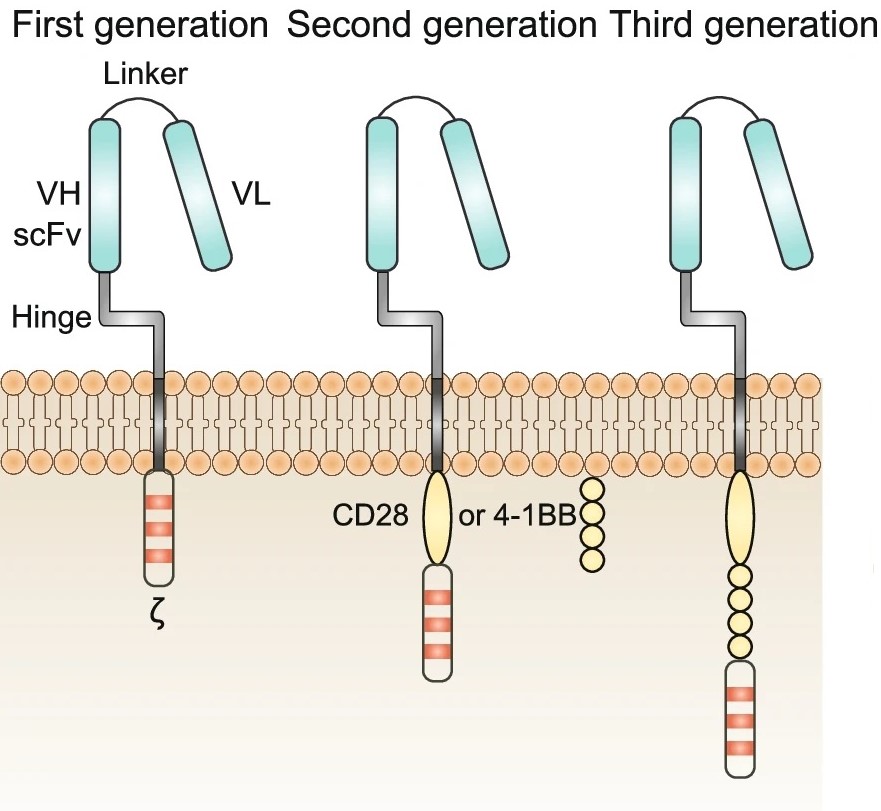
CAR是一种重组抗原受体,可以改变T淋巴细胞的特异性和功能,从而产生强大的抗肿瘤反应。CAR由与跨膜和细胞内信号区域融合的单链可变片段组成,通常具有一个或两个共刺激结构域(图4)。
图4 第一代至第三代CAR的结构(Wang et al., 2022)。
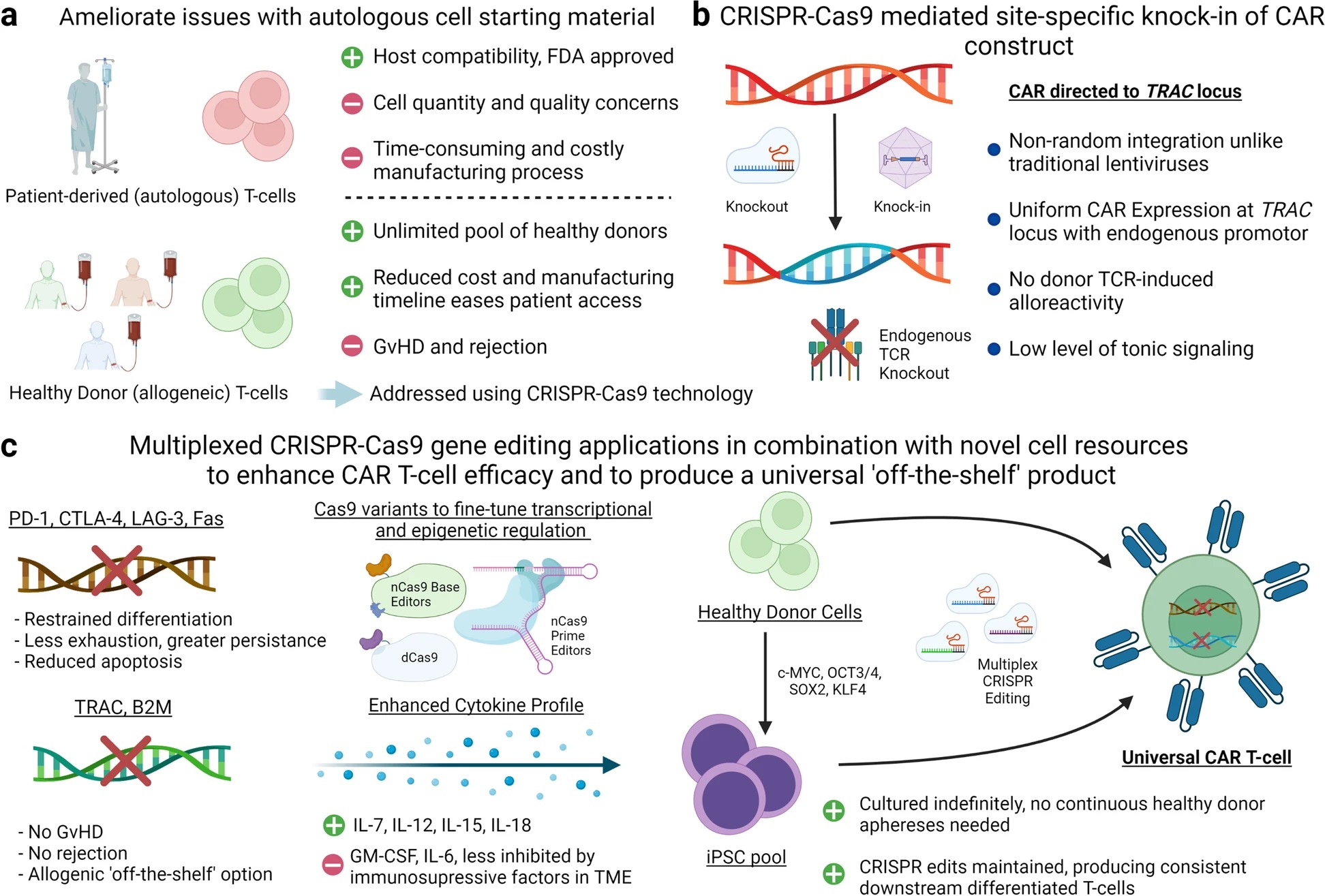
继2017年FDA批准两种自体CAR-T细胞疗法后,多项临床试验表明CAR-T细胞疗法对多种血液学和非血液学恶性肿瘤均有效,目前大多数临床试验使用自体CAR-T细胞,这些细胞从患者身上分离出来,经过基因编辑以表达CAR结构,然后在体外扩增并回输给患者,但这种方法不仅昂贵,而且患者T细胞数量和质量的差异可能会严重影响疗效。同时,CAR-T细胞疗法在实体瘤方面的疗效还有待研究,而凭借CRISPR/Cas9基因编辑的简便性和可访问性,可以解决其中的许多限制,因此,目前的研究工作重点是采用传统的CRISPR/Cas9系统或新型编辑器对CAR-T细胞进行编辑,使其可直接用于靶向T细胞功能的负调节因子,将治疗性转基因引导至特定的基因组位点,并生成可重复的安全且有效的同种异体通用CAR-T细胞产品,用于个性化肿瘤免疫治疗(图5)。
图5 CRISPR/Cas9编辑策略总结,以生成最有效且广泛使用的CAR-T细胞产品(Dimitri et al., 2022)。
临床试验表明,CAR-T细胞疗法在实体瘤中效果有限,主要是由于缺乏肿瘤特异性抗原、肿瘤异质性和抑制性免疫肿瘤微环境。与CAR类似,T细胞可以用定义的TCR进行修饰,使它们对特定的肿瘤抗原产生反应。研究显示,TCR-T细胞在免疫治疗中显示出巨大潜力,介于CARs可以识别糖脂和细胞表面蛋白等靶抗原,但位于细胞内并由MHC分子呈递的肿瘤特异性抗原远远多于细胞表面的肿瘤特异性抗原,这些抗原可以被TCR-T细胞识别,因此,TCR-T细胞疗法可能是治疗实体瘤的一种潜在方法。但TCR-T靶抗原谱有限,需要MHC分子进行抗原呈递,肿瘤细胞可通过下调MHC分子的表达水平来实现免疫逃逸,这已成为这种治疗的一大缺点。
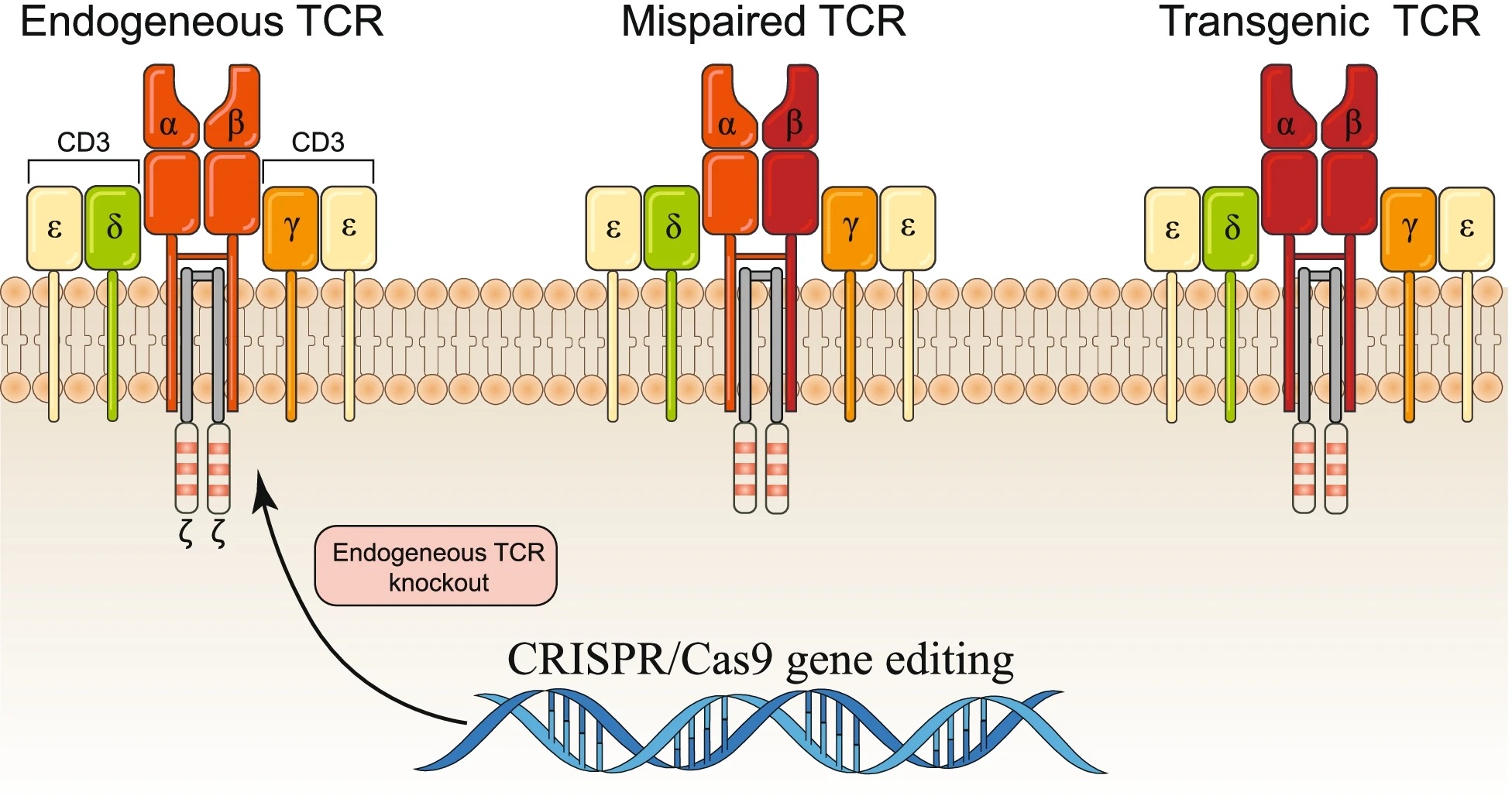
将外源性TCR引入T细胞引起的主要问题之一是受体T细胞上预先存在的内源性TCR,因为引入外源性TCR会导致形成新的反应性TCR二聚体,这些二聚体由引入的TCR链与内源性TCR α或β链配对组成,具有潜在的致病性并阻碍转基因TCR(tgTCR)的表达,内源性TCR和tgTCR之间对CD3分子的竞争进一步限制了tgTCR复合物的表达,这一系列问题可能会导致脱靶效应,从而导致治疗效果下降和致命的自身免疫。使用基因编辑工具介导内源性TCR α和β链基因的破坏是一种消除竞争的策略,已在原代T细胞中证明了可行性(图6)。2020年,第一期人体临床试验报告使用多重CRISPR/Cas9编辑靶向T细胞中的TRAC、TRBC和PDCD1以减少TCR错配并提高抗肿瘤免疫反应,并引入了合成的肿瘤特异性TCR转基因以识别肿瘤细胞,注入患者体内的工程化T细胞在体内持续存在长达9个月,初步表明TCR转移和基因组编辑的结合可能会开发出更有效和更安全的肿瘤免疫疗法。
Cong L, Zhang F. Genome engineering using CRISPR-Cas9 system. Methods Mol Biol. 2015;1239:197-217.
Dimitri A, Herbst F, Fraietta JA. Engineering the next-generation of CAR T-cells with CRISPR-Cas9 gene editing. Mol Cancer. 2022;21(1):78.
Huang S, Yan Y, Su F, et al. Research progress in gene editing technology. Front Biosci (Landmark Ed). 2021;26(10):916-927.
Li T, Yang Y, Qi H, et al. CRISPR/Cas9 therapeutics: progress and prospects. Signal Transduct Target Ther. 2023;8(1):36.
Lu Y, Xue J, Deng T, et al. Safety and feasibility of CRISPR-edited T cells in patients with refractory non-small-cell lung cancer. Nat Med. 2020;26(5):732-740.
Mali P, Yang L, Esvelt KM, et al. RNA-guided human genome engineering via Cas9. Science. 2013;339(6121):823-826.
Schwank G, Koo BK, Sasselli V, et al. Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell. 2013;13(6):653-658.
Wang SW, Gao C, Zheng YM, et al. Current applications and future perspective of CRISPR/Cas9 gene editing in cancer. Mol Cancer. 2022;21(1):57.