原理:
Annexin V可与磷脂酰丝氨酸(PS)特异性结合,因此,可以作为检测细胞早期凋亡的灵敏指标之一。但Annexin V无法区分坏死细胞(中晚期凋亡细胞)和早期凋亡细胞。而碘化丙啶(Propidium Iodide,PI)是一种核酸染料,不能透过细胞膜,但由于凋亡中晚期细胞和死细胞的细胞膜通透性增加,PI能够透过细胞膜而使细胞核染红;而早期凋亡细胞和活细胞的细胞膜仍然完整,PI无法进入。所以将Annexin V与PI联合使用,即可将处于不同凋亡时期的细胞区分开:活细胞(Annexin V–/PI–)、早期凋亡细胞(Annexin V+/PI–)、晚期凋亡细胞和坏死细胞同时被Annexin V和PI结合染色呈现双阳性(Annexin V+/PI+)。
图1 Annexin V/PI检测原理。
实验流程:
(1)收集细胞:在进行完细胞凋亡刺激后,用预冷的PBS洗涤细胞2次,4℃离心5min,(贴壁细胞使用不含EDTA的胰酶消化);
(2)重悬细胞:取1~5×105个重悬的细胞,离心弃掉PBS,加入Annexin V-FITC结合液轻轻重悬;
(3)染色:加入Annexin V-FITC和PI Staining Solution,轻轻混匀;
(4)孵育:避光、室温孵育10~15min,随后置于冰上;
(5)检测:①流式细胞仪检测,Annexin V-FITC为绿色荧光(激发波长488nm,发射波长525nm),PI为红色荧光(激发波长535nm,发射波长为615nm);②在荧光显微镜下用双色滤光片观察,Annexin V-FITC荧光信号呈绿色,PI荧光信号呈红色。
结果判断:
如图2所示,在二维散点图上,Annexin V是X轴,PI是Y轴,十字门将图片分为四个象限。其中根据Annexin V染色分为左右两部分,右侧(Q2/3)为Annexin V染色阳性;根据PI染色分为上下两部分,上方(Q1/2)为PI染色阳性。一般认为Annexin V单染的细胞是凋亡早期的细胞,PI单染的细胞是已经死亡的细胞,而双染是凋亡晚期的。
左上象限Q1:(Annexin V-FITC)–/PI+,此区域的细胞为坏死细胞。也可能有少数的晚期凋亡细胞在其中,甚至机械损伤的细胞也包含其中。
右上象限Q2:(Annexin V-FITC)+/PI+,此区域的细胞为晚期凋亡细胞。
右下象限Q3:(Annexin V-FITC)+/PI–,此区域的细胞为早期凋亡细胞。
左下象限Q4:(Annexin V-FITC)–/PI–,此区域的细胞为活细胞。
细胞凋亡率:Q2与Q3象限百分率的和。
优缺点:
1、简便、快速;
2、可准确区分活细胞、凋亡细胞和坏死细胞。
1、制备贴壁细胞样品时,容易因消化和吹打造成细胞额外损伤,从而夸大了实验结果,增加了数据变异度;
2、凋亡细胞的本底荧光或非特异染色的特性会增强,造成荧光飘移,导致定量不准。
原理:
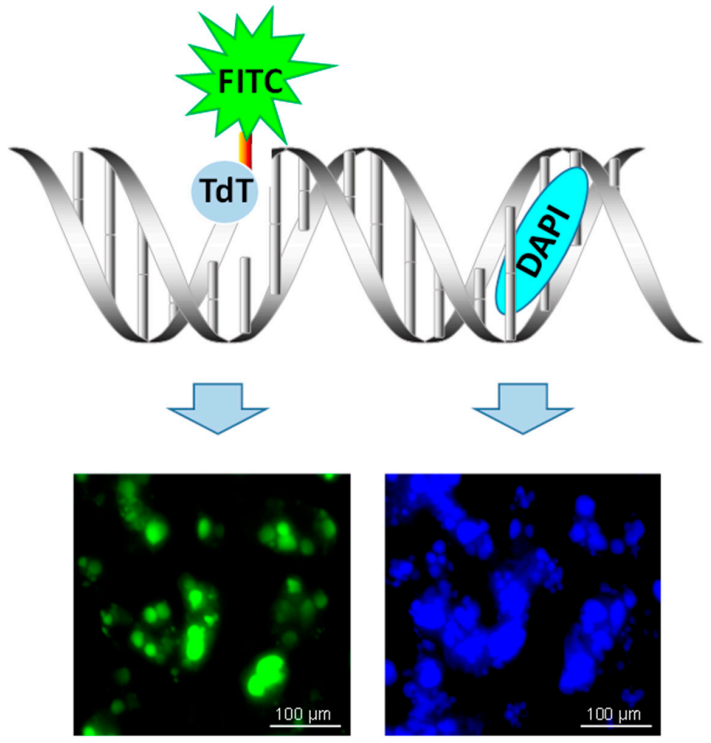
细胞在发生凋亡时会激活一些DNA内切酶,这些内切酶可以使染色体DNA双链断裂或单链断裂而产生大量的粘性3′-OH末端,可在脱氧核糖核苷酸末端转移酶(TdT)的作用下,将脱氧核糖核苷酸和荧光素、过氧化物酶、碱性磷酸酶或生物素形成的衍生物标记到DNA的3′-末端,从而可通过荧光显微镜或者流式细胞仪对凋亡细胞进行检测。
实验流程(以细胞样本为例):
(1)准备细胞爬片:PBS洗涤2次细胞爬片(贴壁细胞爬片),每次5min;
(2)细胞固定:用4%多聚甲醛固定细胞30~60min;
(3)细胞通透:加入破膜液破膜(Triton X-100)2次,每次5min,PBS清洗3次,每次2min;
(4)加TUNEL检测液:加入TUNEL检测液,37°C湿盒避光孵育60min。将细胞爬片浸入PBS中,室温放置5min,重复洗涤3次;
(5)检测:用抗荧光淬灭封片液封片后荧光显微镜下观察。
优点:
1、灵敏、快速、背景干扰小;
2、可直接使用在组织切片上,观察细胞凋亡发生的位置;
3、适用范围广泛,包含各类贴壁细胞(一般可制备细胞爬片)、悬浮细胞(或细胞悬液)、组织切片以及单细胞。
缺点:
1、坏死细胞亦有DNA裂点形成,也可呈现TUNEL反应阳性,因而特异性较差;
2、TUNEL结合免疫组化(IHC)检测时,固定过程对检测的影响较大,切片的大小、薄厚会直接影响到固定效果,从而产生结果的差异。
原理:
Hoechst是一种膜通透性荧光染料,能与DNA双螺旋小沟结合,尤其是富含AT的区域,故正常细胞和中早期凋亡细胞均可被Hoechst着色。正常细胞核呈圆形,DNA分布均匀,染色呈均匀蓝色;凋亡细胞核形似月牙或碎裂,由于浓集染色后呈亮蓝色固缩状或团块状,或核呈分叶,碎片状,边集。
图4 Hoechst染料和DNA结合的模式图(Jonas et al., 2018)。
实验流程(以细胞样本为例):
(1)细胞爬片准备:培养过夜的细胞爬片去上清,PBS洗3次,每次5min;
(2)细胞固定:细胞爬片加4%多聚甲醛室温固定15~20min;
(3)Hoechst染色:在细胞爬片滴加Hoechst染液,室温避光孵育5~10min后,吸去染色液,在PBS中浸洗3次,每次3min;
(4)检测:用抗荧光淬灭封片液封片后荧光显微镜下观察。
优缺点:
优点:
1、无需用DAB显色,它直接结合细胞的DNA,经过紫外光激发后发出蓝色荧光;
2、可进行活细胞染色;
3、操作简单、便捷。
缺点:
1、荧光染料存在淬灭的问题,建议染色后尽量当天完成检测,活细胞或组织染色后需立即观察;
2、Hoechst染液对人体有害,需注意适当防护;
3、Hoechst通过紫外光激发,因此不能用于大多数台式流式细胞仪。
结果判断:
(1)定性分析:观察细胞核形状。
正常细胞:胞核光滑,圆形或椭圆形,染色均一,淡蓝色,内有较深的蓝色颗粒;
凋亡细胞:胞核碎片化,染色增强荧光更为明亮,蓝色发白(因DNA浓缩致密而深染);
坏死细胞:胞核边缘不清晰;
正在分裂细胞:DNA致密深染,DNA分列两排;
分裂旺盛或核仁较大的细胞:核仁位置无Hoechst染色,呈现黑色,核边缘清晰,形状规则。
(2)定量分析:对总细胞和凋亡细胞进行计数后,分析3次独立重复数据并绘图。
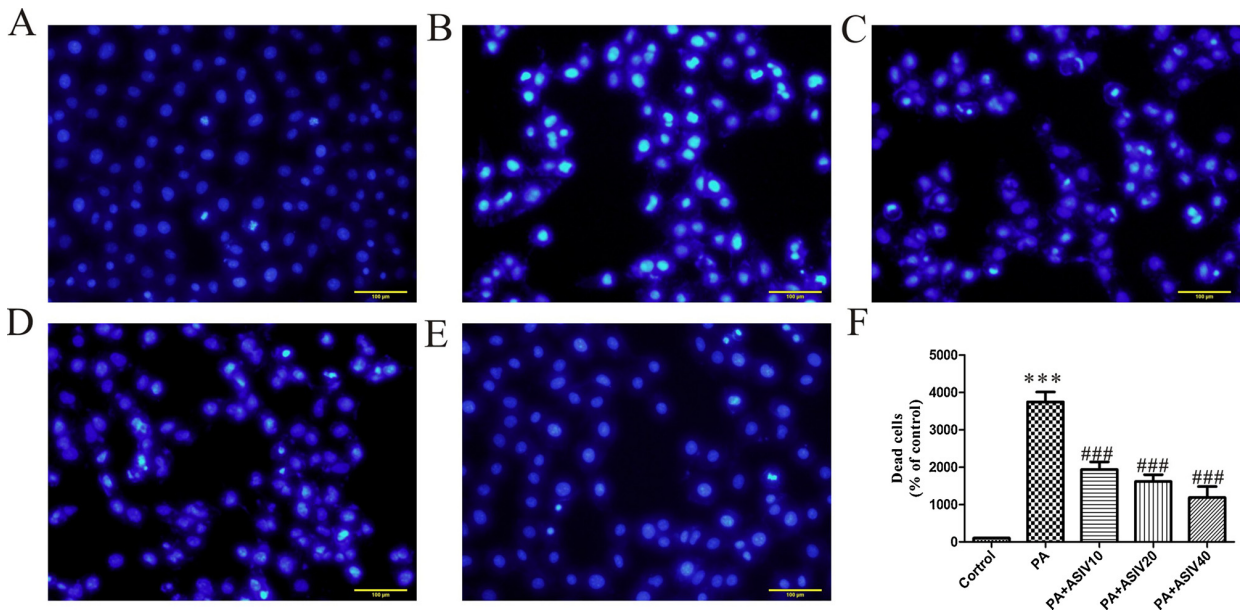
文献示例:
如图5所示,与对照组相比,PA组的细胞凋亡率明显升高。与模型组相比,PA和不同浓度AS-IV共同处理组凋亡细胞明显减少,细胞凋亡率显著降低。相应的定量分析显示,AS-IV可降低PA刺激下的HK-2细胞的凋亡。
Jonas Bucevičius, Gražvydas Lukinavičius, Rūta Gerasimaitė. The Use of Hoechst Dyes for DNA Staining and Beyond[J]. Chemosensors, 2018,6(2).
Qingqing Chen,Yong Su,Yinghui Ju,et al. Astragalosides IV protected the renal tubular epithelial cells from free fatty acids-induced injury by reducing oxidative stress and apoptosis[J]. Biomedicine & Pharmacotherapy, 2018,108.
Ribeiro A R C, Maria Lúcia da Silva Cordeiro, Silva L M P, et al. Myrciaria tenella (DC.) O. Berg (Myrtaceae) Leaves as a Source of Antioxidant Compounds[J]. Antioxidants, 2019, 8(8).