说起他汀类药物,就离不开它优越的降血脂功效。并且,他汀药物具有多效性,是个不折不扣的“多面手”。
越来越多的证据表明,表观遗传修饰在心血管疾病的发生和发展中起着关键作用。他汀类药物可以通过DNA甲基化和组蛋白乙酰化重塑染色质可及性,起到抗癌和保护心血管的作用。
在近期的《自然·心血管研究》中,斯坦福大学Chun Liu及其研究团队发现他汀类药物可以通过表观遗传调节内皮-间质转化(EndMT)调节基因,显著改善糖尿病条件下的内皮细胞功能,保护心血管。
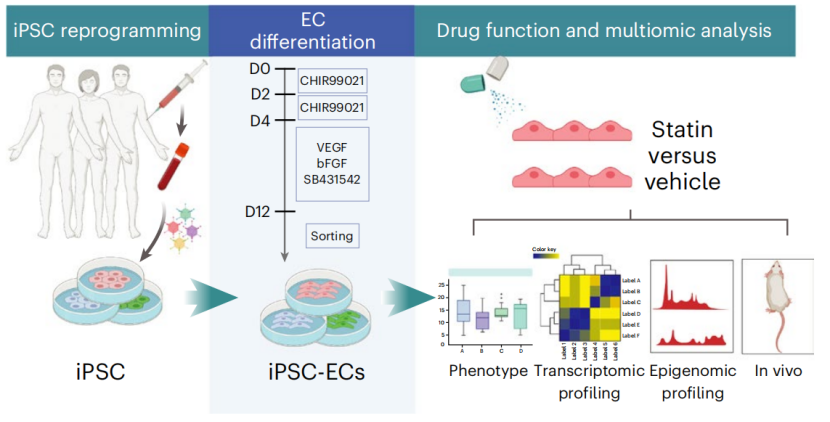
这是第一批使用人诱导多能干细胞衍生的内皮细胞(iPS-ECs)作为非遗传性心血管疾病模型来研究细胞病理生理学分子机制的研究之一。
动脉粥样硬化是导致心血管疾病的重要原因,他汀类药物对心血管的保护作用不仅在于可以降低低密度脂蛋白胆固醇水平,还与恢复内皮功能、减轻氧化应激和血管炎症、稳定动脉粥样硬化斑块等功能有关。内皮功能障碍是动脉粥样硬化发展的关键早期阶段,许多心血管疾病的风险因素,比如2型糖尿病、高血压、肥胖等,都会导致内皮功能障碍。
内皮-间质转化是指内皮细胞失去内皮特性、表现间质特性,在多种生理和病理过程中都发挥重要作用,可能是内皮障碍导致动脉粥样硬化的潜在机制。研究表明,他汀类药物对人心脏微血管和肾小球内皮细胞中的内皮-间质转化有强大的抑制作用,但是其改善内皮功能的确切机制尚未明晰。
实验设计
在本次研究中,为了研究他汀类药物对内皮功能的影响,研究人员从三名健康供体中获得iPS-ECs,并测试了7种他汀类药物对iPS-ECs的影响,发现其中辛伐他汀以剂量依赖性方式上调NOS3,提高了iPS-ECs体外成管和产生NO的能力,于是选择了1μM辛伐他汀进行接下来的转录组学和表观遗传分析。
转录组分析显示,辛伐他汀处理过的iPS-ECs基因表达发生了较大变化,超过2000个基因发生上调或下调(上调1019个基因,下调1600个基因)。其中,上调的基因与增强内皮功能有关,在血管生成、抗炎反应等过程中富集;下调基因与转录、核小体组装和染色质组织的表观遗传调控有关;未发现细胞增殖的明显差异。
接下来,研究人员对辛伐他汀处理过的iPS-ECs进行了全基因组染色质可及性测序,发现在可及性较低的区域,转录因子TEAD家族显著富集。进一步研究证实,TEAD基序与间质细胞、转化生长因子β和内皮细胞功能相关通路有关,辛伐他汀改变的可及区域与血管功能有关。也就是说,辛伐他汀通过降低与TEAD基序相关的染色质可及性发挥作用。
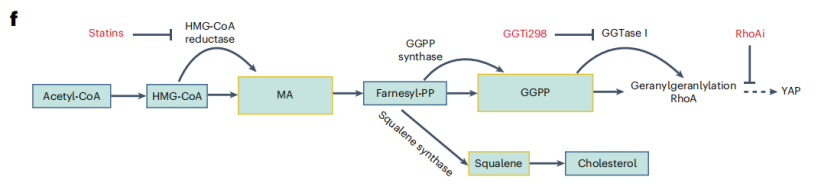
甲戊酸途径调控YAP示意图概述
但是,虽然TEAD可以直接与DNA结合,但是并不能独立调节基因表达,需要与YAP形成复合物后再激活特定靶基因转录。研究人员评估了辛伐他汀对YAP的影响,发现辛伐他汀降低了YAP在细胞核的活性,抑制了TEAD与YAP的结合,从而影响了基因转录和染色质可及性。
他汀类药物通过抑制RhoA的香叶酰化来降低乳腺癌细胞中的YAP活性。研究人员使用GGTi298(靶向RhoA香叶酰化的特异性GGTase抑制剂)和RhoAi(RhoA抑制剂)处理内皮细胞,可以成功抑制内皮细胞中的TAP核定位,表明辛伐他汀通过抑制GGTase-RhoA-YAP信号轴来改善iPS-ECs功能。
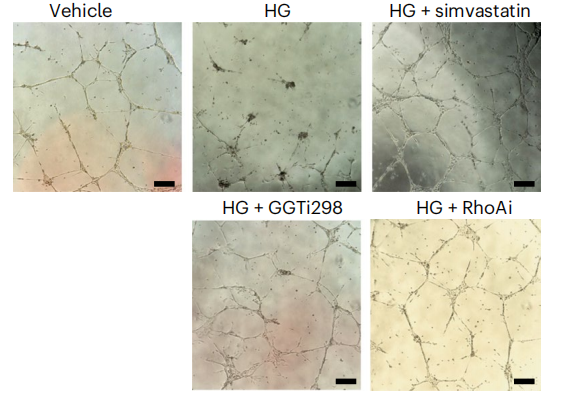
接下来,研究人员培养了糖尿病条件下的iPS-ECs,试图确定靶向抑制GGTase-RhoA-YAP轴是否可以改善内皮功能障碍。高糖条件显著损害了iPS-ECs的管形成和NO产生能力,但是辛伐他汀、GGTi298和RhoAi显著改善了病理表型。
不同条件下iPSC-ECs中毛细血管样管密度图像
研究人员发现,辛伐他汀可以有效抑制高糖条件下被激活的EndMT基因簇,介导EndMT基因下调。同样,敲低YAP表达也可以改善高糖诱导的内皮功能障碍。染色质免疫沉淀测序结果显示,辛伐他汀/GGTi298处理后YAP结合信号降低,其中,SOX9增强子区域信号显著下调。但是单独敲除SOX9对高糖诱导的内皮细胞障碍没有影响。
以上结果表明,辛伐他汀通过抑制GGTase-RhoA-YAP-SOX9信号轴,表观遗传阻断YAP-TEAD介导的EndMT染色质可及性上调,从而改善内皮功能。
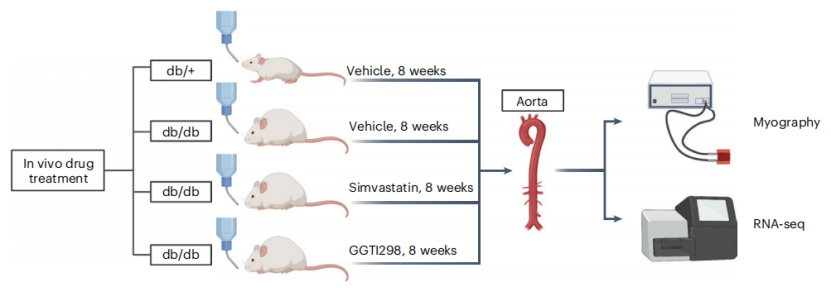
小鼠实验设计示意图
小鼠实验也证实了辛伐他汀和GGTi298对内皮细胞的保护作用。糖尿病小鼠主动脉对乙酰胆碱的基础内皮依赖性松弛反应较低,内皮功能受损,血管平滑肌细胞功能受损,使小鼠口服辛伐他汀或GGTi298 8周,都能有效恢复小鼠内皮功能到对照小鼠水平。
总的来说,研究揭示了辛伐他汀通过表观遗传介导染色质可及性和改善内皮功能,证明了YAP激活在EndMT和血管功能障碍中的作用,有助于内皮功能障碍相关心血管疾病的生物标志物开发、预防或治疗。
参考文献:
[1] Liu C, Shen M, Tan W L W, et al. Statins improve endothelial function via suppression of epigenetic-driven EndMT[J]. Nature Cardiovascular Research, 2023: 1-19.
[2] https://www.nature.com/articles/s44161-023-00268-0
文章来源:奇点网