对阿尔茨海默病(AD)的认知,今天又要更新了。
今日,《自然·医学》发表了一篇论文,科学家们对世界第二例对家族性AD具有抗性的病例进行了分析。该男性患者为常染色体显性阿尔茨海默病(ADAD)基因PSEN1 E280A携带者,但直到67岁仍保持正常认知水平。他脑内具有极高的淀粉样蛋白斑块负荷水平,tau蛋白纤维缠结同样水平颇高,但在内嗅皮层中水平较低。
研究者发现他携带一种具有保护性的罕见突变RELN H3447R。该突变为功能获得性突变,表达产物能够更强地激活下游靶点并减少tau蛋白磷酸化。
或许,这会成为我们攻破AD的新出口。
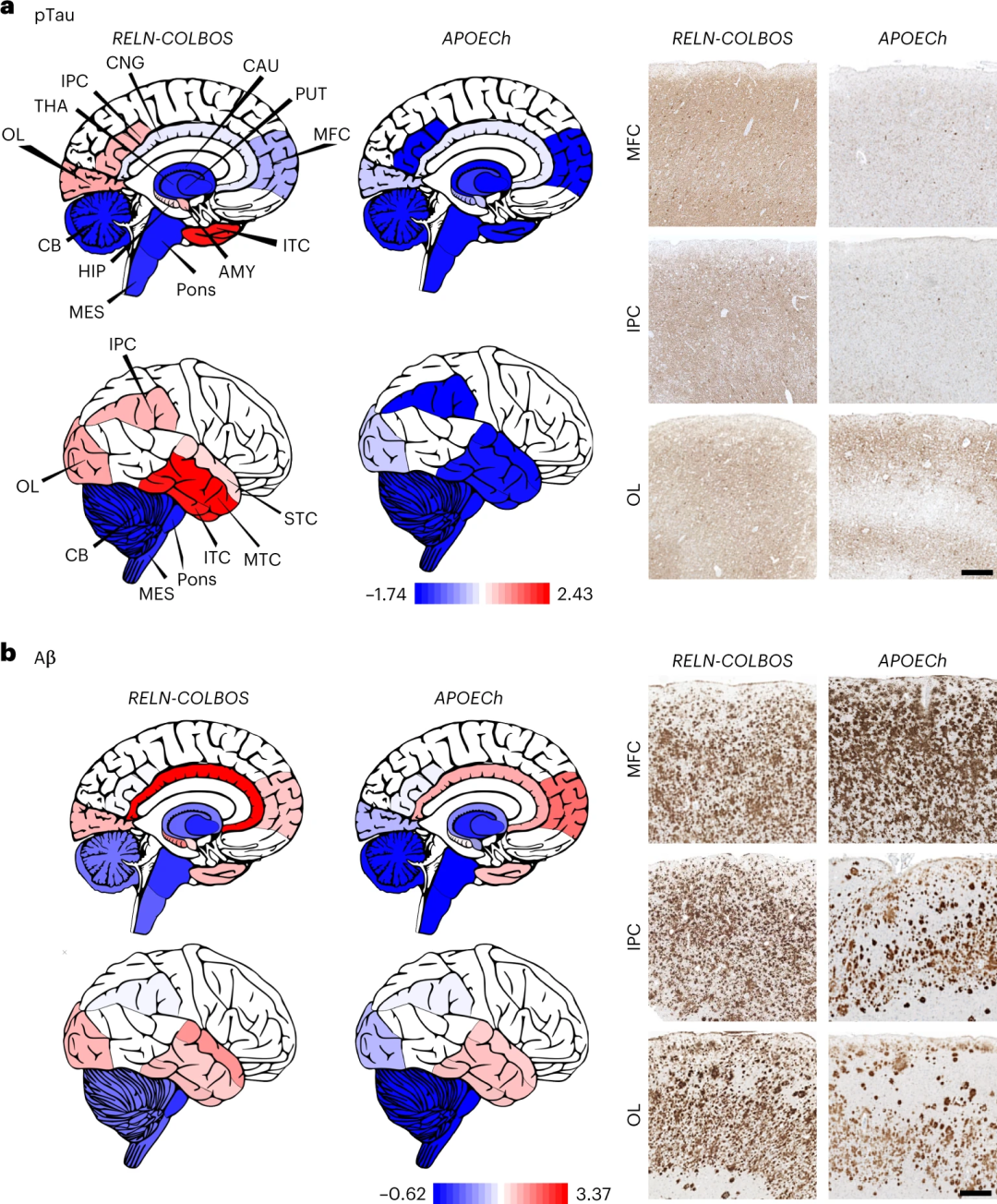
之前,研究者们在这个家族中发现了一个特殊的个体,那名女性在携带PSEN1 E280A的同时,还携带两个APOE3 Christchurch(APOE3 R136S,APOECh)突变,这使得她的发病年龄比家族平均水平延后了近30年。
此次报道的病例为发现的第二例对家族性AD具有抵抗性的患者病例。该男性在完成5年教育后工作直至60来岁,已婚并育有两个孩子。他在67岁时首次认知评估表现出了些许语言学习能力障碍,并在70岁时因短期记忆和语言流畅性下降确诊为MCI;72岁时,他的语言能力进一步恶化,进展为轻度痴呆;73岁时,他需要帮助才能完成基本的和工具性日常活动,符合中度痴呆标准;74岁,他死于吸入性肺炎。
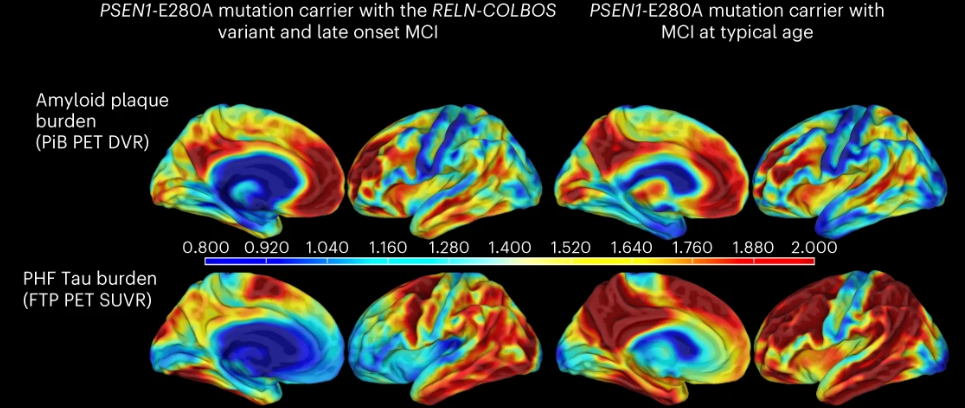
通过PET检查脑内蛋白沉淀,研究者发现,该男性患者在73岁时脑内β淀粉样蛋白(Aβ)斑块负荷水平显著高于家族中处于平均发病年龄的较年轻者(DVR 1.77 vs 1.51±0.13);类似的,FTP测量的下颞叶tau缠结负担也与典型发病年龄者类似(SUVR 1.78),但在内嗅皮层(ERC)tau病理水平明显较低(SUVR 1.34)。
研究者认为,这个特征可能是他的保护表型的关键。
RELN编码蛋白Reelin能够调节tau蛋白磷酸化,并且在功能上与APOE密切相关。Reelin与APOE结合相同的受体VLDLr和APOEr2。
在原代培养的小鼠皮质神经元中,研究者发现,Reelin-COLBOS能够聚集和激活VLDLr和APOEr2,并显著增加下游Dab1磷酸化。
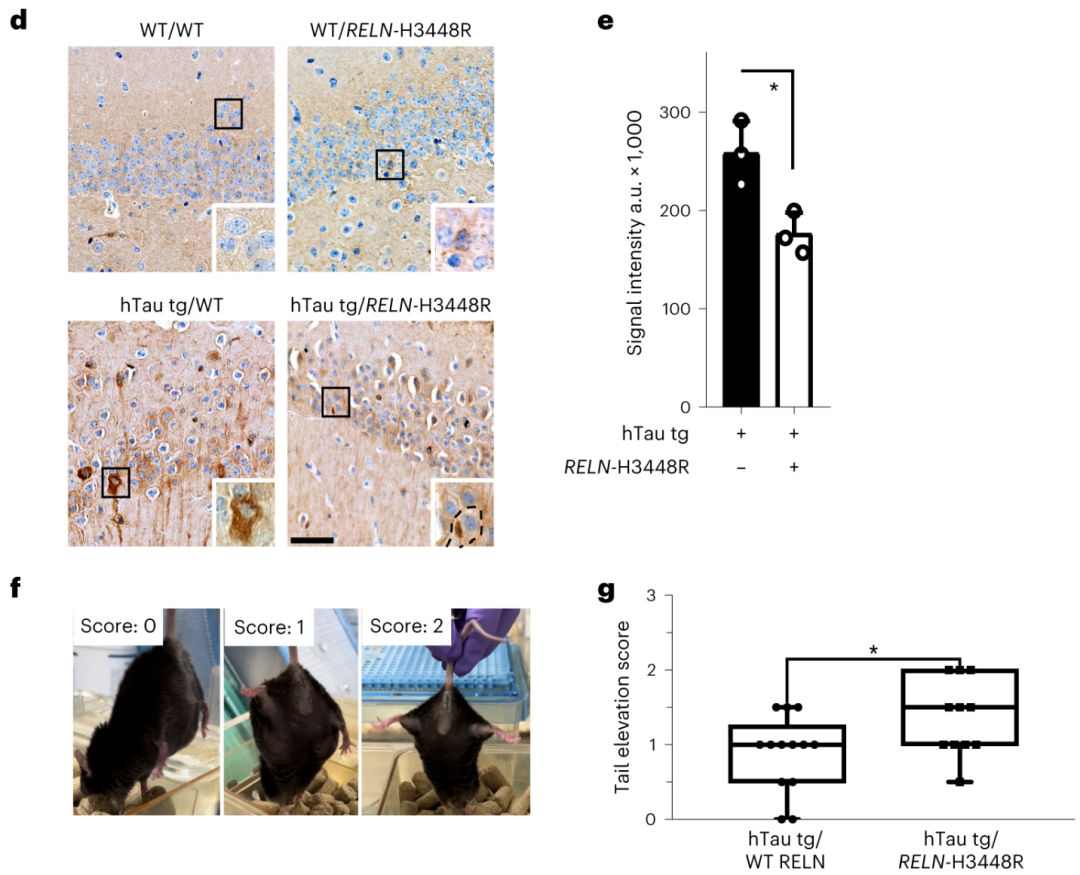
研究者还在tau病模式小鼠中进行了实验,STOCK Tg JNPL3Hlmc小鼠具有突变的tau基因,会自发产生tau缠结积累和特定脑区的神经元损失。转入RELN-COLBOS等位基因之后,雄性小鼠海马、延髓中的磷酸化tau蛋白显著减少,异常夹紧肢体等小鼠常见的tau病表现也得到了显著的恢复。
研究者认为,这足以说明RELN-COLBOS是一种功能获得性突变,对tau病有明显的保护作用。
可以认为,内嗅皮层是RELN介导的保护作用的关键。
可以认为,内嗅皮层是RELN介导的保护作用的关键。
文章来源:奇点网