高蛋白饮食是有效的体重管理方法,对于很多人来说,也是相对比较好接受/忍受的方法,而且,高蛋白饮食不仅能够减重,还可以一定程度上阻止反弹,这是因为高蛋白饮食能够增加一些“厌食激素”的水平,比如胆囊收缩素、胰高血糖素样肽-1(GLP-1)和酪酪肽(PYY)[1,2],同时抑制“促食欲激素”,胃饥饿素(ghrelin)[3]。
不过,由于高蛋白饮食后,氨基酸代谢物水平升高,可能对肾功能造成一些挑战[4]。因此,为了优化高蛋白饮食的健康益处,需要更详细地揭示它的底层机制。
最近,Cell Research杂志上刊登了深圳湾实验室王立铭和重庆大学黄锐研究团队的研究成果[5],他们发现,高蛋白饮食能够减少体脂肪量,主要与饮食中半胱氨酸的含量有关。
从机制上看,半胱氨酸能够增加神经肽FMRFa的产生,与同源受体(FMRFaR)结合后,促进能量消耗,同时抑制食物摄入,具体来说,激活脂肪细胞蛋白激酶A(PKA)信号和脂肪酶活性,促进脂肪分解,还作用于甜味感知味觉神经元,抑制食欲感知,从而减少食物摄入。
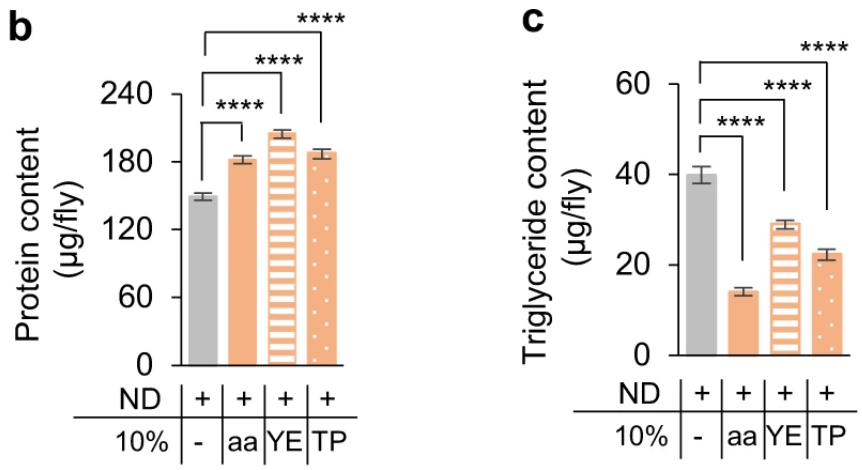
研究选择果蝇作为主要实验模型,为它们定制了三种高蛋白饮食,分别为在标准饮食中添加10%的氨基酸混合物、酵母提取物或胰蛋白胨。相比标准饮食的对照组,三组的体重略有增加,但脂质储存量明显减少,脂肪细胞内的脂滴也相应减小。
添加氨基酸混合物(aa)、酵母提取物(YE)和胰蛋白胨(TP)的三种高蛋白饮食和标准饮食(ND)组小鼠饮食中蛋白质含量(b)和脂质储存量(c)
为了寻找高蛋白饮食中发挥作用的氨基酸,研究人员分别在果蝇的5%蔗糖(最低食物需求)培养基中单独添加了20种天然氨基酸,结果显示,其中只有3种具有减少脂质储存量的效果,包括半胱氨酸、苏氨酸和天冬氨酸,而半胱氨酸效果最明显,半胱氨酸可以显著减少食物消耗,且是在保持蛋白质消耗量不变的情况下减少了糖的摄入。
饮食中半胱氨酸的浓度与果蝇腹部脂肪沉积具有剂量依赖关系,脂肪沉积随着浓度增加而减少。在标准饮食中只添加半胱氨酸,果蝇不仅脂质储存减少,体重也降低,能量消耗增加,食物消耗减少,且同样具有剂量依赖关系。因此,研究人员认为,高蛋白饮食的减脂效果很大程度上归因于半胱氨酸的含量。
5%蔗糖+0/0.2%/0.4%半胱氨酸喂食的果蝇腹部脂肪沉积对比
这可能也解释了三种高蛋白饮食中,为什么添加氨基酸混合物的一组脂质减少最多。
RNA测序分析显示,与蔗糖对照组相比,半胱氨酸组有约1000个基因表达发生了显著变化,这些差异化表达的基因富集在多种代谢和神经激素途径中。
考虑到神经激素信号在脂质代谢中的重要性,研究人员选择了受半胱氨酸影响最大的7个神经肽/神经递质基因(倍数变化>2,FDR<0.001),基因敲除实验显示,只有FMRFa敲除的果蝇失去了对半胱氨酸的响应,这意味着,FMRFa信号传导是半胱氨酸诱导的脂质减少所必需的。
当敲低FMRFa同源受体FMRFaR时,半胱氨酸抑制食物摄入的效果也被消除,脂质减少不再显著。
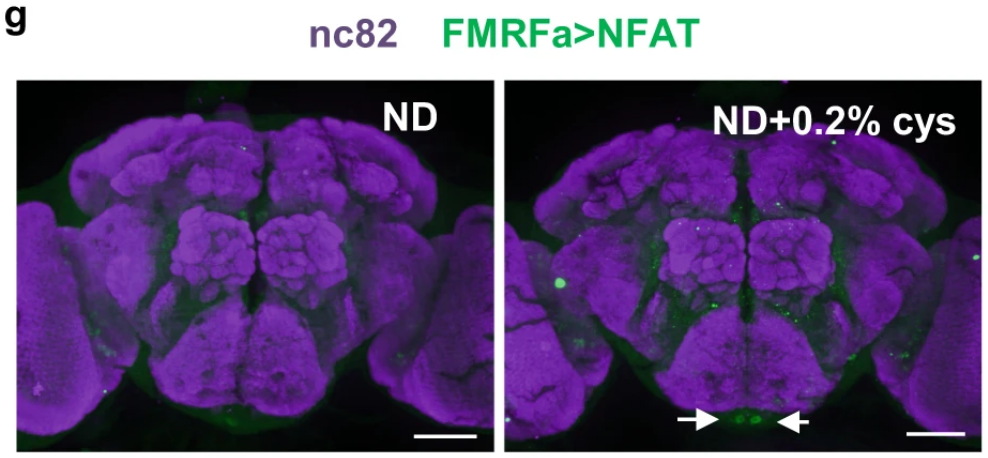
FMRFa在果蝇的大脑和腹侧神经管(VNC)中表达,但不在肠道、脂肪细胞或吻部表达。在大脑中,食道下区(SEZ,容纳味觉感受系统和进食行为回路的脑区)中有2个神经元对半胱氨酸有响应,使用电压门控钠离子通道阻断剂处理后,半胱氨酸诱导的突触传递失败,这表明,SEZ中的FMRFa+神经元可以直接感知饮食中的半胱氨酸,并抑制食物摄入行为。
2个神经元对半胱氨酸有响应
VNC中也有少量FMRFa+神经元被半胱氨酸激活,通过广泛的轴突末端,它们调控了包括脂肪细胞在内的外周组织,反映了半胱氨酸通过对FMRFa对脂肪代谢方面的调节。
基因差异化表达的涉及代谢的途径中,主要包含脂肪分解和其他分解途径,基于此,研究人员观察到了多种脂肪酶基因表达的增加,例如限速脂肪酶brummer(bmm),bmm的上游调节因子,PKA活性也增加,基因敲除实验证实,FMRFa通过FMRFaR和PKA信号直接诱导了脂肪细胞的脂肪分解。
这一条通路只负责脂肪分解,与摄食行为无关,摄食行为的主要负责区域为吻部的Gr5a甜味感知味觉神经元,SEZ中的FMRFa+神经元抑制了Gr5a+神经元,从而抑制了食欲感知和摄食行为。
为了验证半胱氨酸和FMRFa机制的进化保守性,研究人员在小鼠中也进行了实验,直接给小鼠喂食半胱氨酸,确实观察到了体重、脂质储存和食物消耗的减少,与果蝇一致。
在哺乳动物中,神经肽FF(NPFF)参与摄食行为的调节,尽管小鼠NPFF和果蝇FMRFa整体序列相似性并不高,但特征氨基酸序列-Arg-Phe-NH2是保守的,因此,研究人员假设,二者可能发挥类似的生理功能。
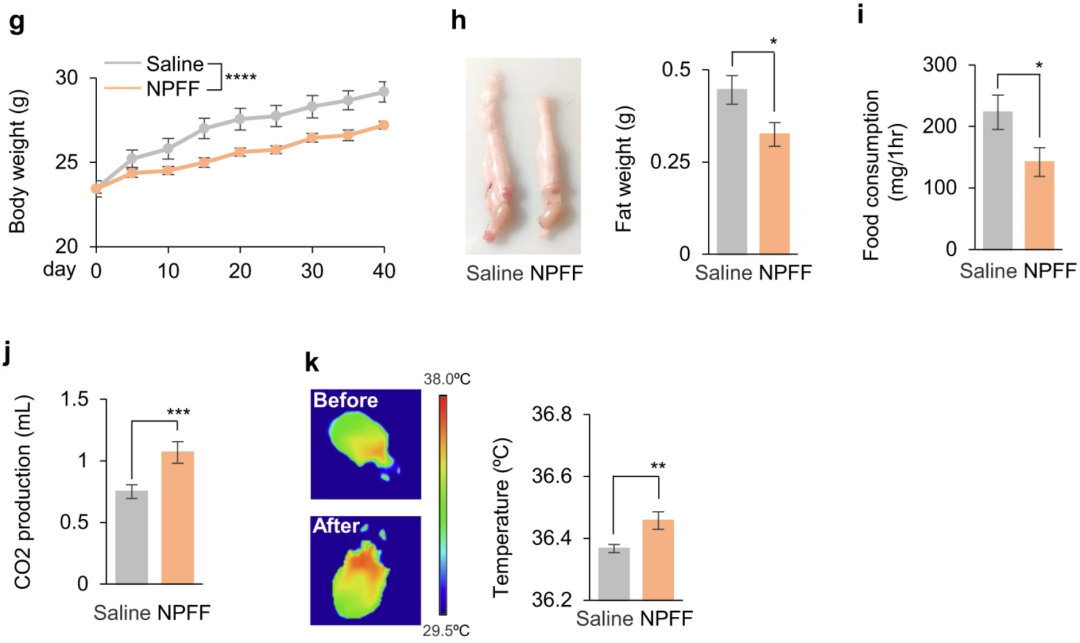
他们发现,半胱氨酸增加了小鼠NPFF的产生,直接注射NPFF导致体重和脂质储存减少,摄食抑制,以及能量消耗增加,与果蝇中FMRFa效果类似。这些现象证实了这一机制的进化保守性。
小鼠注射NPFF后的体重、脂质储存、摄食、能量消耗变化
另外,当前减肥方案的一个常见副作用是精神障碍,如焦虑和睡眠不足,而补充半胱氨酸和调控FMRFa信号传导在果蝇中并没有改变整体的运动或睡眠持续时间/频率。
总的来说,这项研究的结果显示,膳食半胱氨酸补充剂可能是一种新的体重管理策略,且没有明显的不良反应,且其机制的揭示也为肥胖和相关代谢疾病提供了新的治疗靶点。
参考文献:
[1] Moon J, Koh G. Clinical evidence and mechanisms of high-protein diet-induced weight loss[J]. Journal of obesity & metabolic syndrome, 2020, 29(3): 166-173.
[2] Belza A, Ritz C, Sørensen M Q, et al. Contribution of gastroenteropancreatic appetite hormones to protein-induced satiety[J]. The American of Clinical Nutrition, 2013, 97(5): 980-989.
[3] Wren A M, Seal L J, Cohen M A, et al. Ghrelin enhances appetite and increases food intake in humans[J]. 2001.
[4] Cuenca-Sánchez M, Navas-Carrillo D, Orenes-Piñero E. Controversies surrounding high-protein diet intake: satiating effect and kidney and bone health[J]. Advances in nutrition, 2015, 6(3): 260-266.
[5] Song T, Qin W, Lai Z, et al. Dietary cysteine drives body fat loss via FMRFamide signaling in Drosophila and mouse[J]. Cell Research, 2023: 1-14.
文章来源:奇点网