细胞增殖是活细胞重要的生理功能之一,是生物体重要的生命特征,是生物体生长、发育、繁殖以及遗传的基础。检测细胞增殖的能力是评价细胞代谢、生理、病理状况、细胞活性、基因毒性等的重要指标之一。而细胞增殖与多种因素有关,比如细胞代谢活性、与细胞增殖相关的蛋白表达、ATP的浓度等等。
我司常用的几种检测细胞增殖的方法有:
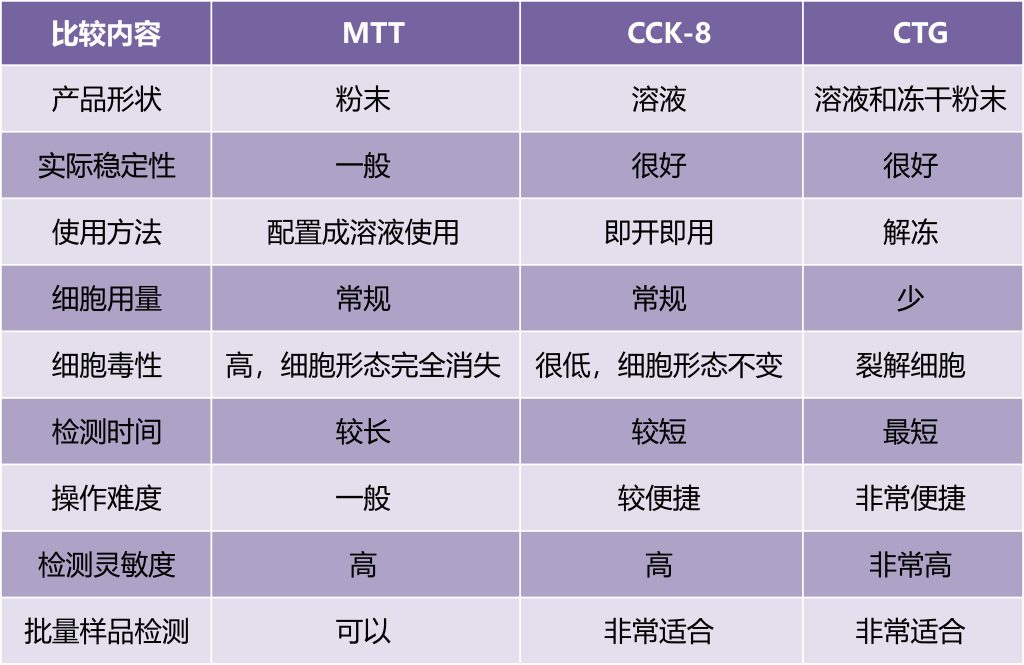
它们之间的区别是:
1.直接计数法:
这是一种非常简单的检测方法,不需要特殊的试剂和仪器,只需利用血球计数板或细胞计数仪计算得出细胞数目即可。优点是省钱;缺点是无法区分增殖细胞与非增殖细胞,不适合数量较多或特定亚群的细胞计数。
2.检测细胞代谢活性:
基于细胞代谢能力还原孵育的底物,使用分光光度计或者酶标仪检测吸光度,从而间接测定活细胞数量,评价细胞的增殖情况。代表方法有MTT、CCK-8、MTS、XTT及SRB法。该类方法简便、快速且经济,广泛应用于各种细胞增殖检测,细胞因子活性检测,细胞毒性检测,药物筛选等。MTT是最早出现的检测方式,但是存在一定缺陷,对细胞有毒,且还原产物不溶于水,需要在DMSO中溶解。而XTT、MTS、CCK-8,都是可溶且无毒的。
3.检测细胞DNA合成:
通过直接测定细胞的DNA合成含量来评价细胞的增殖能力,是检测细胞增殖最准确的方法。细胞在增殖过程中,DNA的倍增,是最显著的变化之一,通过检测DNA量的变化,可判断细胞数量的变化。通过检测DNA进行细胞增殖检测的方法,除了同位素标记DNA外,最常用的就是:BrdU/EdU检测法。常应用于细胞DNA修复,分化及细胞标记物追踪等方面。
BrdU(5-溴脱氧尿嘧啶核苷)是胸腺嘧啶(T)核苷类似物,可代替胸腺嘧啶掺入S期的DNA合成,然后利用BrdU抗体,通过免疫化学方法识别增殖细胞。如果与其它细胞标记物进行双染,则可判断增殖细胞的种类、增殖速度,对研究细胞动力学有重要意义。
EdU检测法是BrdU的替代方法,也是目前更广泛适用的方法,BrdU抗体分子较大,需要细胞或组织样品经过变性处理后,BrdU抗体才能与BrdU亚单位结合,而这个处理过程对细胞有损伤,破坏DNA的双链结构。EdU同样可以代替胸腺嘧啶(T)掺入DNA,且其分子大小只有BrdU的1/500,可以直接在DNA双链形态下与染料分子结合用于检测,无需抗体结合反应,实验过程简单,对细胞损伤小,是新一代基于DNA检测细胞增殖的试剂。
4.检测ATP含量:
ATP是细胞能量的直接来源,其含量与细胞周期和细胞状态关系密切,死细胞或濒临死亡的细胞几乎不含ATP。在细胞中测得的ATP浓度与细胞数之间存在严格的线性关系。因此,检测ATP也可以得到细胞增殖的情况。利用萤火虫荧光素酶Luciferase及其底物荧光素Luciferin的生物发光检测ATP,结果非常灵敏。有ATP存在,荧光素酶就会发光,且其发光强度与ATP浓度成正比,这种方法非常适用于高通量细胞增殖检测和筛选。
另外,Promega公司开发的CellTiter-Glo Luminescent活细胞发光检测系统,实现了“加样-混合-测量”的简单快速检测模式,是基于ATP检测的快速细胞活力检测法,公认的高灵敏度发光检测法,是细胞活力检测的金标准,在国内外被广泛应用。CellTiter-Glo试剂和细胞培养中的常用培养基兼容,且不受酚红和有机溶剂的影响,误差小,准确率高,可用于自动化高通量筛选(HTS)。
5.活细胞荧光标记:
羟基荧光素二醋酸盐琥珀酰亚胺酯(CFSE)是一种可穿透细胞膜的荧光染料,CFSE能够轻易穿透细胞膜,在活细胞内聚积并与胞内蛋白共价结合,水解后的CFSE释放出荧光物质,这些共价结合的荧光分子很少从细胞内脱落。当细胞分裂时,CFSE标记荧光可平均分配至两个子代细胞中,因此其荧光强度是亲代细胞的一半。这样,在一个增殖的细胞群体,各连续代细胞的荧光强度呈对数递减,利用流式细胞仪在488nm激发光和荧光检测通道可对其进行分析,从而得到细胞增殖情况。
6.检测细胞增殖相关抗原:
有些抗原只存在于增殖细胞中,而非增殖细胞缺乏这些抗原,因此常作为细胞增殖的标志。在对组织样本进行增殖表型的相关检测时,可通过免疫组化的方法检测增殖细胞特异性表达的某些特定蛋白,如增殖细胞核抗原PCNA,细胞核相关抗原Ki-67和微小染色体维持蛋白MCM等,间接反应细胞增殖的情况。由于这些细胞增殖因子,在异常增殖的细胞中显著表达,是研究肿瘤细胞增殖的重要核抗原,因此这一方法颇受癌症研究者们的喜爱。但其缺点在于需要组织切片,无法进行高通量分析。
7.染料排斥法:
活细胞有排斥某些染料如伊红、台盼蓝、苯胺黑等的能力,而死细胞由于膜完整性的破坏,可被着色。因此,可通过使用染料对细胞染色的方式进行细胞增殖情况的观察。适合少量细胞的统计,一般广泛用于绘制细胞生长曲线等。
8.实时细胞分析法:
前文所介绍的MTT以及BrdU法都属于End-point assay(终点分析法),因为这类技术对于细胞都有破坏作用,检测过程中细胞已经死亡,结构也不再完整。而RTCA(实时细胞分析法),采用特殊工艺,将微电极列阵整合在细胞培养板的每个细胞生长孔底部,用以构建实时、动态、定量跟踪细胞形态和增殖分化改变的细胞阻抗检测传感系统。当贴壁生长在微电极表面的细胞引起贴壁电极界面阻抗的改变时,这种改变与细胞的实时功能状态改变呈相关性,通过实时动态的电极阻抗检测可以获得细胞生理功能相关的生物信息、包括细胞生长、伸展、形态变化、死亡和贴壁等。该方法不仅能实时检测细胞增殖数据,还可以监测整个培养周期内细胞增殖的动力学变化过程,其应用范围非常广泛。不过,RTCA对于硬件设备的要求很高,成本高昂。
9.移植瘤动物模型:
肿瘤研究中,最常用的动物模型是移植瘤动物模型。通过此种方法检测增殖表型时,需要记录移植瘤的大小/体积,重量等参数。同时,也可将动物的移植瘤样本进行组织切片或匀浆抽提出总蛋白/总RNA来检测增殖相关的分子标志物的表达变化。此外,移植瘤内部细胞会因肿瘤恶性增殖引起细胞密度过高,无法接触到外界氧气和养分,进而形成坏死区域。因而移植瘤恶性增殖程度越高,坏死的区域也越明显。所以通过组织切片检测移植瘤内部坏死区域的面积大小,也是评估增殖的有效手段。
如果想了解细胞增殖中的代谢活性变化,可以使用MTT、XTT、CCK-8或SRB比色法检测。
如果是高通量的药物筛选,悬浮细胞推荐采用MTS,CCK-8这两种方法,操作较为简单;若是贴壁细胞推荐SRB法,不受时间限制,且有很好的线性关系。
如果对DNA合成的改变感兴趣,可以选择用BrdU、EdU标记法。
如果药物带有颜色,且药物处理时间较短,推荐采用基于ATP的检测方法。
如果对细胞增殖及代谢等多个方面感兴趣,可以通过多种方法来验证,如可以选择用BrdU标记,再通过比色法、化学发光或荧光检测进行分析。

.png)
.png)
