他汀抗癌的机制,又有了新发现。
近日,由上海交通大学医学院附属仁济医院消化科房静远、陈萦晅和熊华领衔的研究团队,在著名期刊《自然·微生物学》杂志发表重要研究成果[1]。
他们基于临床研究样本、小鼠模型和患者队列研究,首次发现他汀类药物能重塑肠道微环境,促进益生菌罗伊氏乳杆菌(Lactobacillus reuteri)生长,并产生吲哚-3-乳酸(ILA)调节肠道免疫,进而抑制肠癌发生。
仁济医院的韩济璇、陶智杭和王吉林为该论文共同第一作者。
论文首页截图
对于他汀具有预防肠癌的潜力这一点,我相信大家一定不陌生。
毕竟,近及来有大量的流行病学和临床前研究表明,使用他汀类药物与肠癌发病率降低之间存在关联[2-4]。然而背后的机制还需要进一步阐明。
我简单回顾了一下近五年我们在这一领域内的报道,找到了两个与机制相关的研究。
2018年底,哥伦比亚大学的Carol Prives团队在《细胞》上发表了一项研究成果[5],他们发现P53失去功能时,甲羟戊酸途径就会失控,进而增加癌症的发生风险。巧的是,他汀正是靶向甲羟戊酸途径。
在2021年底,荷兰莱顿大学医学中心的James C.H. Hardwick团队又发现,他汀防肠癌的潜能与SMAD4的表达水平有关[6]。
这一次,房静远团队将目光投向了肠道微生物。毕竟肠癌的发生与肠道微生物密切相关,而且2020年也有研究发现他汀可以改善人体肠道微生物[7]。
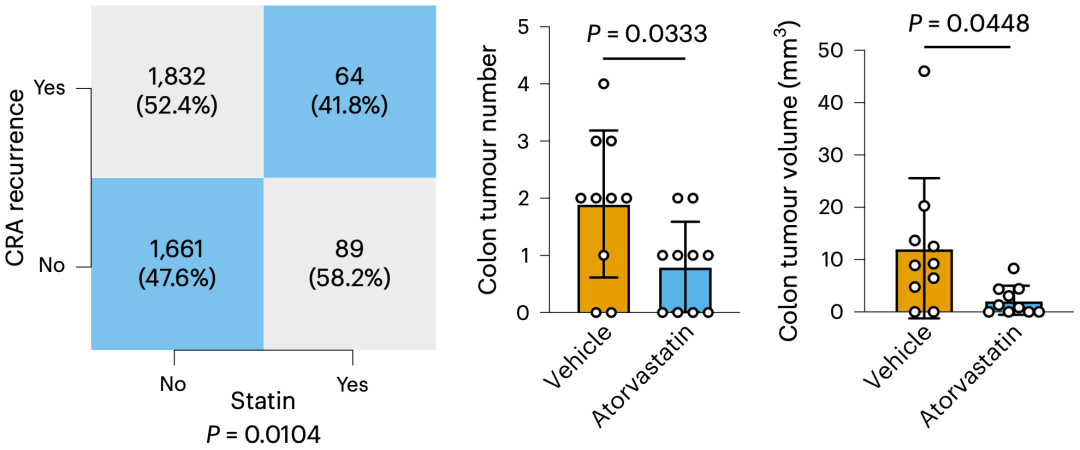
他们首先基于仁济医院5703名肠癌患者的数据,证实了阿托伐他汀有防肠腺瘤(CAR)复发的能力(不服用 vs 服用:41.8% vs 52.4%,P=0.0104)。紧接着,他们在结直肠癌小鼠模型ApcMin身上检验了阿托伐他汀抗肠癌的能力。与不使用阿托伐他汀的小鼠相比,使用的小鼠肠道肿瘤数量更少和体积更小。此外,他们还证实,阿托伐他汀的这种抗癌效果不依赖于降脂作用。
临床数据和小鼠模型均表明,他汀有抗癌潜力
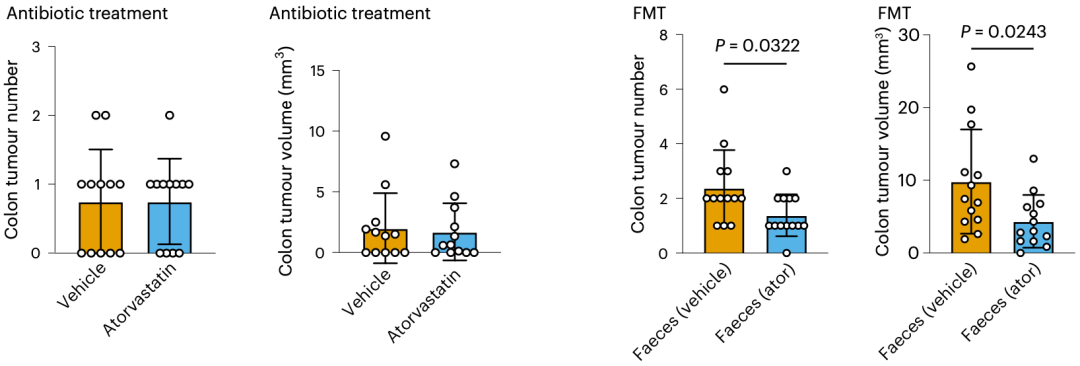
要想确定肠道微生物在这个过程中发挥的作用,抗生素治疗和粪菌移植实验必不可少。
结果如房静远团队所料,抗生素鸡尾酒处理之后,阿托伐他汀抗癌的魔法消失了;不过,在给小鼠移植接受阿托伐他汀治疗的小鼠的粪便微生物之后,差异又出现了。这两个实验证明,他汀的抗癌作用确实依赖于肠道微生物。
是肠道微生物无疑了
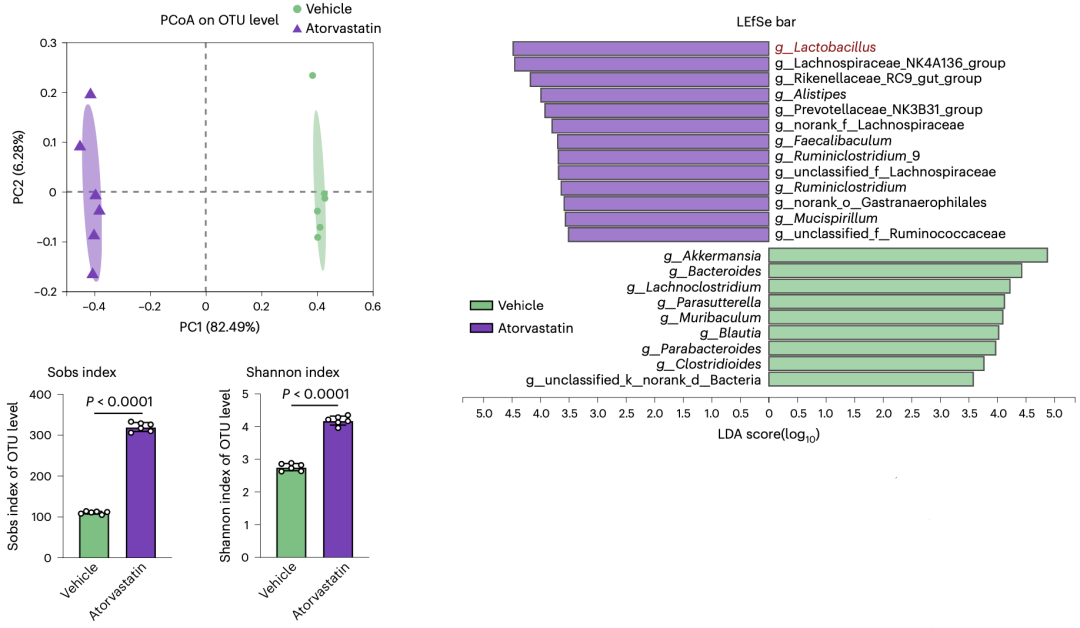
16S rRNA测序揭示了真相。
原来阿托伐他汀重塑了肠道微生物群。
而且,在阿托伐他汀治疗后,肠道微生物群的α多样性增加,乳酸菌显著富集。
阿托伐他汀治疗后,小鼠肠道微生物群的变化
在进一步分析9种乳酸菌的数据之后,罗伊氏乳杆菌浮出水面。
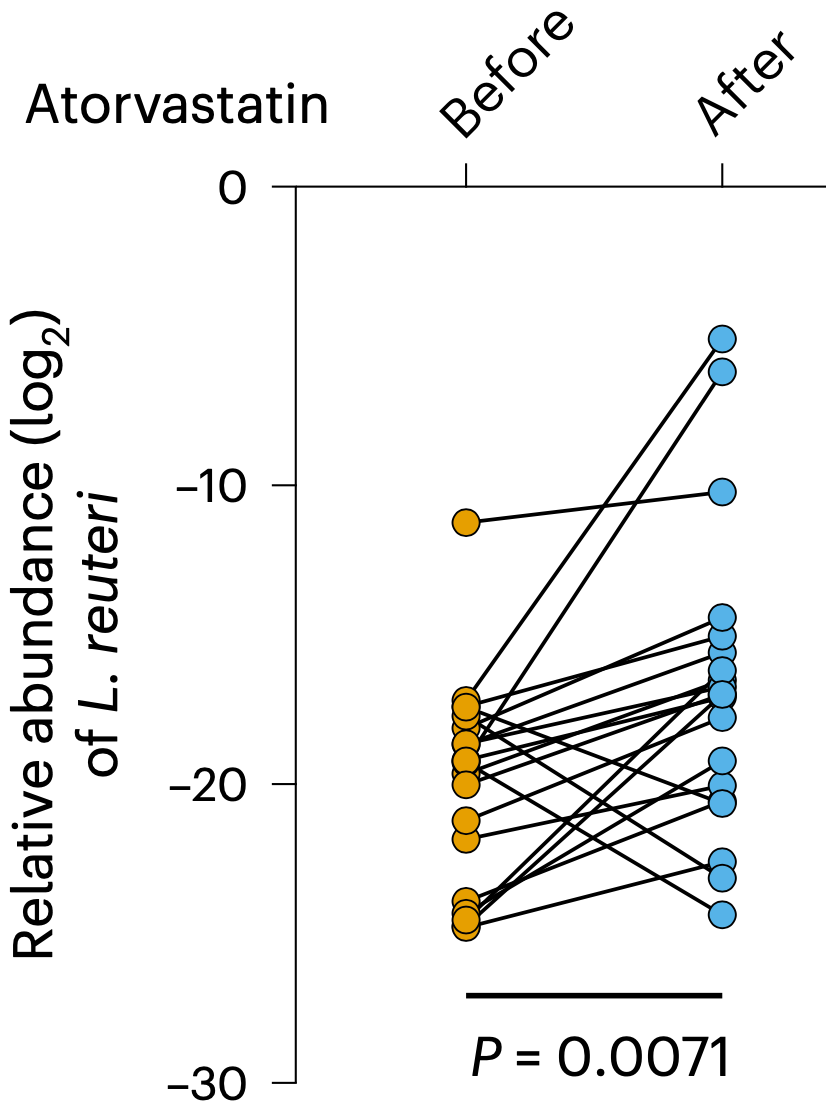
为了证实罗伊氏乳杆菌确实是幕后推手,房静远团队在20名健康志愿者身上开展了为期5天的探索性试验。结果发现,阿托伐他汀治疗后,罗伊氏乳杆菌的丰度明显增加。
是罗伊氏乳杆菌没跑了!
是它是它就是它
奇怪的是,在体外实验环境中,阿托伐他汀并不能促进罗伊氏乳杆菌的生长。
这让房静远团队想到,阿托伐他汀可能改变了肠道微环境,让肠道变得更适合罗伊氏乳杆菌繁殖。
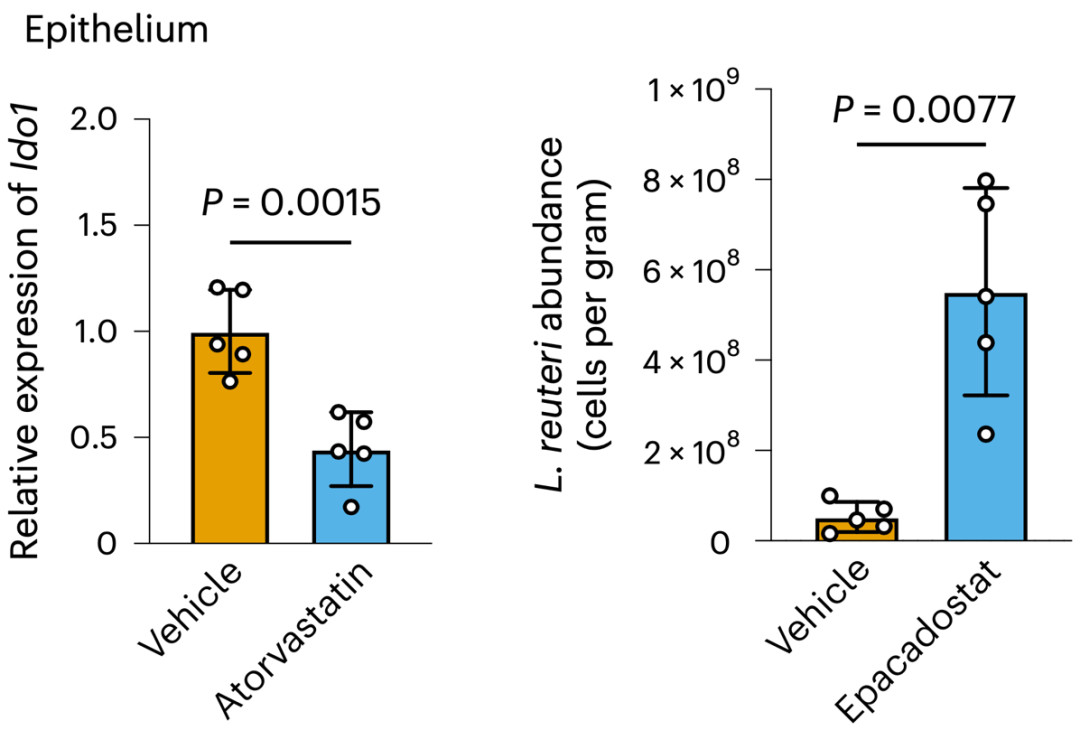
结肠上皮细胞的RNA测序数据揭示了真相:阿托伐他汀抑制了肠上皮细胞Ido1的表达,限制了肠上皮细胞对色氨酸的消耗,导致肠道色氨酸浓度增加,如此一来,“喜食”色氨酸的罗伊氏乳杆菌就可以大量繁殖了。IDO1抑制剂epacadostat也可以促进罗伊氏乳杆菌的增殖。
原来是IDO1和色氨酸
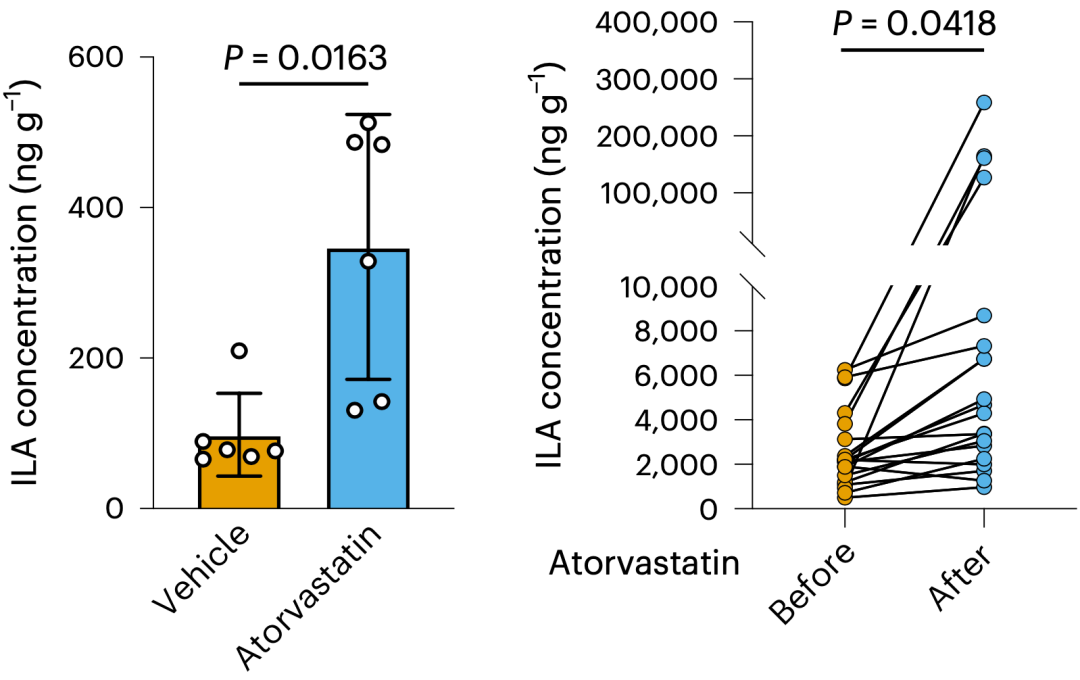
巧的是,色氨酸不仅养育了肠道的罗伊氏乳杆菌,色氨酸被罗伊氏乳杆菌代谢后产生的吲哚-3-乳酸(ILA)竟然是抗癌的关键所在。如果罗伊氏乳杆菌失去合成ILA的能力,它的抗癌活性也就消失了。
前面那20个健康志愿者的数据也证实,阿托伐他汀干预后,健康志愿者的粪便ILA浓度也有所增加。
关键的ILA浮出水面
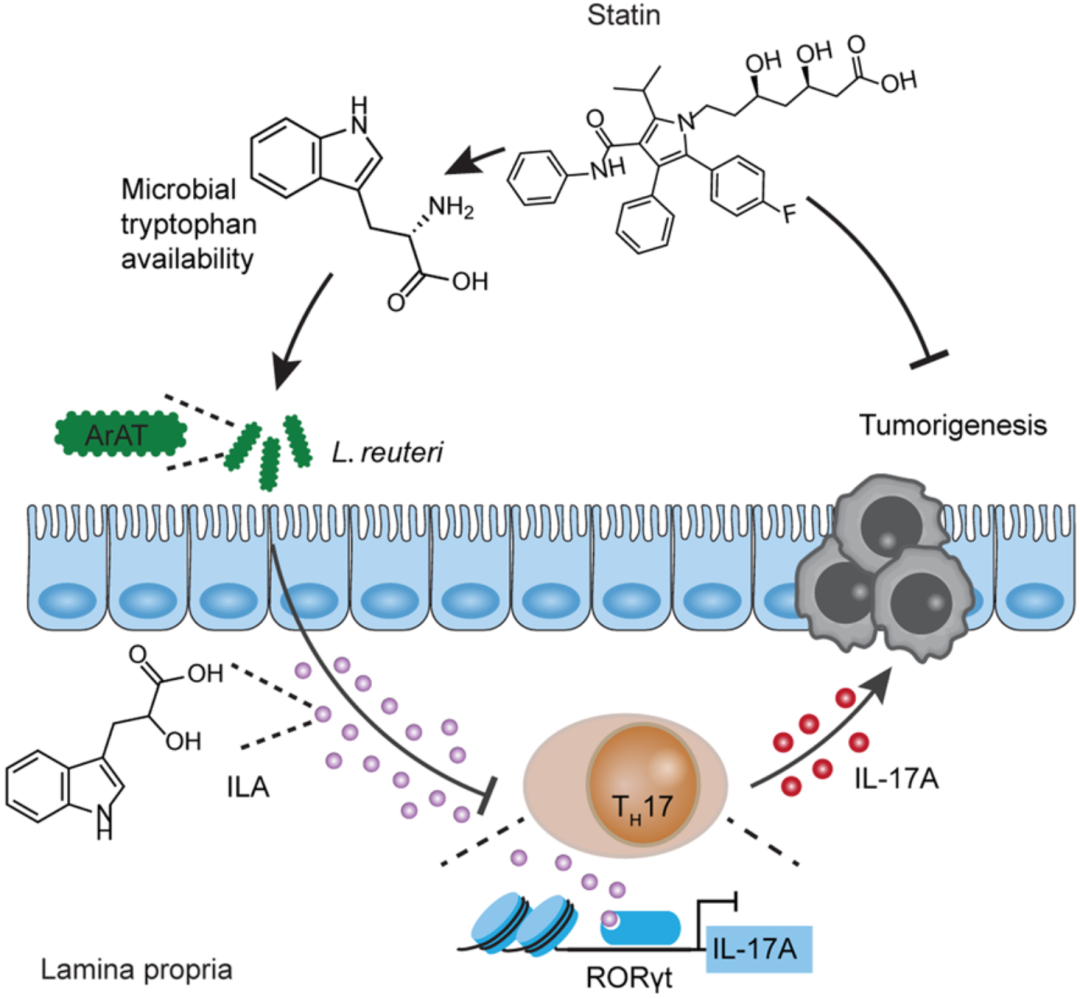
在研究的最后,房静远团队探讨了阿托伐他汀通过肠菌抗癌的机制。
简单来说,阿托伐他汀抑制了肠道上皮细胞Ido1的表达,提升了肠腔中色氨酸的浓度,促进罗伊氏乳杆菌增殖并产生ILA,ILA导致肠道中促肠癌的TH17细胞减少,最终达到抑制肠癌发生的目的。
机制示意图
总的来说,房静远团队的这项研究让我们对他汀类药物的抗癌机制有了新见解。更重要的是,这个研究还提示,罗伊氏乳杆菌或ILA干预,或是肠癌化学预防的有效策略。
最近罗伊氏乳杆菌真可谓风头无两。
就在本月初,匹兹堡大学团队在《细胞》发表一项重要研究成果,首次证实口服罗伊氏乳杆菌可进入肠道外的肿瘤,罗伊氏乳杆菌代谢色氨酸的另一种产物吲哚-3-甲醛(I3A)能够增强CD8+T细胞功能,促进患者对免疫治疗的反应。
如果将这两个研究结合在一起看,或许能解释他汀类药物为何还与前列腺癌、肾癌、乳腺癌和肺癌等肠道外肿瘤的死亡风险降低有关。
如此看来,罗伊氏乳杆菌真的是一个非常有潜力的益生菌。
参考文献:
[1].Han JX, Tao ZH, Wang JL, et al. Microbiota-derived tryptophan catabolites mediate the chemopreventive effects of statins on colorectal cancer. Nat Microbiol. 2023. doi:10.1038/s41564-023-01363-5
[2].Poynter JN, Gruber SB, Higgins PD, et al. Statins and the risk of colorectal cancer. N Engl J Med. 2005;352(21):2184-2192. doi:10.1056/NEJMoa043792
[3].Cheung KS, Chen L, Chan EW, Seto WK, Wong ICK, Leung WK. Statins reduce the progression of non-advanced adenomas to colorectal cancer: a postcolonoscopy study in 187 897 patients. Gut. 2019;68(11):1979-1985. doi:10.1136/gutjnl-2018-317714
[4].Ren QW, Yu SY, Teng TK, et al. Statin associated lower cancer risk and related mortality in patients with heart failure. Eur Heart J. 2021;42(32):3049-3059. doi:10.1093/eurheartj/ehab325
[5].Moon SH, Huang CH, Houlihan SL, et al. p53 Represses the Mevalonate Pathway to Mediate Tumor Suppression. Cell. 2019;176(3):564-580.e19. doi:10.1016/j.cell.2018.11.011
[6].Ouahoud S, Jacobs RJ, Kodach LL, et al. Statin use is associated with a reduced incidence of colorectal cancer expressing SMAD4. Br J Cancer. 2022;126(2):297-301. doi:10.1038/s41416-021-01604-6
[7].Vieira-Silva S, Falony G, Belda E, et al. Statin therapy is associated with lower prevalence of gut microbiota dysbiosis. Nature. 2020;581(7808):310-315. doi:10.1038/s41586-020-2269-x
[8].Bender MJ, McPherson AC, Phelps CM, et al. Dietary tryptophan metabolite released by intratumoral Lactobacillus reuteri facilitates immune checkpoint inhibitor treatment. Cell. 2023;S0092-8674(23)00271-4. doi:10.1016/j.cell.2023.03.011
文章来源:奇点网