说起幽门螺杆菌,大家第一个想到的可能是胃癌。
毕竟,幽门螺杆菌寄生在胃里,且是一级致癌物。
你可能不会想到,这个专门生活在胃里的细菌,竟然会把自己促癌的魔爪伸到了肠道里!
近日,由德国慕尼黑工业大学医学院Markus Gerhard教授领衔的研究团队,在著名期刊GUT发表重磅研究成果[1],首次证实幽门螺杆菌感染与肠癌之间存在因果关系,并揭示了幽门螺杆菌推动肠癌发生发展的潜在机制。
这一发现对肠癌的预防有重要意义。
论文首页截图
据统计,幽门螺杆菌感染影响了世界上一半以上的人口,而且它是胃癌的主要风险因素。
虽然幽门螺杆菌仅感染胃部,但是越来越多的流行病学数据表明,幽门螺杆菌感染与多种胃外疾病之间存在关联[2]。其中,幽门螺杆菌感染者患结直肠癌(CRC)的风险增加了近两倍,高于吸烟、饮酒和BMI与肠癌之间的关系[3,4]。然而,目前还没人知道背后的原因。
为了搞清楚幽门螺杆菌感染是否与肠癌发生发展之间存在因果关系,以及背后的潜在机制,Gerhard团队使用了两种结直肠癌小鼠模型(Apc+/min和Apc+/1638N),并仅在它们的胃部接种幽门螺杆菌。
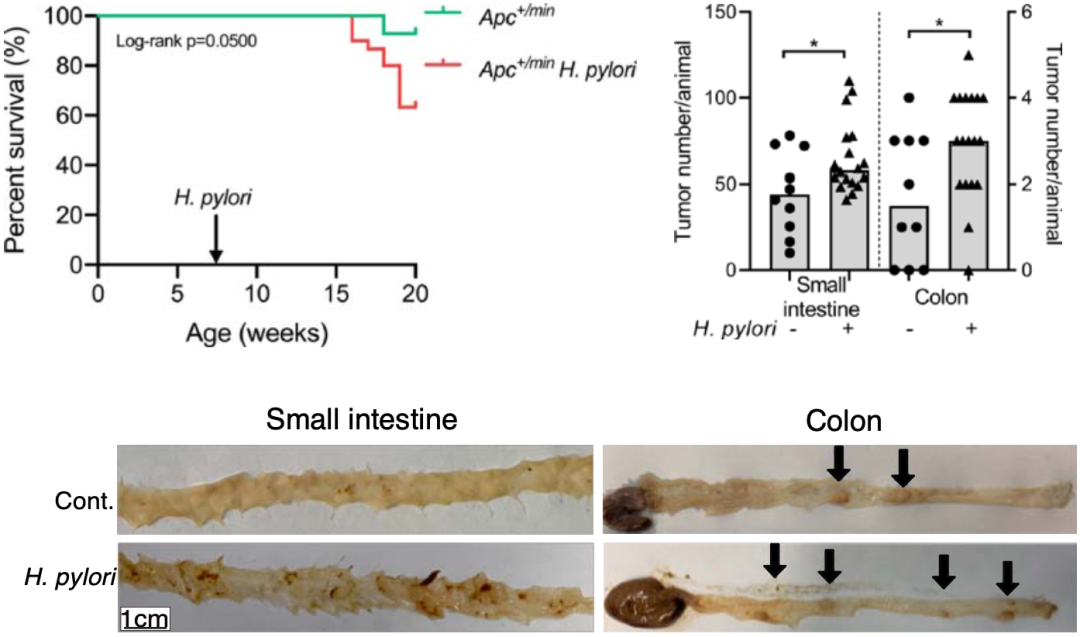
他们注意到,与未感染的对照组相比,感染幽门螺杆菌的Apc+/min小鼠小肠和结肠的肿瘤负担增加;感染12周后只有60%的Apc+/min小鼠仍存活。在Apc+/1638N小鼠中也观察到类似的结果,它们在感染后形成的肿瘤数量不仅是对照组的两倍,而且肿瘤也更大。
这些观察结果表明,幽门螺杆菌感染确实促进了肠癌小鼠模型肠癌的发生和发展。
幽门螺杆菌感染确实会促进肠癌的发生和发展
在对肠癌小鼠模型和野生型小鼠肠道免疫状态进行分析后,他们发现幽门螺杆菌感染在肠癌和野生小鼠的小肠和结肠中,都诱发了幽门螺杆菌特异性的促炎症免疫反应。
具体来说,肠道中CD3+T细胞(总T细胞)水平增加,而起到免疫抑制作用的调节性T细胞(Tregs)减少,因为它们都分化成了致病性的Foxp3+IL-17A+T细胞。
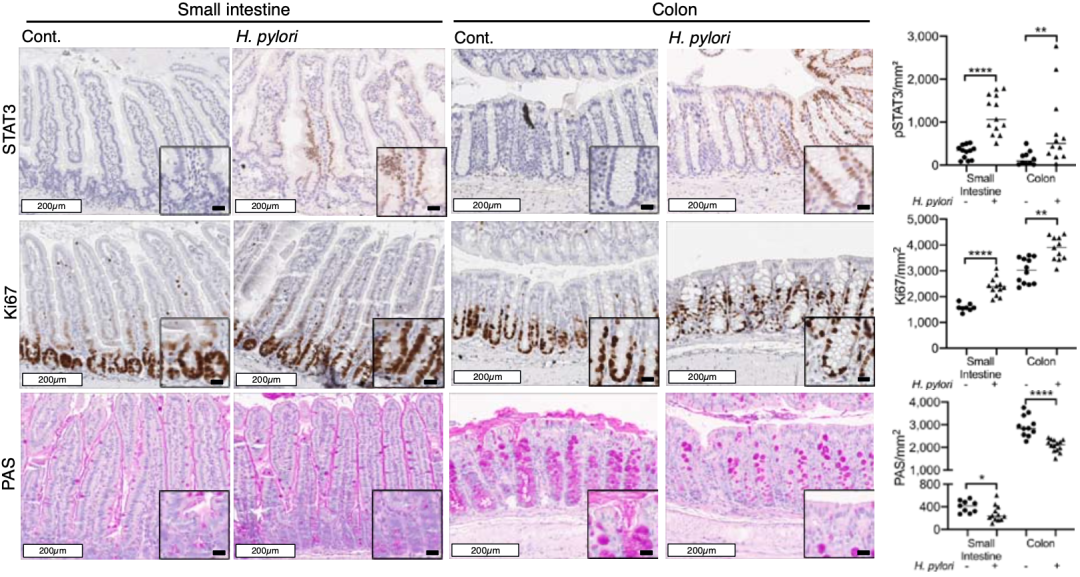
为了搞清楚胃部感染幽门螺杆菌对肠道致癌信号的影响,Gerhard团队又评估了幽门螺杆菌感染小鼠肠道上皮细胞基因表达情况的变化,尤其是STAT3和NF-κB等与肠癌启动和发展相关的信号通路。
不出所料,这两条信号通路在野生型小鼠和肠癌小鼠模型中确实都上调了。实际上,在几年前,就已经有研究团队发现肠上皮细胞STAT3通路的激活,会促进淋巴细胞的招募,同时抑制Treg细胞的浸润[6],这刚好解释了前面的发现。
STAT3与免疫激活之间的关系
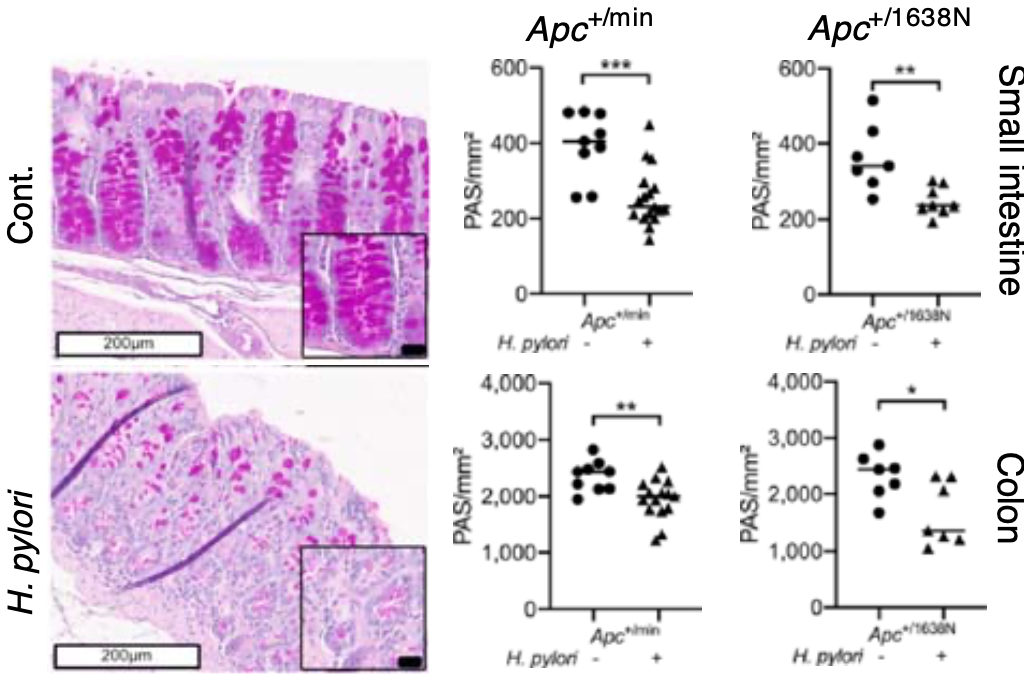
Gerhard团队还评估了幽门螺杆菌感染胃部对肠道屏障完整性的影响,结果发现,野生型小鼠和Apc突变型小鼠胃部在感染幽门螺杆菌之后,小肠和结肠中产生粘液的杯状细胞数量减少。这说明,肠道屏障的完整性受损。
幽门螺杆菌感染导致肠道杯状细胞减少
考虑到前两年北京大学肿瘤医院潘凯枫/游伟程团队发现幽门螺杆菌感染可以改变胃微生物群的特征,且与胃癌的发生有关[7],以及肠道菌群的变化与肠癌密切相关[8],Gerhard团队研究了胃部感染幽门螺杆菌后,小鼠肠道微生物群的变化。
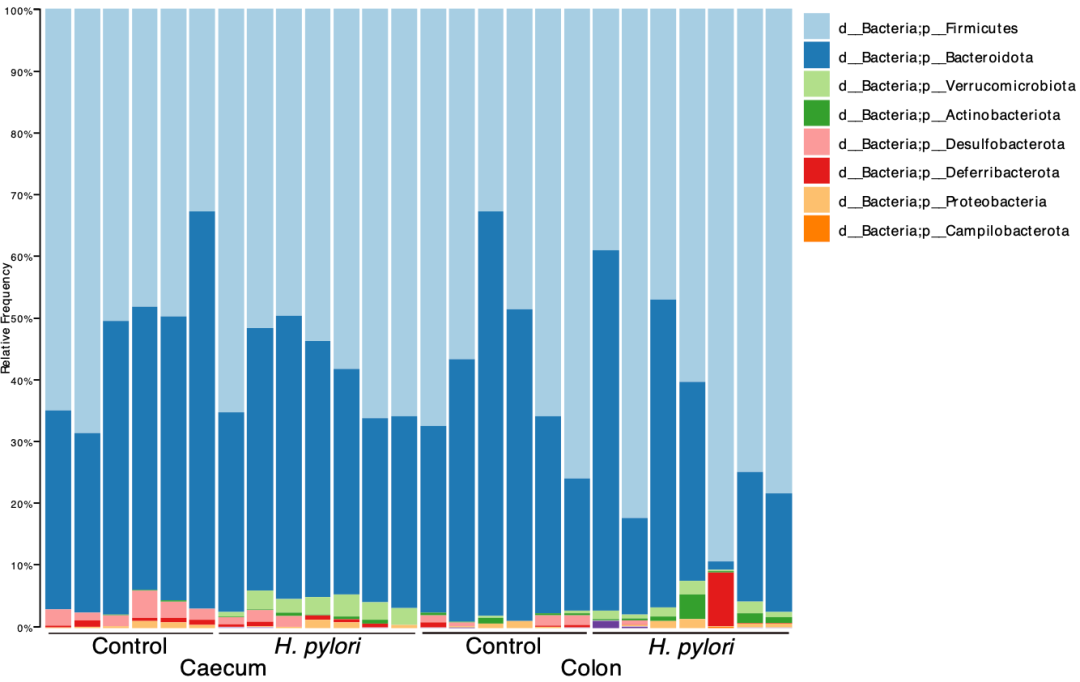
在对胃部和肠道展开16S RNA测序后,他们发现感染后幽门螺杆菌在胃部丰度显著增加,而小鼠的肠道中没有发现幽门螺杆菌的身影。这也再次应证了幽门螺杆菌只感染胃部。
与未感染的野生型和Apc突变型小鼠相比,胃部感染幽门螺杆菌的小鼠肠道微生物发生了剧烈的变化。差异分析显示,能分解肠道粘液的Akkermansia spp.和Ruminococcus spp.在感染小鼠的肠道中显著富集。
肠道菌群的变化
从上面的结果不难看出,胃部感染幽门螺杆菌,可以激活促癌信号通路,改变肠道免疫状态,破坏肠道屏障的完整性,还改变了肠道微生物的特征,而且这种改变与Apc致癌突变无关,无论是肠癌小鼠模型还是正常小鼠,都发生了这些的变化。
基于无菌小鼠和粪菌移植实验,Gerhard团队证实幽门螺杆菌诱导的肠道微生物变化对肠癌的发展贡献很大。而幽门螺杆菌感染的三联疗法,可以让Apc突变型小鼠模型肠癌负担与未感染对照组相当,还可以让小鼠肠道免疫环境正常化。
三联疗法可以预防肠癌的发生,恢复肠道免疫稳态
总的来说,Gerhard团队认为,以上观察结果表明,幽门螺杆菌通过塑造肠道免疫反应,诱导肠道微生物群和上皮细胞平衡的深刻变化,直接促进结肠癌的发生。
实验到此,最关键的问题是,上面发现的过程在人体内是不是存在。
为了回答这个问题,Gerhard团队分析了154个人类结肠组织样本的免疫特征。
他们发现,与未感染者相比,幽门螺杆菌感染者的结肠表现出更高的CD3+T细胞浸润,结肠上皮中的Tregs细胞几乎消失,STAT3阳性上皮细胞数量较多,产生粘液的细胞丢失。这些现象在根除治疗的患者肠道中有所缓解。此外,在幽门螺杆菌阳性患者中,与肠癌相关的Prevotellaceae和Peptostreptococcales的丰度发生了变化。
这说明,幽门螺杆菌感染在小鼠肠道中诱发的免疫、上皮特征和微生物组变化,在人体内也存在,进一步坐实了幽门螺杆菌感染和肠癌之间的因果关系。更重要的是,这个研究说明根除幽门螺杆菌感染,有望成为预防肠癌的新策略。
不过这个研究也留下了一个问题。Gerhard团队虽然观察到了幽门螺杆菌感染对肠道的影响,但是并没有搞清楚定植在胃部的幽门螺杆菌究竟是如何远程影响肠癌发生的。解开这个问题,或许能给肠癌的防治带来更多的新思路。
期待Gerhard团队的后续研究。
参考文献:
[1].Ralser A, Dietl A, Jarosch S, et al. Helicobacter pylori promotes colorectal carcinogenesis by deregulating intestinal immunity and inducing a mucus-degrading microbiota signature. Gut. 2023. doi:10.1136/gutjnl-2022-328075
[2].Gravina AG, Zagari RM, De Musis C, Romano L, Loguercio C, Romano M. Helicobacter pylori and extragastric diseases: A review. World J Gastroenterol. 2018;24(29):3204-3221. doi:10.3748/wjg.v24.i29.3204
[3].Zuo Y, Jing Z, Bie M, Xu C, Hao X, Wang B. Association between Helicobacter pylori infection and the risk of colorectal cancer: A systematic review and meta-analysis. Medicine (Baltimore). 2020;99(37):e21832. doi:10.1097/MD.0000000000021832
[4].Kim TJ, Kim ER, Chang DK, et al. Helicobacter pylori infection is an independent risk factor of early and advanced colorectal neoplasm. Helicobacter. 2017;22(3):10.1111/hel.12377. doi:10.1111/hel.12377
[5].Shi Y, Liu XF, Zhuang Y, et al. Helicobacter pylori-induced Th17 responses modulate Th1 cell responses, benefit bacterial growth, and contribute to pathology in mice. J Immunol. 2010;184(9):5121-5129. doi:10.4049/jimmunol.0901115
[6].Nguyen AV, Wu YY, Liu Q, et al. STAT3 in epithelial cells regulates inflammation and tumor progression to malignant state in colon. Neoplasia. 2013;15(9):998-1008. doi:10.1593/neo.13952
[7].Guo Y, Zhang Y, Gerhard M, et al. Effect of Helicobacter pylori on gastrointestinal microbiota: a population-based study in Linqu, a high-risk area of gastric cancer. Gut. 2020;69(9):1598-1607. doi:10.1136/gutjnl-2019-319696
[8].Wirbel J, Pyl PT, Kartal E, et al. Meta-analysis of fecal metagenomes reveals global microbial signatures that are specific for colorectal cancer. Nat Med. 2019;25(4):679-689. doi:10.1038/s41591-019-0406-6
文章来源:奇点网