艾滋病的治疗,又取得突破性进展。
近日,由美国威尔康奈尔医学院Jingmei Hsu等领衔的研究团队,在顶级期刊《细胞》上报道了全球第一例,接受CCR5Δ32/Δ32干细胞移植后艾滋病得到缓解的混血女性病例(“纽约病人”)[1]。
这也是继“柏林病人”[2]、“伦敦病人”[3,4]和“杜塞尔多夫病人”[5]之后,全球第4例以研究论文形式报道的干细胞移植缓解HIV-1感染的病例。
值得一提的是,与前三位治愈者采用的成人骨髓造血干细胞移植不同,“纽约病人”移植的干细胞来自于脐带血,这也是脐带血干细胞首次成功帮助艾滋病患者摆脱HIV-1。
由于在全球范围内脐带储存相对较多,且更容易配型,因此这一新方法有望让更多的HIV-1感染者获益。
论文首页截图
统计数据显示,在2021年,全球有约3840万HIV-1感染者(PLWH),65万人死于艾滋相关的疾病[6]。
一直以来,感染HIV-1被视为不能治愈的疾病,因为HIV-1潜伏在长寿的、静止的记忆CD4阳性T细胞中[7]。抗逆转录病毒治疗(ART)一旦停止,潜伏的病毒就会伺机而动,因此HIV-1感染者必须终身接受治疗。
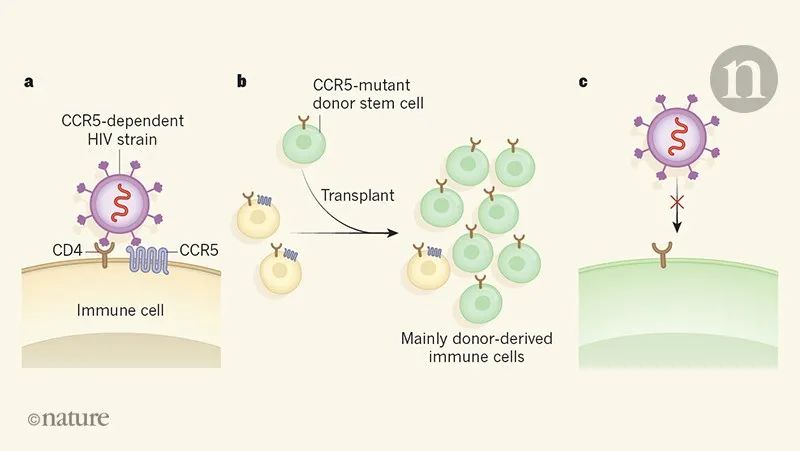
近年来,科学家发现CD4阳性T细胞表面的CCR5是HIV-1入侵的关键受体,而且携带CCR5Δ32/Δ32功能缺失突变的人,对HIV-1有天然的抵抗力。
“柏林病人”、“伦敦病人”和“杜塞尔多夫病人”的案例表明,给因其他疾病需要移植造血干细胞的HIV-1感染者移植CCR5Δ32/Δ32干细胞,可以根除感染者体内的HIV-1潜伏储藏库,让患者对HIV-1产生免疫力,最终实现疾病的缓解甚至实现临床治愈[8]。
干细胞移植治疗HIV-1感染示意图[9]
遗憾的是,基因型为CCR5Δ32/Δ32的人非常少,而且鲜有捐献登记机构给成人干细胞捐献者进行这种突变的检测,再加上配型成功的概率也不高,因此CCR5Δ32/Δ32成人干细胞移植非常罕见。
Hsu等领衔的这个临床研究,将脐带血干细胞作为突破口。因为与成人造血干细胞相比,脐带血干细胞对配型的要求更低,而且出现移植物抗宿主病的风险也较低。因此,对于不同种族的HIV-1感染者来说,脐带血可能是一种更好的供体干细胞。
在介绍患者治疗过程之前,有必要介绍下国际母婴青少年艾滋病临床试验网络(IMPAACT) P1107研究[10]。这是一项观察性临床试验,研究对象是年龄大于12个月、且因基础疾病(血液恶性肿瘤等)需要接受异体干细胞移植治疗的HIV-1感染者。研究使用的CCR5Δ32/Δ32脐带血干细胞来自于脐带血库StemCyte。
左:Koen Van Besien,中:Jingmei Hsu,右:Marshall Glesby(图源:威尔康奈尔医学院)
在Hsu团队报告研究结果时,有两位感染者参与了P1107研究。他们都接受了CCR5Δ32/Δ32脐带血干细胞移植,不过其中的中年男性感染者因基础疾病霍奇金淋巴瘤复发死亡,剩下的那名女性HIV-1感染者就是“纽约病人”。
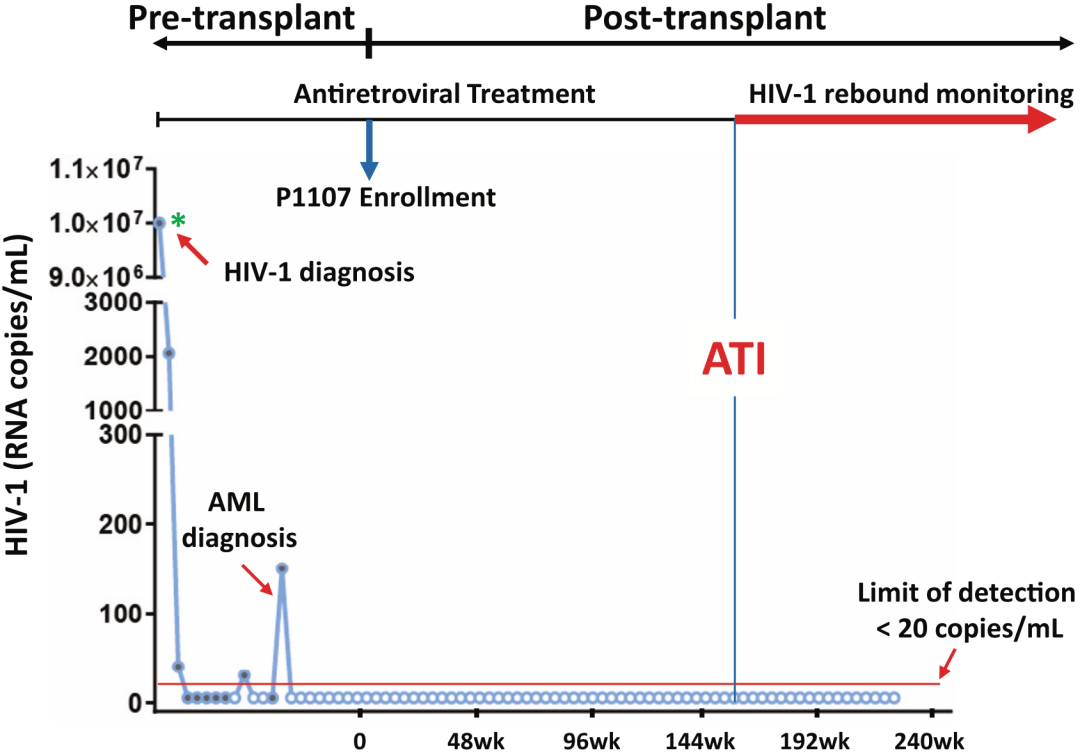
这名女性患者自认为是混血儿,由于血浆病毒载量高于临床检测定量上限(>1000000拷贝/毫升),被诊断为急性HIV-1感染。在接受抗逆转录病毒治疗的5个月后,她的血浆病毒载量降低到定量下限以下(<20拷贝/毫升)。
在确诊HIV-1感染的四年后,她又被诊断患有急性髓细胞性白血病(AML),因此她入组了P1107研究。Hsu和她的同事从StemCyte的数据库中,帮她确定了一个5/8 HLA匹配的CCR5Δ32/Δ32脐带血单位。此外,研究人员还帮助“纽约病人”匹配了具有野生型CCR5等位基因的成年亲属供体,以实施单倍体造血干细胞移植,促进脐带血干细胞移植的成功。
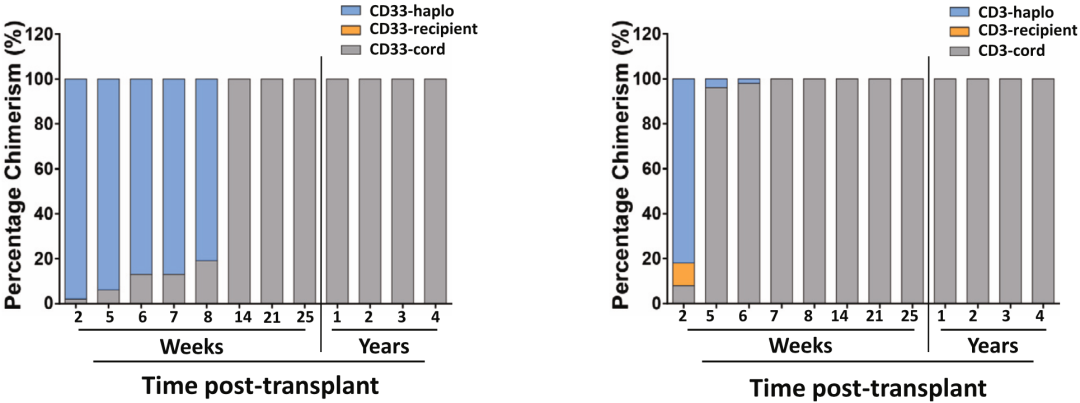
在2017年,“纽约病人”移植了从亲属外周血采集的CD34阳性细胞(造血干/祖细胞),然后移植了CCR5Δ32/Δ32脐带血干细胞。移植后2周,她血液中82%的淋巴细胞(CD3阳性)和98%的髓系细胞(CD33阳性)来自单倍体成人捐赠者;不过,到14周时,她血液中的淋巴细胞和髓系细胞就变成全部来自于CCR5Δ32/Δ32脐带血干细胞了。
移植后患者血液免疫细胞的动态变化
在移植后6个月,B细胞(CD19阳性)恢复到正常水平;到13个月,CD4和CD8阳性T细胞亚群和自然杀伤(NK)细胞(CD16/56阳性)恢复到正常水平,并一直保持正常。
经过研究讨论,“纽约病人”选择在移植后30个月中断抗逆转录病毒治疗方案,以评估HIV-1缓解和治愈的可能性。不过,由于新冠病毒大流行,研究人员担心不能及时监测HIV-1的动态,因此第一次抗逆转录病毒治疗中断只持续了13天。在移植后37个月,抗逆转录病毒治疗再次中断,在此后的18个月里,无法在患者体内检测到HIV-1 RNA。
因此,Hsu和她的同事认为,这一结果预示着HIV-1的缓解,以及这名患者有可能是被治愈了。
“纽约病人”的确诊、治疗和监测的全过程
需要指出的是,Hsu团队没有分析“纽约病人”的组织中是否还存HIV-1潜伏储藏库;然而,之前的一项研究发现,尽管血液的供体嵌合度为100%,但宿主来源的T细胞仍可在皮肤和组织中持续存在[11],因此很难评估这名患者终身缓解(治愈)的概率。
不过,这名患者的持续HIV-1缓解,仍意味着她有较大的治愈几率。虽然算上“纽约病人”之后,已经有4个HIV长期缓解的研究成果以论文的形式发布,但是异体干细胞移植仍然是一个复杂的过程,而且有复发和致命并发症的风险,因此目前应该只考虑给那些因患有其他威胁生命的疾病而需要移植的HIV-1感染者实施。
这个研究最大的意义在于,它证实了脐带血干细胞的治疗价值,意味着CCR5Δ32/Δ32脐带血干细胞疗法有可能给更多的HIV-1感染者带来治愈的希望。Hsu团队建议,全球的脐带血干细胞库都应积极筛查供体库中的这种突变的存在情况,因为这有可能会带来更多的治愈。
参考文献:
[1].Hsu J, Van Besien K, Glesby MJ, et al. HIV-1 remission and possible cure in a woman after haplo-cord blood transplant. Cell. 2023;186(6):1115-1126.e8. doi:10.1016/j.cell.2023.02.030
[2].Hütter G, Nowak D, Mossner M, et al. Long-term control of HIV by CCR5 Delta32/Delta32 stem-cell transplantation. N Engl J Med. 2009;360(7):692-698. doi:10.1056/NEJMoa0802905
[3].Gupta RK, Abdul-Jawad S, McCoy LE, et al. HIV-1 remission following CCR5Δ32/Δ32 haematopoietic stem-cell transplantation. Nature. 2019;568(7751):244-248. doi:10.1038/s41586-019-1027-4
[4].Gupta RK, Peppa D, Hill AL, et al. Evidence for HIV-1 cure after CCR5Δ32/Δ32 allogeneic haemopoietic stem-cell transplantation 30 months post analytical treatment interruption: a case report. Lancet HIV. 2020;7(5):e340-e347. doi:10.1016/S2352-3018(20)30069-2
[5].Jensen BO, Knops E, Cords L, et al. In-depth virological and immunological characterization of HIV-1 cure after CCR5Δ32/Δ32 allogeneic hematopoietic stem cell transplantation. Nat Med. 2023;29(3):583-587. doi:10.1038/s41591-023-02213-x
[6].https://www.unaids.org/sites/default/files/media_asset/UNAIDS_FactSheet_en.pdf
[7].Chun TW, Carruth L, Finzi D, et al. Quantification of latent tissue reservoirs and total body viral load in HIV-1 infection. Nature. 1997;387(6629):183-188. doi:10.1038/387183a0
[8].Ambinder RF, Capoferri AA, Durand CM. Haemopoietic cell transplantation in patients living with HIV. Lancet HIV. 2020;7(9):e652-e660. doi:10.1016/S2352-3018(20)30117-X
[9].Henrich TJ. Second example reported of a stem-cell transplant in the clinic leading to HIV remission. Nature. 2019;568(7751):175-176. doi:10.1038/d41586-019-00989-y
[10].https://www.impaactnetwork.org/
[11].Divito SJ, Aasebø AT, Matos TR, et al. Peripheral host T cells survive hematopoietic stem cell transplantation and promote graft-versus-host disease. J Clin Invest. 2020;130(9):4624-4636. doi:10.1172/JCI129965
文章来源:奇点网